对二氧化硫性质实验的改进
李 庆
(吴江平望中学 江苏 吴江 215221)
二氧化硫的性质是高中化学重要的元素化合物知识,考虑到二氧化硫气体是一种有毒气体,在敞开的环境下进行,易造成SO2扩散,污染教室环境,严重威胁了师生的健康。故现行教材中直接涉及SO2气体的实验安排的很少,而且大部分都改用SO2的水溶液代替,但是这样就免不了因为亚硫酸而带来一定的异议。为此,笔者对二氧化硫的性质实验进行了优化和改进。
一、实验用品
实验仪器:培养皿、表面皿、三角漏斗、胶头滴管、乳胶管
实验试剂:无水亚硫酸钠、70%浓硫酸、pH 试纸、浸有酸性KMnO4溶液的滤纸、浸有品红溶液的滤纸、NaOH 溶液
二、实验装置
实验装置如图所示。
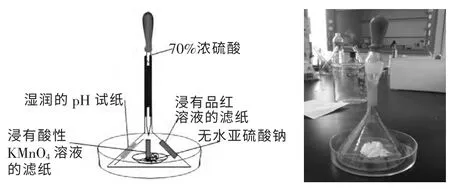
三、实验操作及现象
1.如上图组装实验仪器:将胶头滴管和漏斗尖端用橡胶管连接, 分别将湿润的pH 试纸、浸有酸性KMnO4溶液的滤纸、浸有品红溶液的滤纸粘贴在漏斗内壁; 在表面皿上放少许无水亚硫酸钠固体粉末,置于培养皿中间;再在漏斗边缘涂上凡士林,倒扣在表面皿上方并按紧。
2.轻轻挤压胶头滴管,使70%浓硫酸慢慢滴入无水亚硫酸钠中, 可以清晰的观察到湿润的pH 试纸变红色,证明SO2气体溶于水产生酸性物质H2SO3,浸有酸性KMnO4溶液的滤纸迅速褪色, 浸有品红溶液的滤纸慢慢褪色(如图1)。
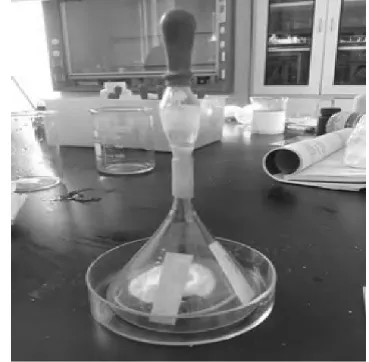
图1

图2
3.当反应停止以后,用胶头滴管吸4 滴管NaOH溶液滴入培养皿中, 轻摇使漏斗松动, 会发现NaOH溶液被倒吸入漏斗中,造成负压,可以整体提起实验装置,证明NaOH 溶液可以和SO2气体反应,可以用其来吸收SO2气体。
4.取下漏斗,将两片褪色的的滤纸分别放在两只试管中,加少量蒸馏水,在酒精灯上加热,很快可以发现浸有品红溶液的滤纸恢复红色,而浸有酸性KMnO4溶液滤纸无明显变化。证明SO2气体具有漂白性可使品红褪色, 且是暂时性漂白, 与HClO 的漂白原理不同;而与酸性KMnO4溶液的反应不是漂白性,是还原性,发生了是氧化还原反应。(如图2)
四、改进实验的优点和注意事项
1.优点
(1)实验微型化,所用试剂量很少,产生SO2气体的量也少,不会对环境有危害。
(2)仪器设备简单、操作简便,实验现象快速明显,且可以起到性质对比学习。
(3)该装置可以推广到高锰酸钾和浓盐酸制备并进行氯气的性质实验。
2.注意事项
(1)挤压胶头滴管使浓硫酸均匀滴下,不要一次性将浓硫酸全部压出,以免造成短时间产生气体太多。
(2)胶头滴管应选用细长的,尖端不要碰到橡胶管和漏斗内壁。

