测定大理石与盐酸反应速率实验的改进
李嘉
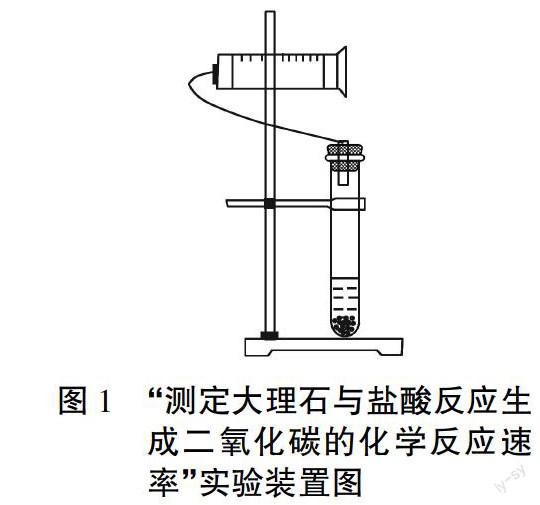

摘要:利用洗瓶作为反应容器,并辅以电子天平来测量排出溶液的质量换算出生成二氧化碳的体积,能准确、直观地测量出大理石和盐酸反应速率,配合使用Excel软件绘制出大理石和盐酸反应速率曲线,使学生了解浓度对化学平衡的影响。
关键词:大理石;盐酸;洗瓶;电子天平
文章编号:1008-0546(2015)03-0090-02 中图分类号:G633.8 文献标识码:B
“测定大理石与盐酸反应生成二氧化碳的化学反应速率”实验室上科版高一下6.1中第一课时的一个重要的学生实验。实验时、将装有大理石和盐酸的试管与针筒相连,随着反应的不断进行,试管内不断产生的二氧化碳,同时针筒的示数也不断增大(如图1),其示数即生成二氧化碳的体积。学生每隔一段时间记录针筒的示数,最后利用数据作图,即可得到相应的反应速率。[1]但在实际实验过程之中,学生得到实验数据并不理想,除了仪器气密性和碳酸钙颗粒的大小和多少等影响因素之外,主要还是因为针筒的活塞有一定的静摩擦力,也导致实验刚开始的时候活塞并不一定能够移动,而且移动的过程是往往有点跳跃造成了数据的不准。为了能让学生更准确地了解化学反应速率的含义,笔者对这个实验进行了如下改进。
一、实验方案的设计方案与装置改进
在测量质量、体积、物质的量的等衡量物质多少的物理量当中以测量质量最为便捷,准确。因为蒸馏水的密度为1g/mL,即1g水的体积为1mL,通过测量排水的质量多少就可得知反应器中生成的气体体积,连续测量单位时间内排除水的质量并换算成生成气体体积就能准确得到化学反应速率与时间的关系图。因此笔者决定使用实验室常见的洗瓶做为反应的容器,通过测量单位时间内排出的饱和碳酸氢钠溶液的重量,换算出生成的二氧化碳的体积,并通过Excel做出相应的速率曲线。
先用酒精灯加热铜丝,趁热将铜丝在洗瓶的盖子上戳两个小洞,再用铜丝固定住口径25mm的试管,穿过洗瓶盖子置于洗瓶中,另外将一只10mL的针筒穿过洗瓶盖子,针头下方对准试管,盖上洗瓶的盖子,使用热熔胶枪将两个小洞封住,保持洗瓶的良好的气密性,再用比重计测量当前室温下饱和碳酸氢钠溶液的密度为1.06g/mL通过V=m/ρ换算出生成的二氧化碳的体积。实验中使用的电子天平量程为200g,精度为0.001g(亦可使用药物天平代替)。
二、实验仪器以及试剂
块状大理石、2mol/L HCl、1mol/L HCl、0.5mol/L HCl、电子天平、电子秒表、洗瓶、铜丝、250mL烧杯。
三、实验操作步骤
(1)先称取约10g的块状大理石,加入到洗瓶中的试管内,再用针筒吸取10mL的2mol/L HCl,将一个250mL的烧杯置于电子天平上并去皮,使示数为0.000g。
(2)将洗瓶的喷嘴对准电子天平上的烧杯,轻轻推动针筒的拉杆将10mL的2mol/L HCl注入到洗瓶中的试管内。
(3)片刻之后,每隔5s记录下电子天平的读数。
(4)将测得的数据换算成生成二氧化碳的体积,填入Excel表格之中,绘制出生成二氧化碳的速率图
(5)实验结束之后可将250mL烧杯中的饱和碳酸氢钠溶液倒回洗瓶中。
(6)取针筒吸取10mL的1mol/L HCl,同样称取约10g的块状大理石置于试管内,重复进行上述实验步骤。
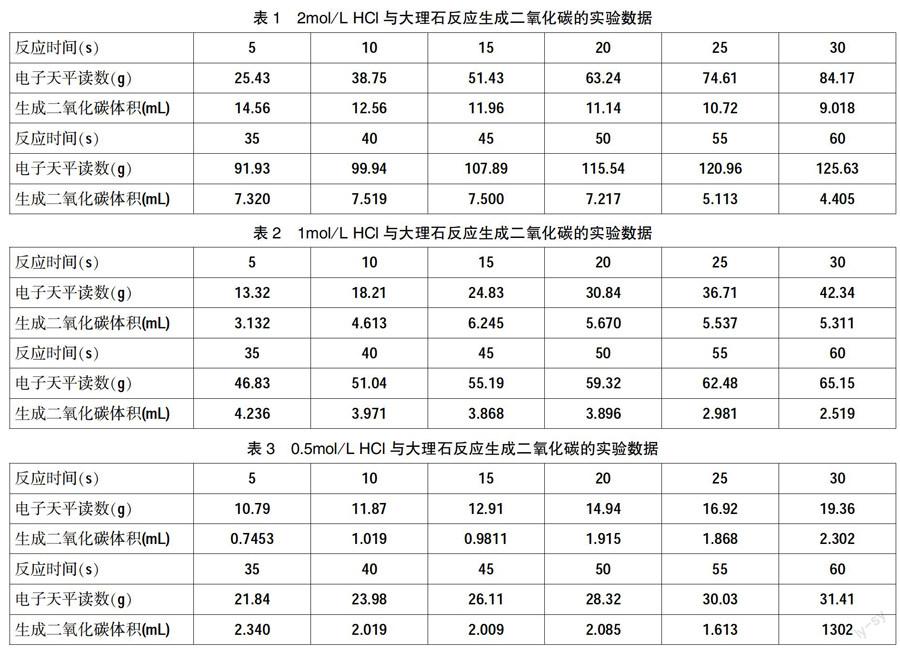
四、实验数据及其处理
上述实验所得实验数据如下表1-3。
将所得数据导入Excel生成的速率曲线如图3所示:
五、实验结果讨论
(1)利用洗瓶作为反应容器,并辅以电子天平来测量排出溶液的质量,可以准确、直观地测量出大理石和盐酸反应速率,数据处理也较为便捷。
(2)对比三组实验数据导入Excel后所绘制出的图像,可以明显观察到增加反应物的浓度,可以明显增大化学反应速率,且随着反应的进行反应体系中的盐酸浓度下降了,化学反应速率也随之下降了,可以让学生了解到浓度是影响化学反应速率的重要因素。
(3)此套装置还可以方便地运用到催化剂和温度对化学平衡的影响的实验中(例如过氧化氢分解速率的研究),同样适合学生分组实验通过观察数据化的实验现象,来关注实验中的量的变化从而学会分析和处理数据,加深学生对化学平衡的理解。
参考文献
[1] 姚子鹏,陈基福,洪东府等.化学(高中一年级第二学期)[M].上海:上海科学技术出版社,2007:33~62

