铜氨溶液配制的全方位探究*
嵇雷高
(江苏省郑梁梅高级中学 江苏 涟水 223499)
一、问题提出
从可见的文献中发现,铜氨溶液的配制目前有两种方法:
一种是沉淀剂用氢氧化钠,即在硫酸铜溶液中加氢氧化钠溶液,待生成氢氧化铜沉淀后再加氨水生成铜氨溶液。如1980年人教版《全日制十年制学校高中课本》第二册P78、1985年人教版《高中化学甲种本》第三册P6、1993年人教版 《高中化学读本》 第二册P111:在盛有硫酸铜溶液的试管里滴入少量氢氧化钠的溶液,生成蓝色的氢氧化铜沉淀;然后滴入适量浓氨水,沉淀消失,得到深蓝色的溶液。再滴入少量氢氧化钠溶液,深蓝色溶液不发生变化,不再生成氢氧化铜沉淀。如果把这种深蓝色溶液浓缩结晶,就可以得到一种深蓝色的晶体,即硫酸四氨合铜,也叫硫酸铜氨。2004年苏教版《有机化学基础》P94:向烧杯中加入5%的硫酸铜溶液, 再加入10%的氢氧化钠溶液至沉淀完全,静置片刻后,倒去上层清液。用浓氨水溶解得到的氢氧化铜沉淀,以获得较高浓度的铜氨溶液。
另一种是沉淀剂用氨水,即在硫酸铜溶液中直接滴加氨水,先生成氢氧化铜沉淀,继续滴加氨水生成铜氨溶液。如2004年人教版《物质结构与性质》P44:向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物氢氧化铜,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体,即[Cu(NH3)4]SO4·H2O。
2004年苏教版《物质结构与性质》P68、2009年华东师大版《高中化学》下册P155:
①向试管中加入2mL5%的硫酸铜溶液, 再逐滴加入浓氨水,边滴加边振荡,发现在天蓝色溶液中滴加氨水,先产生蓝色沉淀,沉淀逐渐增多,继续滴加氨水,沉淀溶解,得到深蓝色溶液。如果把这种深蓝色溶液浓缩或用酒精处理后,还可以得到一种深蓝色的晶体,即硫酸四氨合铜,也叫硫酸铜氨。
②把上述实验中的硫酸铜换成氯化铜、硝酸铜再做实验, 发现现象也是在天蓝色溶液中滴加氨水,先产生蓝色沉淀,沉淀逐渐增多,继续滴加氨水,沉淀溶解,得到深蓝色溶液。说明硫酸根离子、氯离子和硝酸根离子的存在对于铜氨配离子的生成没有影响或影响较小。
③将实验①中所得溶液分成两份,一份滴加氢氧化钠溶液,试管中无现象。另一份滴加氯化钡溶液,试管中有白色沉淀生成。
另外, 不少高校教科书也是用氨水做沉淀剂的,如天津大学杨秋华主编的2012年高等教育出版社出版的《无机化学实验》P106、安徽工程大学吴之传主编的2012年化学工业出版社出版的 《工科化学实验》P55、黑龙江农垦职业学院卢建国主编的2005年清华大学出版社出版的《基础化学实验》P59、河北大学李志林等编著的2007年化学工业出版社出版的 《无机及分析化学实验》P106、刘约权等主编的1999年高等教育出版社出版的《实验化学》P159、吴茂英等主编的2012年化学工业出版社出版的 《微型无机化学实验》第二版P115。
按常规理解,不管用氢氧化钠还是用氨水做沉淀剂,都应生成氢氧化铜沉淀:
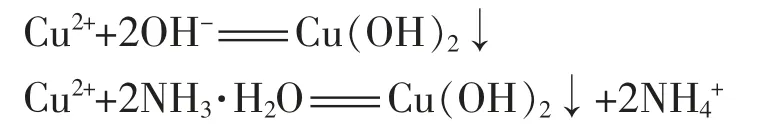
再往两种含有氢氧化铜沉淀的溶液中逐滴加氨水,发生下列反应:
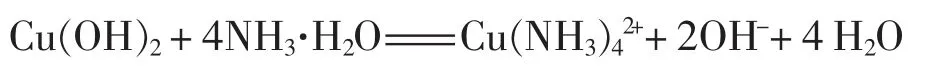
但在实验中笔者发现,用氨水作沉淀剂得到的氢氧化铜沉淀较易和氨水反应得到澄清的深蓝色溶液;而用氢氧化钠作沉淀剂得到的氢氧化铜沉淀不易和氨水反应得到澄清的深蓝色溶液, 即使是用了过量5-6 倍的氨水,溶液还是浑浊,仍不能得到澄清的深蓝色溶液。这是什么原因呢?
二、定性分析
实际上氢氧化铜与氨水的反应相当于复分解反应。而复分解反应发生的条件是有沉淀、气体和难电离物质之一生成。此三个条件中有一个的复分解反应就可以发生,若有两个或三个时,则更有利于复分解反应的发生。我们回过头来看,用氢氧化钠作沉淀剂与硫酸铜反应生成氢氧化铜沉淀的同时溶液中还有Na+和SO42-,这对氢氧化铜与氨水反应应没有什么影响,那么是不是氢氧化铜在氨水中的溶解度不大。而用氨水作沉淀剂与硫酸铜反应生成氢氧化铜沉淀的同时溶液中还有NH4+和SO42-, 而在氢氧化铜和氨水反应生成Cu(NH3)42+的同时又释放出OH-,它和原先在溶液中的NH4+结合生成弱电解质NH3·H2O 而促进了平衡的移动。也就是后者多了一个反应发生的推动力。
三、定量分析
本来笔者想用吉布斯自由能作定量分析的,但笔者手头的数据找不全,所以只能用多重平衡原理讨论其反应的可能性。
1.用氢氧化钠作沉淀剂制铜氨溶液
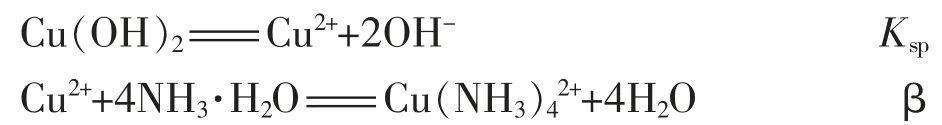
K=Kspβ=2.2×1012×2.3 ×10-20=5.06×10-8
平衡常数这么小,表示氢氧化钠作沉淀剂的氢氧化铜不易和氨水生成Cu(NH3)42+,相反其逆反应(平衡常数为1.98×107)倒是容易进行得比较完全。这从理论上验证了笔者在定性分析中提到的氢氧化铜在氨水中的溶解度不大的推想。
2.用氨水作沉淀剂制铜氨溶液
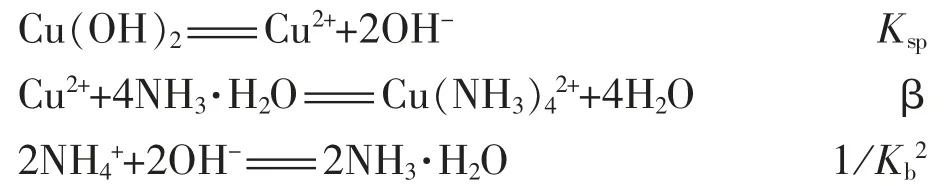
K=Kspβ/Kb2=2.2×1012×2.3×10-20/(1.8×10-5)2=1.56×102
平衡常数较大,表示氨水作沉淀剂的氢氧化铜较易和氨水生成Cu(NH3)42+。
四、实验佐证
把那份不澄清的溶液(即用NaOH 作沉淀剂的那份)分盛于两支试管,往其中一支试管里依次加少量(NH4)2SO4溶液, 另一支试管则留作比较。实验现象是:加少量(NH4)2SO4溶液的试管中的溶液很快变成澄清的深蓝色溶液。如果把(NH4)2SO4溶液换成NH4Cl溶液、NH4NO3溶液、CH3COONH4溶液重复上述实验,现象相同,这就表明确实是NH4+起了作用。从化学平衡移动规则考察此实验,只要有NH4+和OH-就会结合成NH3·H2O,而不必考虑NH4+是原先存在于溶液中的还是外加的。既然是NH4+在起作用, 那么如果降低CuSO4和NH3·H2O 反应体系中NH4+的含量[用水洗涤Cu(OH)2沉淀即达目的]后,再滴加NH3·H2O,其现象应该是不容易得到澄清液。取CuSO4和适量NH3·H2O混合得Cu(OH)2沉淀,离心分离,用蒸馏水洗涤沉淀3-4 次[此举即使不能洗净NH4+,但可使Cu(OH)2中NH4+量明显下降是确定无疑的], 而后往沉淀上加NH3·H2O,不易得到澄清液。此时,若再加入铵盐,溶液又变得澄清了。
由上述实验现象可确知, 有无足量NH4+将对Cu(OH)2和NH3·H2O 间反应起“决定性”作用。顺便提及: 无机合成中制备氨络离子常需加适量铵盐,应该说和这个因素有关。另外吉林大学宋天佑先生编的2012年高等教育出版社出版的《无机化学教程》P574也有记载:“在有大量铵离子存在时,氢氧化铜溶于氨水形成配位化合物氢氧化四氨合铜(Ⅱ)”。但笔者认为,外界可能不是OH-,而是与NH4+结合的阴离子,因为
五、几点说明
1.铜氨溶液的配制不要用氢氧化钠做沉淀剂,而直接使用氨水做沉淀剂。这样不仅药品种类少而且实验容易成功。
2.关于铜氨溶液的配制,在很多教科书上没有注明试剂的浓度和用量,实际实验时有点盲目,需要探讨试剂的浓度和用量。笔者建议,不仅仅是这个实验,其它实验都要注明试剂的浓度和用量。对铜氨溶液的配制,最好表述成“取一支试管,加入0.2mol/L CuSO4溶液4mL,逐滴加入6mol/L NH3·H2O,边加边振荡,待生成的沉淀完全溶解为止,观察现象,写出有关反应的化学方程式。”
3.用氨水作沉淀剂配制铜氨溶液的有关方程式
2004年人教版 《物质结构与性质》P44 给出的离子方程式是:

但这样的写法笔者认为不对。应写成:
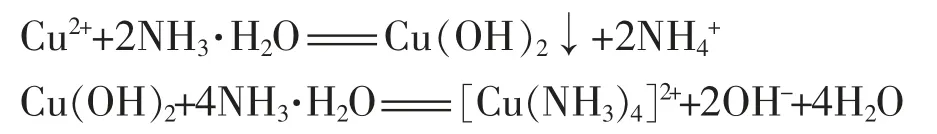
而前后生成的OH-和NH4+又反应生成了NH3·H2O,所以总的离子方程式为
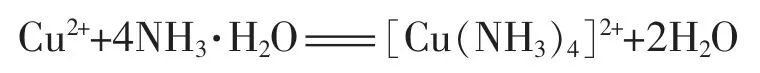
这也就很好地解释了教科书中为什么加入乙醇后,析出的晶体是[Cu(NH3)4]SO4·H2O,而不是[Cu(NH3)4](OH)2的事实。
4.在反应体系中有H+与弱酸根离子或OH-与弱碱阳离子时,不管它们是原先加入的还是反应过程中生成的(生成了这些离子往往不那么一目了然而易被人们忽视),必须考虑生成弱电解质,这些隐形反应往往不引起人们的注意。这方面的例子很多。
例如常规浓度时Ca2+与HCO3-在溶液中不能大量共存,也是因为Ca2+与HCO3-反应中,生成CaCO3的同时释放出的H+与HCO3-结合成H2CO3(H2CO3当然还要分解,更促进反应的发生),也是生成弱电解质沉淀的生成。如若不然,则Ca2+与HCO3-不可能生成沉淀。
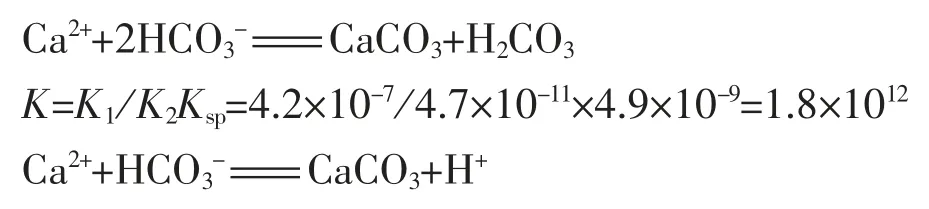
K=K2/Ksp=4.7×10-11/4.9×10-9=9.6×10-3
5.中学教科书和不少大学教科书都认为,硫酸铜与氢氧化钠溶液或氨水反应会生成氢氧化铜沉淀,现在也有不少学者认为是生成碱式硫酸铜或氢氧化铜和碱式硫酸铜的混合物,但这不影响我们的讨论。如碱式硫酸铜用xCuSO4·yCu(OH)2表示,则硫酸铜与氨水反应的离子方程式为
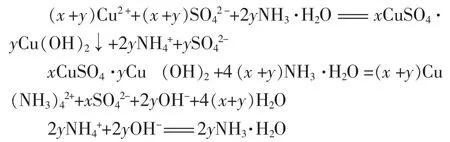
在整个反应中生成的NH4+和OH-的物质的量相同,互相反应生成NH3·H2O。由此可以看出,前面用氢氧化铜来讨论而得到的结论同样适用于碱式硫酸铜与氨水的反应。
[1]严宣申.化学实验的启示与科学思维的训练[M].北京:北京大学出版社,1993:26~31
[2]茆建军.氢氧化铜与氨水反应的实验探究[J].化学教育,2006,(6):55
[3]徐元媛.铜氨纤维的制备方案 [J].中学化学教学参考,2010,(4):45~46
[4]施先义.氨性硫酸铜溶液离解平衡的探讨[J].大学化学,2010,(8):75~77
[5]大连理工大学.无机化学 [M].北京: 高等教育出版社,2006:691~692

