稻壳基磁性介孔SiO2的改性及其性质表征
赵秀平 王 韧 王 莉 周蕴宇 陈正行 黄 鑫
(粮食发酵工艺与技术国家工程实验室食品科学与技术国家重点实验室江南大学食品学院1,无锡 214122)(无锡中粮工程科技有限公司2,无锡 214122)
黄曲霉毒素(aflatoxin,AFT)是黄曲霉(Aspergillus flavus)和寄生曲霉(A.parasiticus)等真菌产生的次级代谢产物[1]。目前已分离和鉴定的黄曲霉毒素有 20 多种,常见的有 AFB1、AFB2、AFG1、AFG2、AFM1、AFM2等几种。国际癌症研究机构于1993年将黄曲霉毒素划定为I类致癌物,其中AFB1被公认为致癌力最强的物质[2]。黄曲霉毒素对热稳定,100℃下20 h也不被破坏,只有加热到280℃以上时才能发生裂解[3-4]。黄曲霉毒素的存在范围广,是发展中国家食品中常见的污染物之一,极易污染花生、玉米、小麦、大米等农产品,是危及食品安全和人类健康的主要因素[5-6]。周闯等[7]对全国的饲料及原料中AFB1等霉菌毒素的污染情况进行了调查,结果发现霉菌污染情况严重,检出率高达66.21%,超标率高达27.75%;AFB1污染情况严重,最高值达488.86μg/kg,高出国家标准近25倍[8]。因此,如何防治和脱除食品中的 AFB1一直受到人们的广泛关注。
目前,脱除黄曲霉毒素的方法主要有化学法、生物法和物理法[9]。物理法是采用溶剂萃取、辐射和吸附等方法除去原料中的黄曲霉毒素;其中,吸附法研究最为广泛。吸附法是利用多孔的吸附材料(如沸石、活性硅藻土、膨润土和蒙脱土等)与黄曲霉毒素作用形成惰性且不被动物体吸收的复合物,从而去除黄曲霉毒素的方法,已得到实际应用[10-12]。但因为吸附材料与物料无法分离,导致如下缺陷:1)吸附材料只能一次性使用,资源浪费;2)被吸附的毒素在体内可能发生部分解吸而造成危害;3)已有吸附材料缺乏特异性,毒素和一些营养素同时吸附。为此,针对吸附材料缺陷的研究一直成为研究热点。
磁性介孔材料作为一种新型功能复合材料,已成为众多领域的一个研究方向。目前,磁性介孔材料的主要应用领域有:重金属离子(Hg2+、Pb2+)及有机污染物(DDT)等的污水处理领域,蛋白质、DNA分离、靶向药物载体等生物医学领域及加氢催化剂、纳米贵金属催化、光催化等催化领域[13-15],鲜有关于其对AFB1脱除的研究。此外,我国是水稻王国,稻壳是稻米加工中的副产物,直接燃烧利用价值不高,且污染环境。若能够对稻壳加以综合利用,这样不仅解决了稻壳的污染,同时也充分利用了资源。基于稻壳的广泛存在且磁性介孔材料具有潜在的良好吸附、分离特性,因此,以稻壳为硅源制备廉价且高效、易分离的磁性介孔材料对于脱除粮油等液态食品中的AFB1具有很高的研究价值。
1 材料与方法
1.1 材料与仪器
稻壳:中粮(江西)米业;AFB1标品(纯度 >99.0%):Alexis公司;十六烷基三甲基溴化铵(CTAB)、三甲基苯(TMB))、γ-氨丙基三乙氧基硅烷(APTES)、乙醇、三氟乙酸、正己烷、水合肼、七水合硫酸亚铁、六水和氯化铁(分析纯):国药集团化学试剂有限公司;乙腈(色谱纯):江苏汉邦科技有限公司。
LXJ-Ⅱ型离心沉淀机:上海医用分析仪器厂;箱式电阻炉:上海实验环境试验设备厂;TGA/SDTA851e:梅特勒-托利多仪器有限公司;JW-BK静态氮吸附仪:北京精微高博科学仪器有限公司;DCY-12G海科氮吹仪:青岛海科仪器有限公司;D8型X射线衍射仪:德国布鲁克AXS有限公司;Nicolet iS10傅里叶红外变换光谱仪:美国赛默飞公司;Agilent 1260 Infinity(荧光检测器,激发波长200~700 nm,发射波长280~900 nm):Agilent公司。
1.2 试验方法
1.2.1 磁性介孔SiO2(MMS)的改性
1.2.1.1 工艺流程及关键步骤
NMMS制备工艺流程见图1。
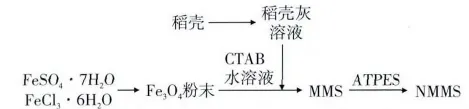
图1 NMMS制备工艺流程图
1)稻壳灰溶液制备 将稻壳淘洗3次,干燥后粉碎,用2 mol/L HCl浸煮2 h,离心弃上清,沉淀用蒸馏水洗涤3次,50℃干燥后于马弗炉中550℃煅烧5 h,得到白色粉末。准确称取所得白色粉末与NaOH固体(m/m,3.1/4.0)14.2 g,用250 mL蒸馏水加热溶解,所得溶液即为稻壳灰溶液。
2)MMS制备 参考Hong等[16]的制备方法,采用添加还原剂法制备Fe3O4磁性纳米颗粒,待用。将0.75 g CTAB溶于100 mL蒸馏水中,添加0.58 mL TMB及0.2 g磁性纳米颗粒,超声波处理使磁性颗粒均匀分散,80℃机械搅拌;快速加入50 mL预先制备的稻壳灰溶液,滴加2 mol/L HCl调pH至11.0,继续搅拌2 h,80℃陈化24 h,离心弃上清,沉淀用无水乙醇和蒸馏水洗涤3次,50℃干燥,550℃焙烧6 h去除模板剂,所得粉末即为磁性介孔SiO2(MMS)。
3)MMS氨基改性[17]将0.5 g MMS样品分散与80 mL甲苯溶液中,再加入APTES,不断加热(含冷凝回流)并搅拌;反应后,离心取沉淀,无水乙醇洗涤3次,50℃干燥,得到氨基改性磁性介孔SiO2(NMMS)。
1.2.1.2 单因素试验
在MMS氨基改性的过程中,以氨基接枝率为指标,考察搅拌时间、温度及料液比(m/m)对氨基接枝率的影响,探索NMMS制备的最佳工艺条件,每组试验重复3次,采用热重分析(TGA)法测定氨基接枝率,计算式:

式中:m为样品总量;m1为50~150℃样品失重量;m2为200~800℃样品失重量。
1.2.2 性质表征
磁场分离法:将NMMS样品分散于蒸馏水中,用磁铁对该样品富集,检测其分离效果;红外光谱法:采用KBr压片法,波数范围4 000~400 cm-1,分析样品中含有的基团,检测氨基是否接枝成功;X射线衍射法:Cu靶Kα射线,λ=0.154 nm,工作电压为40 kV,电流为 40 mA,扫描范围 2θ =1°~80°扫描步长0.02(°)/s,分析样品的物相;静态氮吸附法:200℃脱气2.5 h,-197℃测定吸附等温线,采用BET和BJH法计算孔径和比表面积。
1.2.3 AFB1的吸附试验
将AFB1用乙腈(分析纯)配制成1μg/mL的标准液,分别取10 mg NMMS和MMS样品于10 mL离心管中,加入1 mL的AFB1标准液,再添加超纯水至5 mL,置于摇床中(25℃,200 r/min)震荡2 h,8 000 r/min离心10 min,取1 mL上清液,根据 GB/T 5009.23—2006《食品中黄曲霉毒素 B1、B2、G1、G2的测定》[18]采用高效液相色谱法测得上清液中AFB1的浓度为c,得到NMMS对AFB1的脱除率,计算公式:
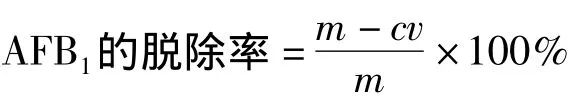
式中:m为 AFB1初始含量/μg;c为上清液中AFB1质量浓度/μg·mL-1;v为吸附体系总体积/mL。
1.2.4 试验数据分析
试验重复3次,采用Excel 2013和OriginPro 9.0作图,并采用SPSS17.0进行ANOVA方差分析(Tukey分析均值差异的显著性,显著水平P≤0.05)。
2 结果与讨论
2.1 单因素试验
2.1.1 搅拌时间对氨基接枝率的影响
在图1的MMS氨基改性过程中,以料液比1∶3加入APTES,80℃下不断搅拌,制备NMMS,考察搅拌时间对氨基接枝率的影响,结果如图2所示。由图2可知,搅拌时间对氨基接枝率的影响显著;当搅拌时间在4~10 h范围内,随着搅拌时间的延长,氨基接枝率明显提高;在10 h时,氨基接枝率达到最大值(13.30±0.2)%;当搅拌时间超过10 h,随着搅拌时间的延长,氨基接枝率无明显变化。因此,选用搅拌时间10 h较为合适。

图2 搅拌时间对氨基接枝率的影响
2.1.2 温度对氨基接枝率的影响
在图1的MMS氨基改性过程中,以料液比1∶3加入APTES,不断加热搅拌10 h,制备NMMS,考察加热温度对氨基接枝率的影响,结果如图3所示。由图3可知,加热温度对氨基接枝率的影响较大;当加热温度在25~80℃范围内时,随着温度的升高,氨基接枝率明显提高;在80℃时达到(13.33±0.21)%;当温度高于80℃时,随着温度的升高,氨基接枝率增长缓慢,基本无明显变化。因此,80℃为最适合成温度。
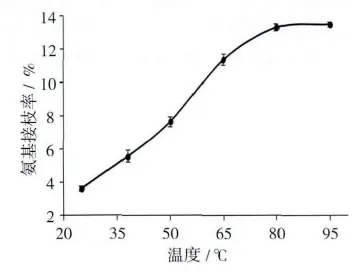
图3 温度对氨基接枝率的影响
2.1.3 料液比对氨基接枝率的影响
在图1的MMS氨基改性过程中,按一定料液比加入APTES,80℃不断搅拌10 h,制备 NMMS,考察料液比对氨基接枝率的影响,结果如图4所示。由图4可得,料液比对氨基接枝率的影响显著;当料液比大于1∶3时,随着APTES添加量的增加,氨基接枝率明显提高;当APTES添加量增加到料液比为1∶3时,氨基接枝率达到最大值(13.31±0.17)%;当料液比小于1∶3时,氨基接枝率达到平衡,基本保持不变。因此,最适料液比为1∶3。

图4 料液比对氨基接枝率的影响
2.2 NMMS的磁分离效果
称取0.3 g NMMS与50 mL烧杯中,加入50 mL蒸馏水,分散均匀,用磁铁分离5 min,结果如图5所示。可见,样品能够很好的用磁铁分离,有利于实际应用中与食品的分离及吸附剂的回收利用。

图5 NMMS的磁分离特性
2.3 FTIR结果分析
图6 为样品的红外光谱图,图中波数800、462、1 088、1 232 cm-1对应样品MMS 和NMMS 骨架中Si—O—Si的弯曲振动和伸缩振动峰,972、1 635 cm-1为Si—OH的弯曲振动峰,可见NMMS样品的Si—OH振动峰强度明显小于MMS样品,表明NMMS样品中的—OH数减少,这是由于嫁接了APTES的缘故;559 cm-1为Fe-O振动峰[19],表明样品中成功包覆了磁性颗粒,与XRD检测结果一致;1 380 cm-1为C—H的特征吸收峰,同时在2 931、1 496 cm-1存在吸收峰,表明有甲基和亚甲基的存在;694、1 560 cm-1吸收峰分别对应N—H的弯曲振动和—NH3+的对称振动峰[20],证明APTES成功的嫁接到了MMS材料上。
2.4 XRD结果分析
如图7a所示,MMS 材料在 2θ =2.54°、4.52°、5.14°处有3个明显的衍射峰,分别对应介孔材料的100、110、200 3 个晶面,100 晶面的衍射峰强而窄,表明MMS材料为有序的六方结构[21];NMMS材料中110、200晶面对应的衍射峰消失,则材料的长程有序度降低,但100晶面对应的衍射峰仍存在,强度减小,说明改性后材料虽然有序度降低,但仍保持有序六方结构。MMS和NMMS在2θ=15°~30°之间有1个宽的衍射峰(图7b),因此,2种材料均为无定型氧化硅结构[22]。2θ =30.18°、35.64°、43.84°、53.90°、57.48°、63.10°处的衍射峰分别对应 MMS和 NMMS样品中 Fe3O4的 220、311、400、422、511、440 6 个晶面,为有标准的尖晶石结构[23]。

图6 样品的红外谱图

图7 样品的XRD图谱
2.5 样品的孔性特征分析
MMS和NMMS的N2吸附-脱附和孔径分布曲线见图8。由图8a可知,2种样品的N2吸附-脱附等温线均为典型的LangmiurⅣ型吸附等温线,具有明显的H1型滞后环,说明MMS和NMMS材料的孔道均一,且为介孔材料;由图8b的孔径分布可知,NMMS样品的孔径分布均一性不如MMS且孔径减小,NMMS的BET多点比表面积为205.884 m2/g,孔径为2.03 nm,相比MMS都有一定程度的减小,这是由于APTES接枝到孔道中所致。

图8 样品的N2吸附-脱附曲线及孔径分布图
2.6 AFB1的脱除效果
HPLC法测得AFB1初始质量浓度为0.2μg/mL时,样品MMS和NMMS对其脱除效果见表1。从表1中可以看出:与MMS相比,NMMS对AFB1的单位吸附量和脱除率都提高了近1倍,因此氨基改性有利于磁性介孔材料对AFB1的吸附;NMMS对AFB1的脱除率高达(83.96±2.74)%,表明该材料在脱除AFB1方面有很好的应用前景。

表1 样品对AFB1的单位吸附量和脱除率
3 结论
以稻壳为硅源,APTES为改性剂,采用后接枝合成法成功合成了氨基改性的有序磁性介孔SiO2材料(NMMS)。研究表明,氨基改性的最佳工艺条件为:搅拌时间10 h,温度80℃,料液比1∶3,在此条件下,氨基接枝率为(13.3±0.2)%;同时,在694 cm-1和1 560 cm-1处出现 N—H吸收峰,表明氨基嫁接成功;NMMS的磁性相为Fe3O4,具有良好的磁分离特性;其孔道为有序的六方结构,孔径和比表面积分别为2.03 nm和205.884 m2/g;对AFB1的脱除率可达(83.96±2.74)%,约为未改性的磁性介孔 SiO2(MMS)的2倍。可见,氨基改性有利于NMMS材料对AFB1的吸附,能够达到有效脱除AFB1的效果。由于NMMS以稻壳为硅源与传统制备方法中以正硅酸乙酯为硅源相比原料廉价,且易分离、可重复利用,成本低,同时,能有效脱除AFB1,因此可作为脱除粮油等液态食品中AFB1的良好吸附材料。
[1]杨建伯.真菌毒素与人类疾病[J].中国地方病学杂志,2002,21(4):76 -79
[2]Groopman J D,Busby W F J,Wogan G N.Nuclear distribution of aflatoxin B1and its interaction with histones in rat liver in vivo[J].Cancer Research,1980,40(12):34 -42
[3]张丽,程杨.关于霉菌毒素对食品的污染及防止方法[J].食品研究与开发,2002,23(6):98-100
[4]张会娟,胡志超,王海鸥,等.农产品黄曲霉毒素污染致因与防除措施浅析[J].世界农业,2012,394(2):79-81
[5]Richard J L.Some major mycotoxins and their mycotoxicoses-An overview[J].International Journal of Food Microbiology,2007,119(12):3 -10
[6]Pohland A E.Mycotoxins in review [J].Food Additives and Contaminants,1993,10(1):17 -28
[7]周闯,何成华,司慧民,等.2012年国内饲料及原料霉菌毒素污染调查分析[J].畜牧与兽医,2014,46(1):81-84
[8]王君,刘秀梅.部分市售食品中总黄曲霉毒素污染的监测结果[J].中华预防医学杂志,2006,40(1):33 -37
[9]李培武,张道宏,杨扬,等.粮油制品中黄曲霉毒素脱毒研究进展[J].中国油料作物学报,2010,32(2):315-319
[10]佘婷婷.黄曲霉毒素脱毒方法研究进展[J].广东第二师范学院学报,2013,33(5):63 -69
[11]肖军霞,张岩,黄国清,等.黄曲霉毒素脱除方法研究进展[J].食品安全质量检测学报,2012,3(5):395 -399
[12]张国辉,何瑞国,齐德生.饲料中黄曲霉毒素脱毒研究进展[J].中国饲料,2004,3(16):36 -38
[13]刘峰,田华,贺军辉,等.磁性介孔材料的研究进展[J].化学通报,2013,76(3):210 -216
[14]徐慧,颜文晶,张鹏华,等.氨基改性Fe3O4/SiO2核壳结构的DNA吸附特性[J].中南大学学报:自然科学版,2012,43(1):100 -104
[15]付庆涛,何婷婷,于濂清,等.磁性核壳介孔氧化硅微球的制备与应用[J].化学进展,2010,22(6):1116-1124
[16]Hong R Y,Li JH,Li H Z,et al.Synthesis of Fe3O4nanoparticles without inert gas protection used as precursors of magnetic fluids[J].Journal of Magnetism and Magnetic Materials,2008,320(9):1605 -1614
[17]杨娜,朱申敏,张荻.氨基改性介孔二氧化硅的制备及其吸附性能研究[J].无机化学学报,2007,23(9):1627 -1630
[18]中华人民共和国青岛进出口商品检验局.GB/T 5009.23—2006,食品中黄曲霉毒素 B1、B2、G1、G2的测定[S]
[19]高云燕,李海霞,欧植泽,等.多壁碳纳米管负载Fe3O4磁性纳米粒子表面吸附增强过氧化酶的催化活性[J].物理化学学报,2011,27(10):2469 -2477
[20]伍宏玉,张友玉,李海涛.介孔二氧化硅的扩孔及其氨基功能化[J].化学研究与应用,2011,23(11):1441-1446
[21]Wang Y,Ren J,Liu X,et al.Facile synthesis of ordered magnetic mesoporous gamma-Fe2O3/SiO2nanocomposites with diverse mesostructures[J].Journal of Colloid and Interface Science,2008,326(1):158 -165
[22]Zhao L,Chi Y,Yuan Q,et al.Phosphotungstic acid anchored to amino-functionalized core-shell magnetic mesoporous silica microspheres:A magnetically recoverable nanocomposite with enhanced photocatalytic activity[J].Journal of Colloid and Interface Science,2013,390:70 - 77
[23]Liu X,Liu H,Ma Z,et al.Preparation and characterization of aminosilane modified superparamagnetic silica nanospheres[J].Journal of Magnetism and Magnetic Materials,2004,270(1):1-6.

