自发性荨麻疹血清总IgE、补体与Th1/Th2相关细胞因子的检测
高润光,毕美霞,张妍慧
(1.河南省焦作市妇幼保健院,焦作454000;2.河南省焦作市中医院,焦作454000)
自发性荨麻疹(Spontaneous Urticaria,SU)是病因不明、发病机制复杂的一组疾病,可累积多器官和脏器,以反复发作的皮肤风团与瘙痒为主要症状。病程小于6 周为急性自发性荨麻疹(Acute spontaneous urticaria,ASU),病程超过6 周为慢性自发性荨麻疹(Chronic spontaneous urticaria,CSU)[1]。目前的共识是: 本病是多因素参与的以人体自身免疫功能紊乱为核心的自身免疫性疾病[2]。本研究通过检测ASU 和CSU 患者血清总IgE、血清补体与Th1/Th2 相关细胞因子的改变,探讨Th1/Th2 平衡在SU 发病中的作用。
1 对象与方法
1.1 研究对象 随机收集我院皮肤科2012 年6月—2014 年8 月门诊ASU 患者(ASU 组)80 例,其中男36 例,女44 例,平均(34.67±17.53)岁;CSU 患者(CSU 组)170 例,其中男73 例,女97 例,平均(35.83±18.98)岁。纳入条件:(1)1 个月内未用糖皮质激素和免疫抑制剂。(2)无明确诱发因素(药物、物理性、精神性等)。(3)无其他免疫相关性疾病。另选同期我院健康体检者38 例为对照组,男20 例,女18 例,年龄6~65 岁,平均(28.25±19.87)岁,均无过敏性疾病史,1 个月内未使用糖皮质激素和免疫抑制剂。3 组间性别(F=2.61)和年龄(F=2.84)比较差异无统计学意义。
1.2 检测方法 3 组受试者均常规抽取清晨空腹静脉血3 mL,离心收集血清500 μL,-80 ℃中保存。血清总IgE 检测采用双抗体夹心ELISA 法进行,试验步骤按试剂盒(Genzyme 公司)说明书进行。双光径免疫浊度法(贝克曼库尔特)检测血清C3、C4,试剂购于上海科华生物工程股份有限公司。ELISA 法检测血清IL-2、IL-4、IFN-γ,试验步骤按试剂盒(上海森雄)说明书进行。
1.3 荨麻疹活动评分 按照参考文献[1]将荨麻疹患者按风团数量与瘙痒程度的评分分为轻度(0~2分)、中度(3~4 分)和重度(5~6 分)。评分标准如下,(1)风团数量:无、轻度(24 h 风团数<20 个)、中度(24 h 风团数20~50 个)、重度(24 h 风团数>50 个)分别计0、1、2 和3 分。(2)瘙痒程度:无、轻度(轻微瘙痒,心情不受影响)、中度(瘙痒明显,心情受影响,但无影响日常活动及睡眠)、重度(瘙痒十分明显,无法日常活动及睡眠)分别计0、1、2 和3分。
1.4 统计学方法 采用SPSS 17.0 统计学软件进行分析,计量资料数据以均数±标准差(x±s)表示,组间比较采用方差分析。检测各指标与病情严重程度分析采用Spearman 相关性分析,P<0.05 为差异有统计学意义。
2 结果
2.1 3 组间各指标水平结果比较 CSU 组与ASU组总IgE 水平均高于对照组,且CSU 组低于ASU组;CSU 组C3 水平低于ASU 组及对照组,差异均有统计学意义(P<0.05)。ASU 组和CSU 组IL-2、IFN-γ 均低于对照组,差异有统计学意义(均P<0.05),但CSU 组IL-2、IFN-γ 水平与ASU 组比较差异无统计学意义(P>0.05)。CSU 组IL-4 水平高于对照组,差异有统计学意义(P<0.05),见表1。
2.2 血清各检测指标水平与积分相关性分析ASU 组、CSU 组血清总IgE 水平均与病情分级呈正相关(rs分别为0.537 和0.589,P<0.05)。血清补体C3、C4 水平与ASU 病情分级无明显相关性(rs分别为0.098 和0.134,P>0.05)。血清补体C3、C4 水平与CSU 分级均呈负相关(rs分别为-8.891 和-7.262,P<0.05)。血清IL-2 水平(rs分别为0.022 和0.831)、IFN-γ 水平(rs分别为0.121 和-0.176)、IL-4 水平(rs分别为0.245 和0.189)与ASU、CSU 病情分级无明显相关性(均P>0.05)。见表2、3。
3 讨论
SU 病因及致病机制复杂,涉及体液与细胞免疫平衡的异常。多项研究表明其更可能是自身免疫性疾病。研究发现SU 患者体内可检测到抗IgE 受体(FcεRI)的自身抗体和抗IgE 自身抗体,这些自身抗体可与其相应配体结合,在补体的参与下,活化肥大细胞和嗜碱性粒细胞等效应细胞,致其脱颗粒而产生一系列临床症状[3]。本研究中ASU、CSU 组血清总IgE 水平均高于对照组,且血清总IgE 水平与ASU、CSU 病情分级呈正相关,结果与张敏等[4]研究相一致。这种现象可能与Horn 等[5]提出的条件性自身抗体平衡学说相关,即肥大细胞、嗜碱性粒细胞等效应细胞的稳定性与其表面的FcεRI 结合的饱和度有关,受体结合饱和度升高或降低,均可引起效应细胞释放组胺等介质。血清中的IgE 浓度升高、抗FcεRI 自身抗体的出现或效应细胞表面FcεRI的下调均可引起肥大细胞、嗜碱性粒细胞释放介质。每个个体效应细胞表面的FcεRI 数量不同,血清总IgE 水平升高或降低引起嗜碱性粒细胞、肥大细胞释放介质情况差异大,但血清总IgE 水平明显升高时,引起嗜碱性粒细胞、肥大细胞释放介质概率明显升高。因此,血清总IgE 水平测定对诊断和判断病情有重要意义。
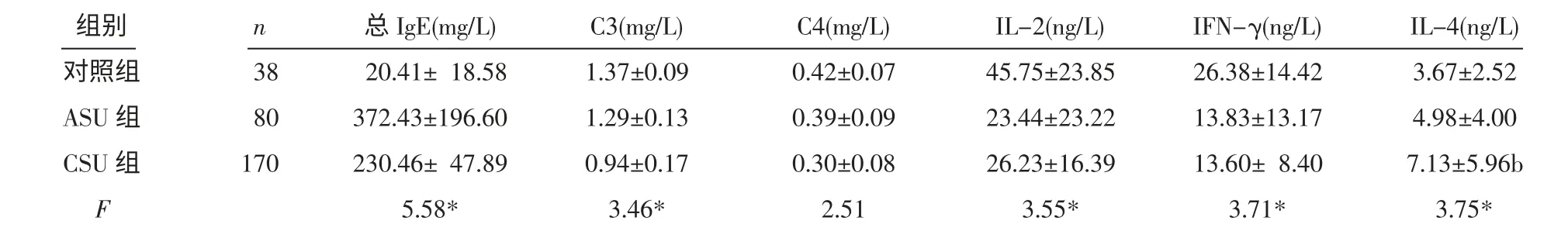
表1 3 组血清总IgE、C3、C4、IL-2、IFN-γ、IL-4 水平 (x±s)
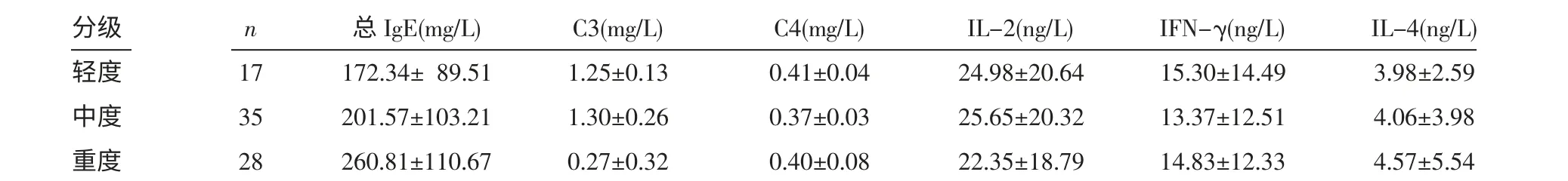
表2 ASU 组不同自发性荨麻疹分级的血清总IgE、C3、C4、IL-2、IFN-γ、IL-4 水平 (x±s)
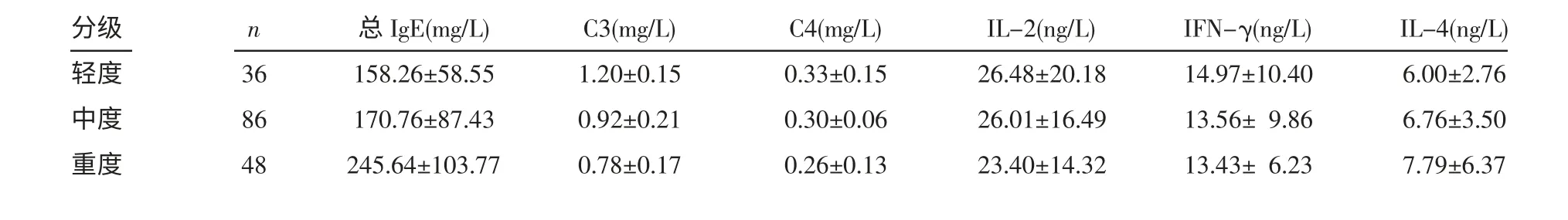
表3 CSU 组不同自发性荨麻疹分级的血清总IgE、C3、C4、IL-2、IFN-γ、IL-4 水平 (x±s)
补体的异常激活在自身免疫性疾病的病理作用的机制早已阐明,如血清C3、C4 水平下降可提示自身免疫性疾病患者病情处于活动期。高宏等[6]曾报道过C3、与慢性荨麻疹的病情相关性。本研究结果表明血清C3、C4 水平与CSU 病情轻、中、重均呈负相关,与已报道文献结果一致,但其与ASU 病情分级无明显相关性。在生理状况下,C3 与B 因子相互作用,可产生极少量的C3B 和C3bBb(旁路途径的C3 转化酶),IL-13、IL-4 可协同TNF-α 作用促进C3 合成[7]。Andrews 等[8]研究发现IL-1α,IFN-γ,IL-1β 与IL-6 或IFN-γ 可特异地增加HepG2(肝细胞瘤来源的细胞)分泌C3,并发现IL-1β 与IL-6 可以协同介导增加C3mRNA 转录与表达。本研究中ASU 与CSU 组IL-2、IFN-γ 均低于对照组,而CSU组IL-4 高于对照组。ASU 组IL-4 水平高于正常组,但差异无统计学意义,结果提示ASU、CSU 患者体内Th1/Th2 相关细胞因子水平均异常,但CSU 患者体内Th1/Th2 相关细胞因子水平改变更明显。结果与吴慧珍等[9]报道相一致。Th1/Th2 细胞功能的平衡是维持机体免疫功能正常的重要前提,本研究进一步证实了Th1/Th2 相关细胞因子的失衡,为进一步探讨本病的发病机制提供了实验依据。
SU 的发病是以Ⅰ型变态反应为主,涉及免疫系统的各层面和免疫反应的各阶段,鉴于细胞和体液免疫的高度相关,SU 发病可能更归因于Th1/Th2 细胞作用失衡,探讨该病的发病机制不应局限于其多样的临床表现,更应关注这两种免疫反应间的相互作用,不仅要检测与Th1/Th2 相关的细胞因子,更应探讨这些细胞因子基因的表达调控,更深层次地阐明SU 的发病机制。
[1] Zuberbier T,Asero R,Bindslev-Jensen C,et al.EAACI/GA(2)LEN/EDF/WAO guideline: definition, classification and diagnosis of urticaria[J].Allergy,2009,64:1417-1426.
[2] Ciprandi G,De Amici M,Berardi L,et al.Serum neopterin levels in spontaneous urticaria and atopic dermatitis[J]. Clin Exp Dermatol,2011,36:85-87.
[3] Miescher SM,Horn MP,Pachlopnik JM, et al. Natural anti-FcepsilonRIalpha autoantibodies isolated from healthy donors and hronic idiopathic urticaria patients reveal a restricted repertoire and autoreactivity on human basophils[J].Hum Antibodies,2001,10:119-126.
[4] 张敏,李桂珍,宋蒙蒙,等.慢性自发性荨麻疹患者血清二胺氧化酶活性和总IgE 检测及意义[J].天津医药,2011,39(6):514-516.
[5] Horn MP,Pachlopnik Jm,Vogel M,et al.Conditional autoimmunity mediated by human natural anti-FcεRIa autoantibodies?[J].FASEB J,2001,15:2268-2274.
[6] 高宏,邱毅,李雪珍,等.慢性荨麻疹患者免疫球蛋白E 和补体C3 的检测结果分析[J]. 浙江中医药大学学报, 2008, 32(5):634-637.
[7] Katz Y,Nadiv O,Papoport M,et al.IL-17 regulates gene expression and protein synthesis of the complement system,C3 and factor B,in skin fibroblasts[J].Clin Exp Immunol,2000,120:22-29.
[8] Andrews E,Feldhoff P,Feldhoff R,et al.Comparative effects of cytokines and cytokine combinations on complement component C3 secretion by HepG2 cells[J].Cytokine,2003,23:164-169.
[9] 吴慧珍,张学奇,张文辉.血清中IL-4 和TNF-α 水平与慢性自发性荨麻疹的相关性[J].中华微生物学和免疫学杂志,2003,23(7):561.

