维生素D受体基因CDX2 多态性与阿达木单抗治疗中重度斑块型银屑病疗效相关性研究
周欣,毕新岭,顾军
(第二军医大学长海医院,上海200433)
近年来,随着对慢性斑块型银屑病认识的深入,产生了许多新的生物制剂。银屑病的复杂基因学也变得越来越清晰,全基因组关联研究(GWAS)已经揭示了多达32 个银屑病易感区域,9 个易感位点[1]。然而银屑病患者基因变异与治疗反应之间的关系仍不明确。针对银屑病患者个体化治疗急需我们找到生物标记来预测治疗效果[2]。生物制剂对中重度银屑病患者显示出不同的疗效,以及不同程度的不良反应、费用[3]。个体化治疗的终极目标是要区别出这些对治疗反应差且不良反应风险增加的患者,来减少不必要的费用和治疗不良反应。
笔者选取本院斑块型银屑病患者42 例,给予肿瘤坏死因子(TNF)-α 抑制剂阿达木单抗治疗12周,采用中高通量SNP 分型技术,对达到和未达到严重程度指数改善75%(PASI75)的2 组患者维生素D 受体(VDR)基因CDX2 位点(rs11568820)多态性进行检测,并通过遗传统计分析,旨在揭示该位点多态性与阿达木单抗疗效的关联性,以期对生物制剂治疗银屑病效果进行预测。
1 对象与方法
1.1 研究对象 2013 年1—12 月我院42 例临床确诊的中重度斑块型银屑病患者,均为汉族。体表受累面积(BSA)≥10%,银屑病面积与PASI≥10,医生整体评价(PGA)为中/重度,年龄21~66 岁,男33例、女9 例。
1.2 入选标准和排除标准 入选标准:①年龄>18岁,性别不限;②斑块型银屑病确诊时间>6 个月,病情处于稳定期>2 个月;③BSA≥10%,PASI 评分≥10,基线PGA 评分为中/重度;④结核筛查阴性、胸片无异常、1 年内未使用过其他生物制剂。排除标准:①其他类型银屑病;②同时使用其他可影响病程的药物;③妊娠和哺乳期妇女;④可能影响治疗结果的伴随疾病如肿瘤、自身免疫性疾病等;⑤其他无法配合完成治疗者。
1.3 方法
1.3.1 治疗方法 阿达木单抗(修美乐,雅培)皮下注射,第1 周80 mg,第1~12 周隔周给药40 mg。治疗前(T0)和第12 周(T12)分别对患者进行PASI评分。
1.3.2 疗效判定 第12 周为观察疗效终点进行疗效评价。计算T0、T12 的PASI,疗效指数=(治疗前评分-治疗后评分)/治疗前评分×100%,以是否达到PASI75 作为治疗有效、无效的标准,将患者分为有效组、无效组。
1.3.3 血液采集 采血前,被检查者安静休息5 min,对采血部位严格消毒,用一次性采血管于肘正中静脉处采血2~3 mL,置于EDTA 抗凝管中,-80 ℃冰箱保存。
1.3.4 基因提取和分型 采用柱式总DNA 提取法,美国OMEGA 全血基因提取试剂盒。由上海天昊生物有限公司采用中高通量SNP 分型技术进行检测:通过连接酶连接反应的高特异性,实现对SNP 位点等位基因的识别,通过在连接探针末段引入不同长度的非特异序列以及通过连接酶连接反应获得位点对应的不同长度的连接产物,利用标记荧光的通用引物对连接产物进行PCR 扩增,通过荧光毛细管电泳对扩增产物进行电泳分离,最后用GeneMapper4.1 软件分析获得各个SNP 位点的基因型。
1.4 统计学方法 采用SPSS20.0 统计软件进行统计学处理。计量资料以均数±标准差表示,计数资料以频数和百分数表示。2 组间计量资料均数的比较采用两样本t 检验,2 组间计数资料的比较采用χ2检验。P<0.05 差异有统计学意义。
2 结果
42 例患者中有1 例因不良反应提前终止试验,其余41 例患者均按要求完成试验。
2.1 一般情况 41 例患者中男32 例(78.0%),女9例(22.0%),男∶女为3.6∶1。年龄21~66 岁,平均(46.66±13.53)岁;平均体质量指数(BMI)为(24.44±3.48)kg/m2;银屑病平均病程(14.84±10.11)年。达到PASI75 的患者32 例(78.0%),未达到PASI75 的患者9 例(22.0%)。
2.2 临床疗效 41 例患者治疗前后PASI 评分、PGA 评分、DLQI 评分经配对资料t 检验显示差异有统计学意义(P<0.001)。见表1。

表1 患者经阿达木单抗治疗前后比较 (x±s)
2.3 组间VDR 基因CDX2 基因型和等位基因分布频率 2 组基因型分布均符合Hardy-weinberg 平衡定律(P>0.05),具有群体代表性。有效组和无效组VDR 基因CDX2 位点(rs11568820)的基因型和等位基因的分布频率相比差异均无统计学意义(P>0.05),见表2。
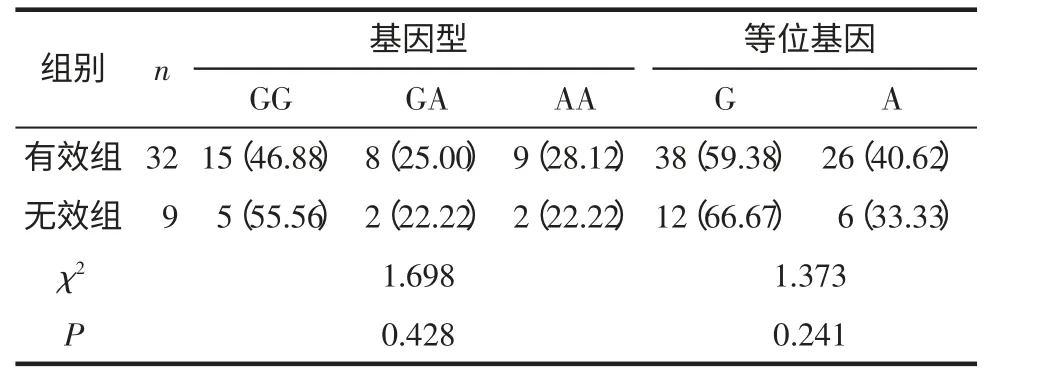
表2 2 组VDR 基因rs11568820 基因型及等位基因分布频率比较 例(%)
3 讨论
TNF-α 抑制剂作为一类代表性生物制剂类药物,主要通过拮抗在慢性炎症过程中起关键作用的TNF-α 而发挥显著的抗炎作用,在包括银屑病、类风湿关节炎、炎症性肠病等免疫介导的炎症性疾病中具有显著的疗效,近10 年来已广泛应用于欧美国家。阿达木单抗(adalimumab)是TNF-α 的全人源化IgG1 单克隆抗体,可特异性地与TNF-α 结合并阻断其与p55 和p75 细胞表面TNF 受体的相互作用。其免疫源性低,刺激机体产生中和抗体的能力弱。该药物的半衰期为12~14 d,推荐用法为:第1周80 mg 皮下注射,第2 周及以后每2 周40 mg,疗效欠佳时可每周40 mg。该药2003 年1 月首次在美国上市。TNF-α 抑制剂价格昂贵,且有潜在严重不良反应,虽然疗效好,但是仍有约30%~50%的患者对治疗反应不佳[2]。提示银屑病基因型和治疗效果之间存在相关性。
关于TNF-α 抑制剂疗效的生物标记,已有的研究如Tejasvi 等[4]发现TNFAIP3 基因多态性与TNF-α抑制剂治疗银屑病疗效显著相关;Di Renzo 等[5]研究提示-174G/C IL-6 基因启动子多态性可作为TNFα 抑制剂疗效预测指标。VDR 是一种细胞核内受体,属于类固醇/甲状腺激素受体超家族[6],激活后抑制T 细胞活性,调节细胞因子分泌模式,抑制树突状细胞成熟、分化和迁移[7]。多个研究证实VDR 基因多态性与银屑病易感性相关[8-9]。而VDR 基因与TNF-α 抑制剂疗效的相关性研究则较少。有研究提示用维生素D 类似物成功治疗银屑病可能需要上调VDR[10]。另一研究显示,窄波紫外线(NB-UVB)治疗后的缓解期受VDR 基因多态性的影响[11]。Ryan等[12]检测了维生素D 受体基因位点FokI、ApaI、BsmI、TaqI 和rs4516035 的多态性与依那西普和阿达木治疗银屑病疗效之间未发现相关性。而对于VDR 基因CDX2 位点,目前暂无相关研究。而国内对VDR基因多态性与TNF-α 抑制剂疗效相关性研究更是缺乏。
本研究结果显示,经过阿达木单抗12 周治疗后,达到PASI75 的患者比例为78.0%,与国外研究结果相似[13]。患者PASI 评分、PGA 评分、DLQI 评分均较治疗前明显降低。提示阿达木单抗治疗中重度斑块型银屑病疗效可靠,且安全性较好。但是仍有22%的患者治疗无效。本研究继续针对有效组和无效组VDR 基因CDX2 位点(rs11568820)的基因型和等位基因的分布频率进行对比,结果显示差异均无统计学意义。可能的原因是:①银屑病由遗传、免疫和环境等多因素共同作用所致,单一因素的变化并不能完全解释所有患者的病情变化;②样本量有限,可加大样本量做进一步研究。
[1] Tsoi LC,Spain SL,Knight J,et al.Identification of 15 new psoriasis susceptibility loci highlights the role of innate immunity[J]. Nat Genet,2012,44:1341-1348.
[2] Ryan C,Menter A,Warren RB.The latest advances in pharmacogenetics and pharmacogenomics in the treatment of psoriasis[J]. Mol Diagn Ther,2010,14:81-93.
[3] Menter A, Gottlieb A, Feldman SR, et al.Guidelines of care for the management of psoriasis and psoriatic arthritis: section 1. Overview of psoriasis and guidelines of care for the treatment of psoriasis with biologics[J].J Am Acad Dermatol,2008,58:826-850.
[4] Tejasvi T, Stuart PE, Chandran V, et al. TNFAIP3 gene polymorphisms are associated with response to TNF blockade in psoriasis[J].J Invest Dermatol,2012,132:593-600.
[5] Di Renzo L,Bianchi A,Saraceno R,et al.-174G/C IL-6 gene promoter polymorphism predicts therapeutic response to TNF-a blockers[J].Pharmacogenet Genomics,2012,22:134-142.
[6] Milde P,Hauser U,Simon T,et al.Expression of 1,25-dihydroxyvitamin D3 receptors in normal and psoriatic skin[J].J Invest Dermatol,1991,97:230-239.
[7] Adorini L,Penna G.Control of autoimmune diseases by the vitamin D endocrine system[J].Nat Clin Pract Rheumatol,2008,4:404-412.
[8] Zhou X,Xu LD,Li YZ.The association of polymorphisms of the vitamin D receptor gene with psoriasis in the Han population of northeastern China[J].J Dermatol Sci,2014,73:63-66.
[9] Liu JL, Zhang SQ, Zeng HM. ApaI, BsmI, FokI and TaqI polymorphisms in the vitamin D receptor(VDR)gene and the risk of psoriasis: a meta-analysis [J]. J Eur Acad Dermatol Venereol, 2013, 27:739-746.
[10] Chen ML,Perez A,Sanan DK,et al.Induction of vitamin D receptor mRNA expression in psoriatic plaques correlates with clinical response to 1,25-dihydroxyvitamin D3[J]. J Invest Dermatol, 1996,106:637-641.
[11] Ryan C,Renfro L,Collins P,et al.Clinical and genetic predictors of response to narrowband ultraviolet B for the treatment of chronic plaque psoriasis[J].Br J Dermatol,2010,163:1056-1063.
[12] Ryan C, Kelleher J, Fagan MF, et al. Genetic markers of treatment response to tumour necrosis factor-α inhibitors in the treatment of psoriasis[J].Clin Exp Dermatol,2014,39:519-524.
[13] Menter A,Tyring SK,Gordon K,et al.Adalimumab therapy for moderate to severe psoriasis:A randomized,controlled phase III trial[J].J Am Acad Dermatol,2008,58:106-115.

