SCOTS技术在筛选动物病原菌功能基因中的应用
汪 洋,易 力,范红结,陆承平
(1.河南科技大学 动物科技学院,河南 洛阳 471003;2.洛阳师范学院 生命科学系,河南 洛阳 471022;3.南京农业大学 动物医学学院,江苏 南京 210095)
病原菌在宿主体内定植与感染的过程是一个复杂的、动态的多因素作用过程,在这个过程中病原菌需要通过调控各基因的表达来适应环境的变化。目前,随着大量细菌的基因组测序完成,为研究细菌病原、流行病学和防控方法提供了参考。下一步就需要研究这些基因的功能,考察在不同环境条件下的选择性表达情况,特别是病原菌的致病过程以及如何与宿主细胞作用一直是关注的重点。目前已经有多种方法用于研究病原菌定植和感染宿主时的基因表达情况,这些技术主要包括DNA 芯片技术(DNA chip)、差异显示技术(Differential display reverse transcription PCR,DD-RT-PCR)、抑制消减杂交技术(Suppression subtractive hybridization,SSH)、体内表达技术(In vivo expression technology,IVET)、信号标签诱变技术(Signature-tagged mutagenesis,STM)和选择性抗原捕获转录序列(Selective capture of transcribed sequences,SCOTS)等,每种方法各有优缺点。
SCOTS 方法于1999 年由Graham 等在研究结核杆菌作用人巨噬细胞时,所建立的筛选差异基因的方法[1]。由于宿主细胞存在大量RNA,在宿主细胞中直接分离细菌的RNA 然后考察在感染宿主中的基因表达情况是非常困难的。而SCOTS 方法在研究病原微生物致病过程中的基因转录情况有其优越性,特别是在病原微生物基因组信息未知的情况下可优先选用。本文就SCOTS 技术的原理、特点及其在动物病原菌中的应用作一简要综述。
1 SCOTS技术原理
SCOTS 技术的原理是从感染的细胞或组织中直接提取感染细胞或组织的总RNA(包括细菌和宿主细胞),通过带有标签的随机引物反转录为总cDNAs,然后对病原基因组进行生物素标记和rRNA 位点封闭;经处理的基因组分别与体内感染条件及正常培养条件的cDNAs 杂交,利用链霉生物素磁珠能够与生物素结合的原理将感染和正常培养不同条件的细菌cDNAs 捕获;再通过不同条件下的cDNAs 的差异杂交和扩增,从而获得病原微生物在宿主体内差异表达的基因(图1)。实验过程包括:克隆病原菌核糖体16S rRNA 和23S rRNA,生物素标记病原菌基因组和破碎rRNA 质粒,提取不同条件下的总RNA,合成双链cDNAs,选择性捕获转录序列,对病原菌在宿主体内得到的特异性转录序列进行富集和鉴定。
2 SCOTS技术的优缺点
2.1 SCOTS技术的优点 细菌在宿主体内的表达情况可以为了解病原与宿主的相互作用和致病的分子机制提供研究思路。对于鉴定病原微生物与宿主细胞相互作用的基因表达情况SCOTS 技术有其独特的优点,该方法与其他各种筛选细菌基因表达谱的方法比较见表1。(1)SCOTS 技术先封闭宿主自身高丰度的cDNA 和细菌自身高丰度的核糖体,然后捕获在感染条件下的上调表达的基因,解决了细菌感染过程中,宿主内细菌数量过少,不可能直接分离细菌RNA 的难题。(2)直接获得感染组织细胞和细菌的总RNA,避免因分离组织细胞和细菌时可能造成的表达谱变化。(3)SCOTS 技术直接考察病原微生物在不同条件下的基因表达差异情况,无需构建突变文库[2]。(4)无需动物模型,简单、快捷。无需预先知道有关目标病原的遗传信息,尤为适用于新病原研究。(5)采用随机引物构建cDNA文库,有助于cDNA 文库质量的保证。(6)假阳性率低。采用两次消减杂交和两次PCR,保证有较高特异性。(7)不仅可以用来研究病原菌在宿主体内和体外培养中基因差异表达,还可以研究细菌在低温、缺铁、厌氧等不同应激条件下的基因差异表达[3-5]。
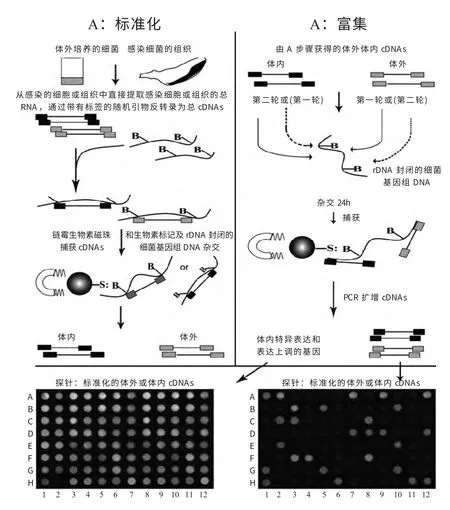
图1 SCOTS 技术原理和流程图[1]

表1 各种筛选细菌基因表达谱方法的比较
2.2 SCOTS技术的缺点 SCOTS 技术也有其不足的地方。选择性捕获得到的基因序列多为在200 bp~500 bp,仅为基因的一部分片段,鉴定后还需要对基因进行全长扩增。另外,利用这种方法所得到的基因数目相对于高通量筛选的基因芯片而言比较有限。因此,在研究细胞内这种提取细菌RNA 不困难的条件的基因表达情况时,可以将两种方法结合使用,以便获得更确切的差异表达基因。此外,通过SCOTS 技术所获得的差异基因有利于了解病原菌感染宿主的致病机制或在宿主体内存活的代谢机制,但未能筛选出的基因并不能代表对宿主的致病性或在宿主体内存活不起作用。
3 SCOTS技术的应用
目前,SCOTS 技术已被用于对多种动物病原菌差异表达基因的筛选。筛选条件各有不同,有病原菌感染宿主后直接从感染组织与细胞中筛选,也有在体外模拟体内病原菌感染条件下的筛选。
3.1 结核分枝杆菌 1999 年,Graham 等在研究结核杆菌(M.tuberculosis)在人巨噬细胞内的反应时,首创了SCOTS方法[1]。研究发现结核分枝杆菌H37Rv 共有11 对双组份调节系统基因,2 个毒力的组氨酸激酶基因和6 个独立的反应调节基因,在人外周血单核增生巨噬细胞中培养18 h、48 h 和110 h 时,有3 个基因一直稳定表达,9 个基因在不同时间点出现表达差异,另有7 个基因未表达[6],其中Rv1057 基因在结核杆菌感染人巨噬细胞的早期表达,而被TrcR 基因所抑制[7]。
3.2 大肠杆菌 利用SCOTS 技术筛选大肠杆菌(E.coli)chi7122(O78:K80:H9)特有的基因,其中在3 周龄SPF 鸡体内上调表达的黏附素、脂多糖核心合成、铁相关、质粒与噬菌体相关编码基因以及未知功能的基因均被筛选出来,其可能与细菌生长和毒力有关[8]。应用SCOTS 方法筛选禽致病性大肠杆菌(APEC)在自然宿主感染模型中致病性相关基因的表达谱,发现APEC E037 株(血清型O78)感染SPF 鸡过程中共获得31 个转录序列,显示其致病性特异序列包括黏附素、LPS 的合成、铁的转运、质粒编码基因、噬菌体编码和一些其它功能基因等[9],在A 群大肠杆菌引起小鼠尿路感染模型中,邻苯二酸铁载体受体iha的表达显著上调[10]。
3.3 伤寒沙门菌 利用SCOTS 技术研究鼠伤寒沙门菌(S.typhimurium)感染人巨噬细胞后的表达情况,共获得28个细菌cDNA 的克隆子,一种为假定的转录调节子LysR[11],其他主要与Vi 荚膜抗原、应激和营养获得有关,缺失LysR 后对沙门菌感染巨噬细胞的数量和感染小鼠的毒力无影响,而LysR 在人源的伤寒沙门菌和甲型副伤寒沙门菌中却不存在[12]。Faucher 等筛选到了36 个基因,并认为这些基因主要定位在毒力岛和噬菌体位置,而与鞭毛、趋化性和铁转运相关的基因表达下调[13-14]。Sheikh 等利用SCOTS 和基因芯片共同分析了伤寒沙门菌感染人后在血液中的表达情况,发现其中29 %的基因出现了差异表达,特别是一些未知功能基因的发现,为伤寒沙门菌的病原诊断、疫苗的制备和药物治疗提供了靶点[15]。
3.4 副猪嗜血杆菌 副猪嗜血杆菌(H.parasuis)是存在于猪上呼吸道的一种条件致病菌,感染后大都会出现发烧和缺铁的现象,并伴有严重的肺部损伤。利用SCOTS 技术发现在感染猪肺组织中筛选到与类细胞表面蛋白、代谢和应激相关蛋白、调节蛋白、转运蛋白和未知功能蛋白有关的上调表达的基因38 个,与体外模拟的缺铁和高温条件下上调表达的基因相比,其中有28 个相同基因在3 种模拟条件下均表达上调,这也暗示了这些基因在体内表达的变化也就是缺铁和高温条件下的环境调节信号。并且,副猪嗜血杆菌在猪组织的表达情况有所不同,如毒力因子黏附素YadA 和唾液酸合成酶SiaB 在猪的肺和脑中均表达,但YadA 在猪肺脏组织中表达量最高,推测可能参与在猪肺脏的定殖;SiaB 在猪脑组织中表达量最高,推测副猪嗜血杆菌突破血脑屏障和猪发生脑膜炎需要该基因直接或者间接参与作用[4]。研究发现在缺铁的应激条件下36 个基因上调表达,这些基因分别与细胞表面蛋白、转运、结合、物质代谢和能量代谢有关[16]。而在高温条件下(即出现热应激时)上调表达的基因分别编码能量代谢、脂肪酸代谢、糖代谢、氨基酸和蛋白质的合成,转运和调节相关蛋白[4]。
3.5 产单核细胞李斯特菌 产单核细胞李斯特菌(L.monocytogenes)是一种通过食物传播的病原,可以在低温条件下生长[17]。利用SCOTS 技术比较产单核细胞李氏杆菌在10 ℃和37 ℃的基因表达差异,共获得了24 个cDNA克隆,这些克隆为冷适应有关基因(flaA 和flp)、调节适应反应(rpoN、lhkA、yycJ、bglG、adaB 和psr)、应激反应(groEL、clpP、clpB、flp 和trxB)、氨基酸代谢(hisJ、trpG、cysS 和aroA)、细胞表面蛋白(fbp、psr 和flaA)及降解代谢有关基因(eutB、celD 和mleA),另外的4 个基因是产单核细胞李斯特菌特有的未知基因[5]。
3.6 胸膜肺炎放线杆菌 胸膜肺炎放线杆菌(A.pleuropneumoniae)是一种引起呼吸道疾病的病原[18]。为研究其在猪肺组织中的基因表达情况,利用SCOTS 技术共筛选出来46 个基因,其中有20 个基因为已知在宿主体内表达的毒力基因[2],其中29 个基因与转运和代谢相关。并首次发现了一种表面相关的假定104 ku 枯草杆菌蛋白酶样自转运体丝氨酸蛋白酶(AasP),该基因在胸膜肺炎放线杆菌15 种血清型中均存在,在感染7 d 和21 d 的猪肺中均有转录,在体外缺氧情况下,它的表达需要总体调节器HlyX 作用[19]。
3.7 多杀性巴氏杆菌 多杀性巴氏杆菌(P.multocida)是一种革兰阴性菌,能够引起多种动物感染发病,如禽的霍乱、猪的肺炎和萎缩性鼻炎、牛和兔的出血性败血症等。采用SCOTS 技术考察多杀性巴氏杆菌感染兔后在兔肝脏中基因差异表达情况,结果鉴定到31 个基因,其中28 个基因按照各自编码蛋白的功能可分为氨基酸生物合成和代谢、中间代谢、能量代谢、应激反应和运输5 大类,另外3 个功能未知[20]。这些基因的研究解析了部分巴氏杆菌的致病机理。
3.8 猪链球菌 应用SCOTS 技术筛选猪链球菌(S.suis)在猪脑微血管上皮细胞中上调表达的基因,共筛选到28 个可能与毒力相关的基因[21],并在感染猪肺组织中鉴定出与代谢,细胞壁相关,转运子,细胞复制及未知功能的五类,共82 个表达上调的基因。研究发现猪链球菌通过上调表达sly、pdgA、ssp、gidA、gcp 和hpl311 等毒力因子来增强其在宿主体内的毒力[22]。为了研究SS2 在缺铁应激条件下的基因表达情况,利用SCOTS 技术研究发现体外缺铁培养时63 个基因出现了上调表达,其中22 个基因与复制有关、8 个基因与细胞壁合成有关、5 个是ATP 结合的运载体、4 个转录调节器和一个未知功能蛋白[3]。为适应这种缺铁应激,猪链球菌需要上调表达RelA,ArcA 和CpdB 等毒力因子,除此之外,与铁吸收有关的fur 和fhuGBDA 操纵子也出现上调表达。有关缺铁条件下转录组学研究将有助于加深对猪链球菌及其他革兰阳性菌的铁代谢的了解程度[3]。本实验室也利用SCOTS 技术研究马链球菌兽疫亚种在感染猪肺组织中基因的差异表达,发现有45 个基因发生差异表达,分别属于代谢细胞壁合成、应激、转运、转录以及未知功能六大类[23]。
4 结语
生物体几乎所有的生命活动过程特别是病理的变化,从本质上讲均为基因表达变化的结果。通过比较同一类病原菌在不同生理状态下或在不同生长发育阶段的基因表达差异,可以为分析其致病机理提供重要信息。因此,关于致病菌在感染过程中基因表达与调控研究已引起人们的高度重视。SCOTS 技术由于无需对感染组织和细菌RNA 进行分离纯化、无需动物模型和假阳性率低等特点正逐渐成为基因组学上研究动物病原菌致病机理的好方法。同时,也为细菌毒力基因的筛选、临床诊断试剂开发和疫苗研发提供新的技术手段。
[1]Graham J E,Clark-Curtiss J E.Identification of Mycobacterium tuberculosis RNAs synthesized in response to phagocytosis by human macrophages by selective capture of transcribed sequences(SCOTS)[J].PNAS USA,1999,96(20):11554-11559.
[2]Baltes N,Gerlach G F.Identification of genes transcribed by Actinobacillus pleuropneumoniae in necrotic porcine lung tissue by using selective capture of transcribed sequences[J].Infect Immun,2004,72:6711-6716.
[3]Li Wei,Liu Lei,Chen Huan-chun,et al.Identification of Streptococcus suis genes preferentially expressed under iron starvation by selective capture of transcribed sequences[J].FEMS Microbiol Lett,2009,292:123-133.
[4]Jin Hui,Wan Yun,Zhou Rui,et al.Identification of genes transcribed by Haemophilus parasuis in necrotic porcine lung through the selective capture of transcribed sequences(SCOTS)[J].Environ Microbiol,2008,10:3326-3336.
[5]Liu Si-qing,Graham J E,Bigelow L,et al.Identification of Listeria monocytogenes genes expressed in response to growth at low temperature[J].Appl Environ Microbiol,2002,68:1697-1705.
[6]Haydel S E,Clark-Curtiss J E.Global expression analysis of two-component system regulator genes during Mycobacterium tuberculosis growth in human macrophages[J].FEMS Microbiol Lett,2004,236:341-347.
[7]Haydel S E,Clark-Curtiss J E.The Mycobacterium tuberculosis TrcR response regulator represses transcription of the intracellularly expressed Rv1057 gene,encoding a seven-bladed beta-propeller[J].J Bacteriol,2006,188:150-159.
[8]Dozois C M,Daigle F,Curtiss R 3rd.Identification of pathogenspecific and conserved genes expressed in vivo by an avian pathogenic Escherichia coli strain[J].PNAS USA,2003,100:247-252.
[9]陈祥,高崧,王晓泉,等.选择性捕获禽病原性大肠杆菌体内转录序列[J].微生物学报,2007,47:407-412.
[10]Leveille S,Caza M,Johnson J R,et al.Iha from an Escherichia coli urinary tract infection outbreak clonal group A strain is expressed in vivo in the mouse urinary tract and functions as a catecholate siderophore receptor[J].Infect Immun,2006,74:3427-3436.
[11]Morrow B J,Graham J E,Curtiss R 3rd.Genomic subtractive hybridization and selective capture of transcribed sequences identify a novel Salmonella typhimurium fimbrial operon and putative transcriptional regulator that are absent from the Salmonella typhi genome[J].Infect Immun,1999,67:5106-5116.
[12]Daigle F,Graham J E,Curtiss R 3rd.Identification of Salmonella typhi genes expressed within macrophages by selective capture of transcribed sequences(SCOTS)[J].Mol Microbiol,2001,41:1211-1222.
[13]Faucher S P,Porwollik S,Dozois C M,et al.Transcriptome of Salmonella enterica serovar Typhi within macrophages revealed through the selective capture of transcribed sequences[J].PNAS USA,2006,103:1906-1911.
[14]Faucher S P,Curtiss R,Daigle F.Selective capture of Salmonella enterica serovar typhi genes expressed in macrophages that are absent from the Salmonella enterica serovar Typhimurium genome[J].Infect Immun,2005,73:5217-5221.
[15]Sheikh A,Charles R C,Sharmeen N,et al.In vivo expression of Salmonella enterica serotype Typhi genes in the blood of patients with typhoid fever in Bangladesh[J].PLoS Negl Trop Dis,2011,5:1419-1424.
[16]Xie Qi-yun,Jin Hui,Luo Rui,et al.Transcriptional responses of Haemophilus parasuis to iron-restriction stress in vitro[J].Biometals,2009,22:907-916.
[17]Liu Yan-hong,Morgan S,Ream A,et al.Gene expression profiling of a nisin-sensitive Listeria monocytogenes Scott A ctsR deletion mutant[J].J Ind Microbiol Biotechnol,2013,40:217-226.
[18]Vanni M,Merenda M,Barigazzi G,et al.Antimicrobial resistance of Actinobacillus pleuropneumoniae isolated from swine[J].Vet Microbiol,2012,156:172-177.
[19]Baltes N,Buettner F F,Gerlach G F.Selective capture of transcribed sequences(SCOTS)of Actinobacillus pleuropneumoniae in the chronic stage of disease reveals an HlyX-regulated autotransporter protein[J].Vet Microbiol,2007,123:110-121.
[20]Guo Dong-chun,Lu Yan,Zhang Ai-qin,et al.Identification of genes transcribed by Pasteurella multocida in rabbit livers through the selective capture of transcribed sequences[J].FEMS Microbiol Lett,2012,331:105-112.
[21]Fittipaldi N,Gottschalk M,Vanier G,et al.Use of selective capture of transcribed sequences to identify genes preferentially expressed by Streptococcus suis upon interaction with porcine brain microvascular endothelial cells[J].Appl Environ Microbiol,2007,73:4359-4364.
[22]Li Wei,Liu Lei,Qiu De-xin,et al.Identification of Streptococcus suis serotype 2 genes preferentially expressed in the natural host[J].Int J Med Microbiol,2010,300:482-488.
[23]Yi Li,Wang Yang,Ma Zhe,et al.Identification of genes transcribed by Streptococcus equi ssp.zooepidemicus in infected porcine lung[J].Microb Pathog,2013,59-60C:7-12.

