鸡痘病毒复制非必需位点的筛选及鉴定
张雪梅,赵 妍,3,张晓彩,王云峰,2*
(1.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/禽呼吸道病创新团队,黑龙江 哈尔滨 150001;2.哈尔滨动物生物制品国家工程研究中心有限公司,黑龙江 哈尔滨 150001;3.东北农业大学 动物科学与技术学院,黑龙江 哈尔滨 150030)
鸡痘病毒(Fowlpox virus,FPV)为痘病毒科禽痘病毒属成员,其基因组由一条双链DNA 构成,2000 年Afonso 公布了第一株FPV 全基因组序列,长度为288 539 bp[1]。FPV 基因组由两个约9.5 kb 的末端反向重复序列(ITR)及两个ITR 之间的中央编码区组成,中间区域相对保守,两端区域变异较大。
FPV 作为疫苗载体具有独特的优越性和良好的应用前景,FPV 基因组包含约260 个ORF,存在大量的复制非必需区可以作为外源基因的插入位点。近年,已有新城疫病毒(NDV)、传染性支气管炎病毒(IBV)、禽流感病毒(AIV)、马立克氏病病毒(MDV)和传染性喉气管炎病毒(ILTV)等病原的保护性抗原基因在FPV 中得以表达[2-6]。NDV 和AIV 的重组FPV(rFPV)已经发展成熟并在美国获得了商业疫苗的许可[2-3]。
之前,由于人们对FPV 的基因组了解有限,多偏向于随机选择的方法,但这种方法带有很大的盲目性,可能存在重组效率不高、筛选周期较长的问题[7-12]。随着FPV 基因组全序列的测定以及越来越多基因的功能被证实,定向克隆法筛选复制非必需区变的更为简便,而且成功率更高。本研究采用定向克隆法筛选到FPV 的一个新的稳定的复制非必需区,为构建多价rFPV 疫苗奠定了基础。
1 材料和方法
1.1 病毒株、载体及实验动物 表达ILTV gB 基因的rFPV(rFPV-gB)、pSY538、pEGFP-N1 和pUC18载体均由本实验室保存;9 日龄~10 日龄的SPF 鸡胚购自本研究所实验动物中心。
1.2 主要试剂 基因组提取试剂盒和质粒提取试剂盒均购自AXYGEN 公司;胶回收试剂盒购自OMEGA 公司;Ex Taq DNA 聚合酶和Premix Ex Taq(Perfect Real Time,DRR039A)均购自TaKaRa 公司;TurboFect Transfection Reagen 购自Thermo Scientific公司。
1.3 引物设计与基因扩增 根据GenBank 中登录的一株FPV 基因组全序列(AF198100.1)和pEGFP-N1的序列(U55762.1),利用Primer5.0 软件设计4 对引物(表1)。PCR 扩增条件为:95 ℃5 min;94 ℃20 s、50 ℃20 s、72 ℃90 s,30 个循环;72 ℃10 min。PCR 产物经1 %的琼脂糖凝胶电泳检测后回收,分别克隆至pMD18-T 载体中,鉴定阳性的重组质粒由华大基因测序。
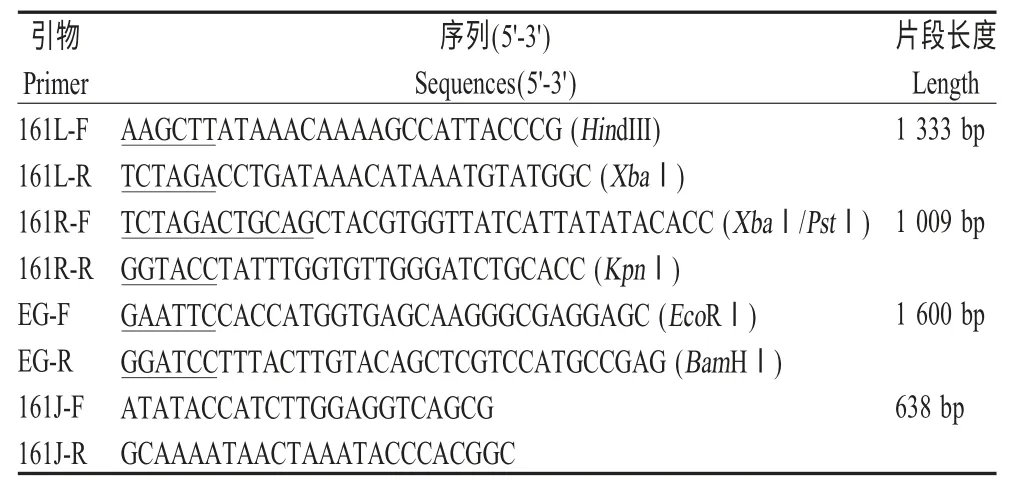
表1 引物及序列Table 1 Primers used in this study
1.4 转移载体的构建 将测序正确的左右同源臂酶切后先后克隆至pUC18 中,构建的重组质粒命名为pUC161;将pEGFP-N1 经Bam HⅠ/Eco RⅠ酶切后克隆至pSY538 载体中,构建重组质粒pSY538-EGFP。最后将含LP2EP2启动子的EGFP 经Pst Ⅰ/XbaⅠ酶切后插入到pUC161 的左右同源臂之间,构建转移载体pUC161-EGFP。
1.5 重组病毒rFPV-gB161gfp的拯救及纯化 将rFPV-gB 以104pfu 接种至培养约80 %单层的CEF中,37 ℃、5 % CO2条件下培养2 h 后弃培养液,按照转染试剂提供的说明书方法对pUC161-EGFP 进行转染,72 h 后收集转染液。在CEF 中连续传代,72 h~96 h 后利用荧光显微镜观察荧光,挑取蚀斑。连续纯化3 轮,采用引物161J-F/161J-R 进行重组病毒的纯度鉴定,将其命名为rFPV-gB161gfp。
1.6 重组病毒遗传稳定性分析与生长曲线测定将纯化的rFPV-gB161gfp 和亲本病毒rFPV-gB 在CEF 中连续传20 代,每隔5 代进行PCR 检测、荧光显微镜观察和毒价测定,并且测定生长曲线,比较rFPV-gB161gfp 与亲本病毒的生长特性。
2 结果
2.1 转移载体的构建及鉴定 以pUC18 为载体先后连接左右同源臂,并且在左右同源之间插入含有FPV 启动子的EGFP。对构建正确的重组质粒pUC161、pSY538-EGFP 及转移载体pUC161-EGFP经过酶切鉴定后,证明同源臂及EGFP 的连接均正确,重组质粒构建正确(图略)。
2.2 重组病毒rFPV-gB161gfp的拯救及鉴定 通过在CEF 中接毒后转染的方法,使转移载体与亲本病毒重组,获得拯救病毒rFPV-gB161gfp,并将其在CEF 中传代。经过3 轮蚀斑纯化后显示重组病毒形成的蚀斑均显示绿色荧光(图1),对F3 代的rFPVgB161gfp 进行PCR 纯度鉴定,结果表明,rFPVgB161gfp 已经纯化(图2)。
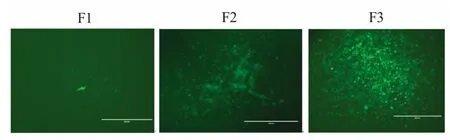
图1 rFPV-gB161gfp 3 轮蚀斑纯化结果Fig.1 The purification of rFPV-gB161gfp
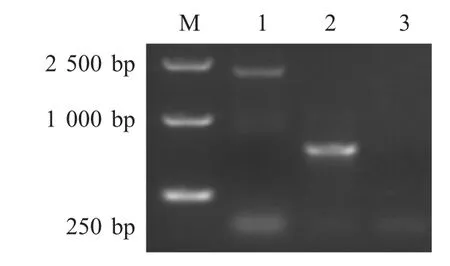
图2 rFPV-gB161gfp 纯度的PCR 鉴定Fig.2 PCR identification of rFPV-gB161gfp
2.3 重组病毒的遗传稳定性检测 每隔5 代分别对rFPV-gB161gfp 进行PCR 检测,结果表明每代rFPVgB161gfp 均能够扩增出目的片段,并且无亲本病毒的片段(图3)。每代病毒均采用荧光显微镜观察荧光,均能够观察到荧光蚀斑(图略)。
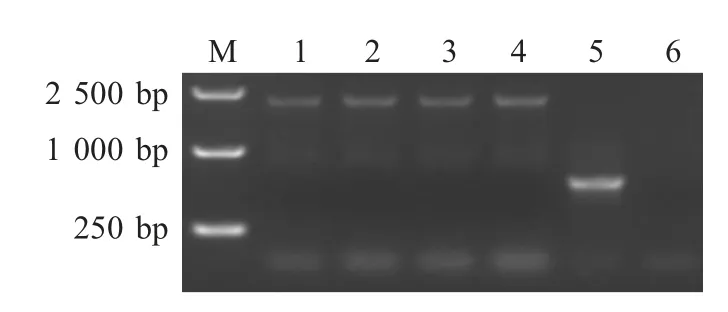
图3 rFPV-gB161gfp 每5 代PCR 鉴定结果Fig.3 Identification of rFPV-gB161gfp by PCR from different passages
2.4 rFPV-gB161gfp生长曲线测定与比较 将rFPV-gB161gfp 及亲本病毒分别以相同毒价接种CEF细胞,于各时间点收毒后进行蚀斑计数,绘制各自的生长曲线。结果显示rFPV-gB161gfp 与亲本病毒的生长曲线基本一致(图4)。
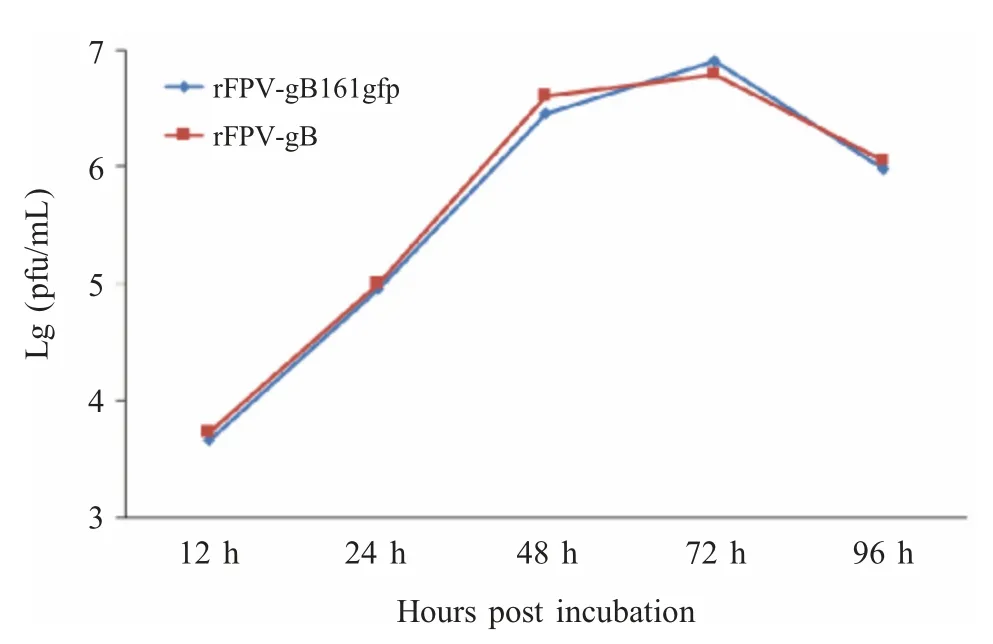
图4 rFPV-gB161gfp 与亲本病毒复制动力学比较Fig.4 Growth curves of the rFPV-gB161gfp and the rFPV-gB in CEF
3 讨论
FPV 基因组庞大,存在大量的复制非必需区可以作为外源基因的插入位点。然而,现在已经证实某些复制非必需区并不是严格的复制非必需区,某些基因虽然是病毒在体外复制非必需的,但它们可能与病毒毒力、病毒免疫逃避或宿主范围相关,若被缺失或者插入外源基因,可能导致病毒在体内的复制能力或者免疫逃避能力下降,使rFPV 无法在宿主体内发挥持久且有效的免疫效力[7-12]。同时,外源基因在不同的复制非必需区构成的rFPV 抵抗母源抗体干扰的能力也有差异[12]。目前关于FPV 复制非必需区片段序列与位置的报道比较少。因此,筛选并优化以我国FPV 疫苗株为基础的复制非必需区,进而构建相应的安全高效的rFPV 活载体疫苗非常必要。
本研究采用定向克隆的方法筛选FPV 的复制非必需区,为方便重组病毒的筛选,绿色荧光蛋白基因被插入到FPV 基因组复制非必需区作为筛选标记,构建了表达EGFP 的重组病毒rFPV-gB161gfp,通过荧光显微镜观察,使重组病毒的蚀斑易于筛选和纯化。遗传稳定性试验和复制动力学比较表明,rFPV-gB161gfp 遗传稳定性良好,并且与亲本病毒生长特性一致。本研究获得的稳定高效的FPV 复制非必需位点为rFPV 的相关研究以及疫苗的研发奠定了基础。
[1]Afonso C L,Tulman E R,Lu Z,et al.The genome of fowlpox virus[J].J Virol,2000,74(8):3815-3831.
[2]Webster R G,Kawaoka Y,Taylor J,et al.Efficacy of nucleoprotein and haemagglutinin antigens expressed in fowlpox virus as vaccine for influenza in chickens[J].Vaccine,1991,9(5):303-308.
[3]Boursnell M E,Green P F,Campbell J I,et al.Insertion of the fusion gene from Newcastle disease virus into a non-essential region in the terminal repeats of fowlpox virus and demonstration of protective immunity induced by the recombinant[J].J Gen Virol,1990,71(3):621-628.
[4]王云峰,智海东,王玫,等.表达传染性喉气管炎病毒gB基因重组鸡痘病毒疫苗的遗传稳定性评价[J].中国预防兽医学报,2001,23(6):426-429.
[5]Qiao Chuan-ling,Yu Kang-zhen,Jiang Yong-ping,et al.Protection of chickens against highly lethal H5N1 and H7N1 avian influenza viruses with a recombinant fowlpox virus co-expressing H5 haemagglutinin and N1 neuraminidase genes[J].Avian Pathol,2003,32(1):25-32.
[6]Chen Hong-ying,Yang Ming-fan,Cui Bao-an,et al.Construction and immunogenicity of a recombinant fowlpox vaccine coexpressing S1 glycoprotein of infectious bronchitis virus andchicken IL-18[J].Vaccine,2010,28(51):8112-8119.
[7]Boulanger D,Baier R,Erfle V,et al.Generation of reombninat fowlpox virus using the non-essential F11L orthologue as insertion site and a rapid transient selection strategy[J].J Virol Methods,2002,106(1):141-151.
[8]Boulanger D,Geren P,Smith T,et al.The 131-amino-acid repeat rigion of the essential 39-kilodalton core protein of fowlpox virus FP9,equivalent to vaccinia virus A4L protein,is nonessential and highly immunogenic[J].J Virol,1998,72(1):170-179.
[9]Boyle D B,Heine H G.Recombinant fowlpox virus vaccines for poultry[J].Immunol Cell Biol,1993,71(5):391-397.
[10]Boyle D B,Coupar B E.Construction of recombinant fowlpox viruses as vectors for poultry vaccines[J].Virus Res,1988,10(4):343-356.
[11]Binns M M,Britton B S,Mason C,et al.Analysis of the fowlpox virus genome region corresponding to the vaccinia virus D6 to Al region:location of,and variation in,non-essential genes in poxviruses[J].J Gen Virol,1990,71(12):2873-2881.
[12]Sun Lei,Liu Wu-jie,Chen Su-juan,et al.Influence of nonessential region on protective efficacy of recombinant fowlpox viruses[J].Wei Sheng Wu Xue Bao,2005,45(3):359-362.

