抑制表皮葡萄球菌生物膜形成的放线菌筛选及其活性研究
谢婷婷,陈 伟,2*
(1.塔里木大学生命科学学院新疆兵团塔里木盆地生物资源保护利用重点实验室,新疆阿拉尔 843300;2.塔里木大学动物科学学院新疆兵团塔里木畜牧科技重点实验室,新疆阿拉尔 843300)
表皮葡萄球菌(Staphylococcus epidermidis)是引起奶牛隐性乳房炎的重要条件致病菌之一。临床研究显示,表皮葡萄球菌的致病性逐年加强,原因可能是该病原菌极易形成生物膜(Biofilm,BF),而BF往往能够使病原菌有效地黏附定植在奶牛乳腺上皮细胞表面,损害宿主免疫细胞,这是奶牛乳房炎反复发作并且难以彻底治愈的主要原因[1]。
大多数放线菌能够产生具有生物活性的化合物,是抗生素的主要来源。研究表明,一些放线菌能够产生抑制细菌BF 形成的活性物质,如吲哚,蛋白酶类等,与传统抗生素机制完全不同的是这些活性物质在不影响病原菌生长的前提下,通过干扰病原菌BF 形成相关基因表达来实现抑制作用[2-3]。临床研究表明,病原微生物在抗生素选择性压力的存在下,会逐渐产生耐药性[4]。与传统的抗菌药物相比,这类活性物质所表现出的“零”抗生素筛选压力,在一定程度上能够缓解细菌耐药性问题。因此,细菌BF 形成抑制剂作为新一代抗生素,在抗BF 感染领域具有广泛的应用前景。本研究通过筛选获得具有抑制表皮葡萄球菌BF 形成活性的放线菌,为开发利用新疆放线菌资源以及寻找以抑制BF 形成为靶点的新型抗生素提供实验依据。
1 材料和方法
1.1 菌株及培养基 表皮葡萄球菌ATCC35984(生物膜形成阳性菌株)由上海复旦大学医学院馈赠;185 株新疆南疆地区土壤放线菌为本实验室保藏的菌株。
放线菌活化和斜面保存培养基(淀粉20 g、KNO31.0 g、K2PO40.5 g、MgSO40.5 g、FeSO40.01 g、琼脂16.0 g,pH7.2~7.4,121 ℃灭菌20 min 备用)、放线菌发酵培养基(小米15 g、蛋白胨5 g、葡萄糖5 g、CaCO31 g,pH7.2~7.4,121 ℃灭菌20 min 备用)、胰蛋白大豆肉汤培养基(Tryptic Soy Broth,TSB),均由本实验室配置备用。
1.2 放线菌菌株活化及发酵 将保藏的放线菌株菌液涂布于固体平板上,37 ℃培养4 d~5 d 进行活化,观察菌落生长情况。将活化的菌接种于发酵培养基中,28 ℃,180 r/min 发酵7 d~9 d,同时观察菌体生长情况。发酵液10 000 r/min 离心20 min,取上清,0.22 μm 无菌微孔滤膜过滤,去除菌体后,-20 ℃贮藏备用。
1.3 放线菌发酵液对表皮葡萄球菌BF形成的影响采用微量板半定量法[5]检测放线菌发酵液对表皮葡萄球菌的影响,按1∶100 的接种比例将过夜培养的菌液接种至TSB 培养基中,振荡摇匀。配制不同浓度梯度(50 %、40 %、30 %、20 %、10 %)的发酵液与菌液的混合液,取200 μL 混合液至96 孔细胞培养板中,每个浓度梯度接种4 孔。每一培养板中同时设空白对照(等体积的TSB 培养基和发酵液混合液)各4 孔。37 ℃静置培养24 h 后测定OD590nm,无菌水洗去未黏附细菌。56 ℃烘干固定1 h,利用0.5%结晶紫染色5 min,冲洗后晾干,测定OD490nm。所有BF 形成检测试验均在不同时间重复3 次。
1.4 放线菌发酵液对表皮葡萄球菌BF不同形成阶段的影响 参照文献[6]操作,按照体积比1∶100 的比例接种生长至对数期的菌液至TSB 培养基中,混匀。吸取100 μL 稀释菌液至96 孔板中,分别加入放线菌发酵液至终浓度为50%、40%、30 %、20 %、10 %,每个浓度梯度接种4 孔,每一培养板中同时设空白对照(等体积的TSB 培养基和对应浓度发酵液混合液)各4 孔。37 ℃静置培养4 h 后,按照1.4所述测定OD590nm、OD490nm值,检测初始黏附期BF形成。
按照上述操作将稀释菌液加入至96 孔板中,37 ℃静置培养4 h 后,重复以上步骤。37 ℃静置继续培养20 h,测定OD590nm和OD490nm值,检测放线菌发酵液对表皮葡萄球菌聚集阶段BF 形成的影响。
1.5 放线菌发酵液对表皮葡萄球菌BF结构的影响采用细胞爬片法[7]观察表皮葡萄球菌BF 结构。按照体积比1∶100 的比例接种生长至对数期的菌液至TSB 培养基中,配制终浓度为50 %的发酵液与菌液的混合液。根据玻片的大小,先在每个培养皿里预备放置玻片的位置滴少量培养基,然后放置玻片,随后加入含有放线菌发酵液的菌悬液,静置培养24 h,取出爬片,无菌水冲洗2 遍,加入冷丙酮于-20 ℃固定10 min,室温吹干。0.5 %结晶紫染色5 min,去离子水冲洗多余染料,40 倍光学显微镜下观察BF 爬片结构。
2 结果
2.1 具有抑制BF形成活性的放线菌筛选 选取185 株新疆南疆地区土壤放线菌菌株,采用微量板半定量法筛选抑制表皮葡萄球菌BF 形成能力的菌株,结果显示有96 株对表皮葡萄球菌BF 形成具有明显的抑制作用,抑制率高达50 %以上的菌株有118 株,占检测总菌株数的65.6 %(图1)。其中放线菌TRM46200、41337、46814 对表皮葡萄球菌生长无明显影响,但对其BF 形成具有明显的抑制作用,终浓度为50 %的发酵液其BF 抑制率分别为86.9%、87.8%、94.3%(图2)。
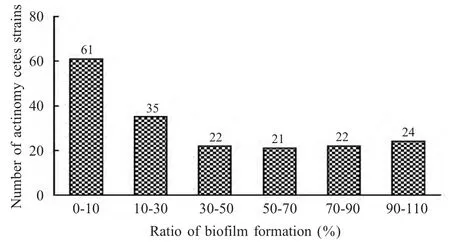
图1 185 株放线菌抑制表皮葡萄球菌BF 形成能力检测Fig.1 Histogram of biofilm modulation with 185 actinomycetes strains for biofilm formation of S.epidermidis ATCC35984
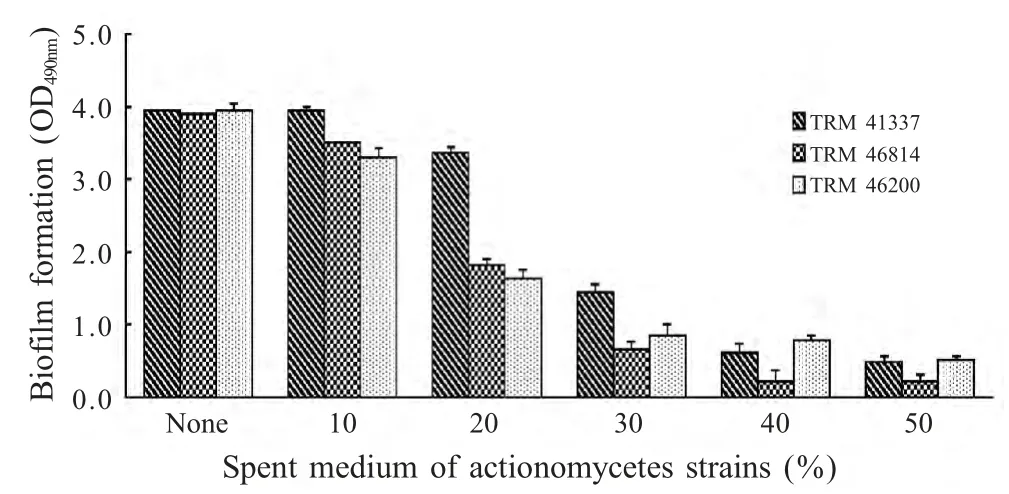
图2 放线菌TRM46200、41337、46814 发酵液抑制表皮葡萄球菌BF 形成能力检测Fig.2 Spent medium of TRM46200,41337,46814 reduces S.epidermidis ATCC35984 biofilm formation
2.2 放线菌对表皮葡萄球菌BF不同形成阶段的影响 以放线菌TRM46200、41337、46814 作为供试菌株,检测其发酵液对表皮葡萄球菌初始黏附期和聚集阶段BF 形成的影响,结果显示放线菌TRM46200、41337、46814 发酵液对表皮葡萄球菌BF 形成的影响主要在BF 形成初始黏附阶段,对聚集阶段影响不明显(图3)。
2.3 放线菌对表皮葡萄球菌BF结构影响 采用细胞爬片法观察放线菌对表皮葡萄球菌BF 结构的影响,结果显示分别加入终浓度为50 %的放线菌发酵液后,附着在固相载体(玻片)表面的菌体明显减少,BF 结构松散,易被破坏,而对照组结构致密(图4)。
3 讨论
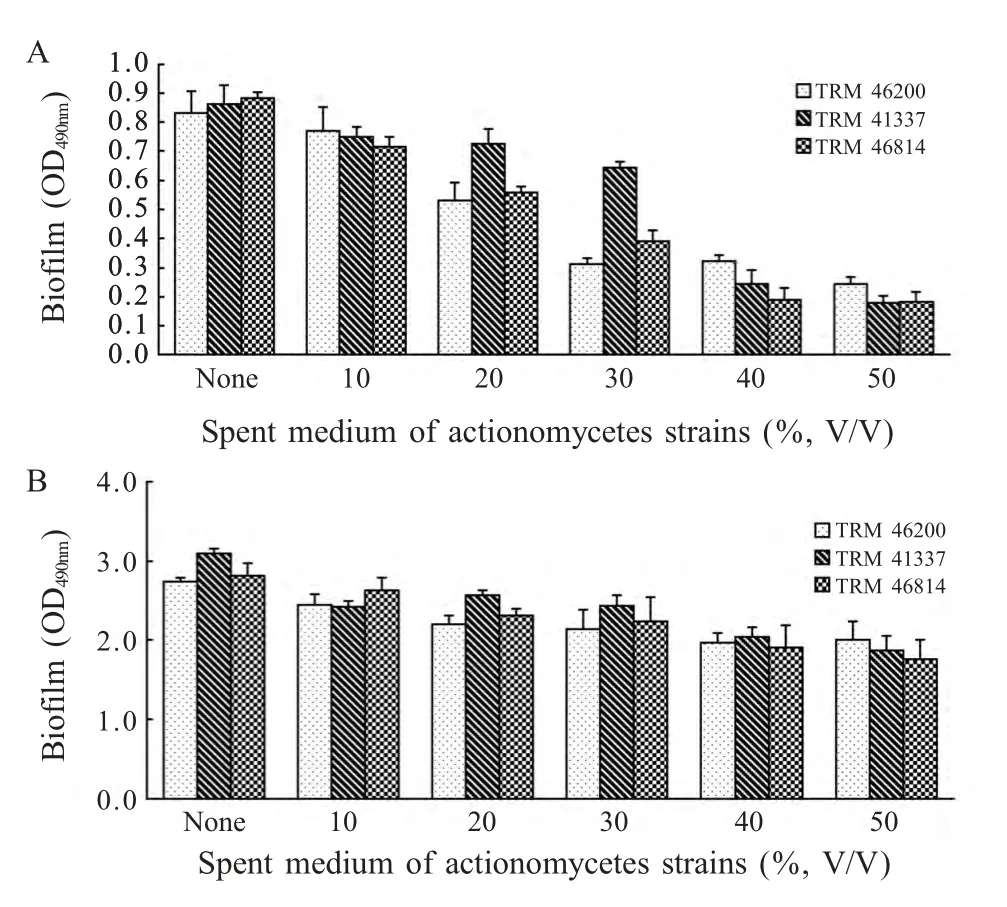
图3 放线菌TRM46200、41337、46814 发酵液对表皮葡萄球菌ATCC35984 初始黏附(A)和聚集阶段(B)BF 形成的影响Fig.3 Effect of TRM46200,41337,46814 spent medium on S.epidermidis ATCC35984 biofilm formation in attachment period(A)and aggregation period(B)
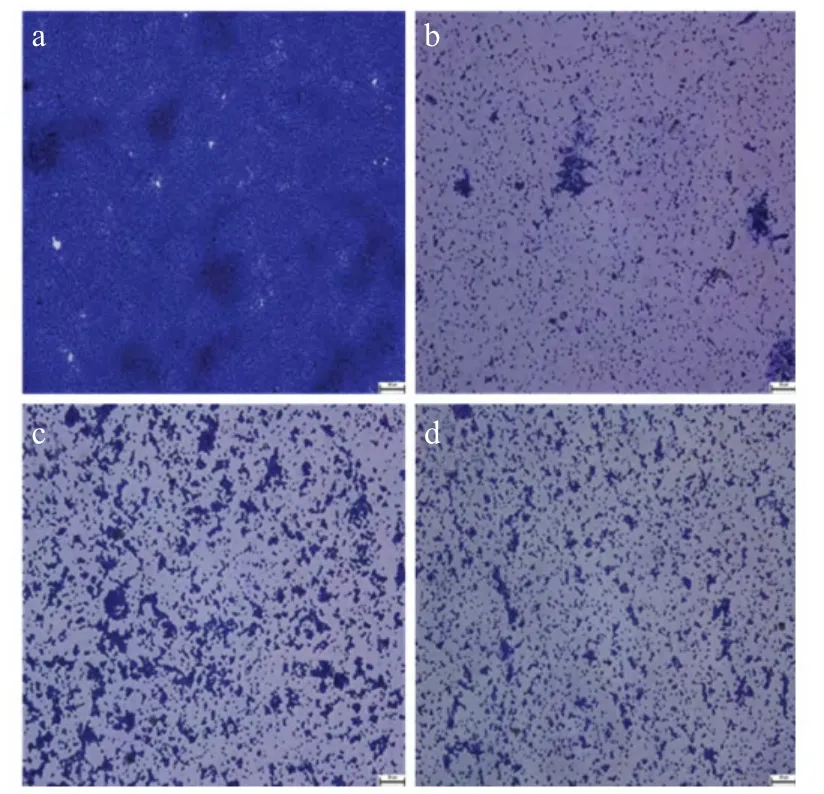
图4 放线菌TRM46200、41337、46814 发酵液对表皮葡萄球菌BF 结构的影响Fig.4 Microscopic images of S.epidermidis ATCC35984 biofilms grown in the absence and presence of actinomycetes spent medium
本研究选取本实验室从新疆南疆地区土壤分离鉴定的放线菌,筛选抑制表皮葡萄球菌BF 形成的活性菌株。BF 抑制活性筛选试验结果显示,新疆南疆地区土壤中分布的放线菌对表皮葡萄球菌具有较好的抗菌活性。3 株通过非抑菌途径表现出抑制BF形成的放线菌分别是拟诺卡氏菌属、链霉菌属和糖单孢菌属。已有文献报道,能够产生无抗菌活性但可以有效抑制病原菌BF 形成的活性物质的放线菌主要是链霉菌属的成员,如白色链霉菌(S.albus)[8];秋吉链霉菌(S.akiyoshiensis)[9];链霉菌属BFI 230、250[3,10]。而本次实验结果表明拟诺卡氏菌属及糖单孢菌属放线菌也可能是BF 抑制剂的重要来源。
细菌BF 形成机制十分复杂,外界及自身因素都会影响BF 的形成。任晓镤等研究表明人为改变培养基营养物质、各种理化因素(NaCl、pH 等)及模拟的体内环境因素等,均能够达到通过非抑菌途径而抑制BF 形成的效果[11]。在病原菌BF 形成周期中,容易受到外界干扰的两个时期是初始黏附期和聚集时期。通过研究放线菌TRM46200、41337、46814 发酵液对BF 形成周期的影响,发现上述3 株放线菌发酵液抑制表皮葡萄球菌BF 形成主要是通过影响其BF 形成的初始黏附期,一旦病原菌开始大量聚集,发酵液的抑制作用效果明显减弱。黏附细菌在增殖同时,合成多种胞外多糖黏附素PIA 和聚集蛋白Aap 等,借助这些胞外多聚物,细菌之间相互黏附并聚集[12]。在依赖ica BF 形成过程中,胞间多糖黏附素PIA 是由ica 操纵子编码的酶蛋白催化合成。表皮葡萄球菌ica 操纵子包含一个调节基因ica R,4 个功能基因(依次为ica A、ica D、ica B和ica C)[13]。ica R 调节4 个功能基因的转录,在BF形成过程中发挥不同的作用。任晓镤在研究醉马草对表皮葡萄球菌BF 形成的影响机制时发现,经过醉马草水煎液处理的表皮葡萄球菌,ica B 基因的表达量和aap 基因的表达量明显下调,ica R 基因的表达量明显上调[14]。同时,研究发现外源加入低浓度Aap 蛋白,明显抑制了初始黏附时期表皮葡萄球菌BF 的形成[15]。
本研究从新疆放线菌资源筛选表皮葡萄球菌BF形成抑制菌株,获得3 株对表皮葡萄球菌无抑菌活性但能抑制其BF 形成的放线菌菌株,可从放线菌的发酵液中提取相关活性物质,用以表皮葡萄球菌BF 感染所致各种疾病(如奶牛乳房炎)的治疗,从一定程度上可以减少耐药菌株的产生,为从抗病原菌BF 感染的角度开发新型抗生素提供实验依据。
[1]Hertl J A,Schukken Y H,Bar D,et al.The effect of recurrent episodes of clinical mastitis caused by gram-positive and gramnegative bacteria and other organisms on mortality and culling in Holstein dairy cows[J].J Dairy Sci,2011,94(10):4863-4877.
[2]Lee J H,Kim Y G,Kim C J,et al.Indole-3-acetaldehyde from Rhodococcus sp.BFI 332 inhibits Escherichia coli O157:H7biofilm formation[J].Appl Microbiol Biotechnol,2013,96(4):1071-1078.
[3]Park J H,Lee J,Kim C J,et al.Extracellular protease in Actinomycetes culture supernatants inhibits and detaches Staphylococcus aureus biofilm formation[J].Biotechnol Lett,2012,34(4):655-661.
[4]Casey G.Antibiotics and the rise of superbugs[J].Nurs N Z,2012,18(10):20-24.
[5]李英,成李静,陈伟.新疆南疆地区奶牛乳房炎性表皮葡萄球菌生物膜形成依赖型检测[J].新疆农业科学,2015,52(4):754-758.
[6]Heilmann C,Gerke C,Perdreau-Remington F,et al.Characterization of Tn917 insertion mutants of Staphylococcus epidermidis affected in biofilm formation[J].Infect Immun,1996,64(1):277-282.
[7]Packiavathy I A,Priya S,Pandian S K,et al.Inhibition of biofilm development of uropathogens by curcumin-an anti-quorum sensing agent from Curcuma longa[J].Food Chem,2014,148(1):453-460.
[8]You Jian-lan,Xue Xiao-li,Cao Li-xiang,et al.Inhibition of Vibrio biofilm formation by a marine actinomycete strain A66[J].Appl Microbiol Biotechno,2007,76(5):1137-1144.
[9]Bakkiyaraj D,Pandian S K.In vitro and in vivo antibiofilm activity of a coral associated actinomycete against drug resistant Staphylococcus aureus biofilms[J].Biofouling,2010,26(6):711-717.
[10]Lee J H,Kim Y G,Kim C J,et al.Antibiofilm activity of Streptomyces sp.BFI 230 and Kribbella sp.BFI 1562 against Pseudomonas aeruginosa[J].Appl Microbiol Biotechnol,2012,96(6):1607-1617.
[11]任晓镤,陈伟,张利莉.不同环境因素对表皮葡萄球菌生物被膜形成的影响[J].西北农业学报,2011,20(12):1-5.
[12]Sadovskaya I,Vinogradov E,Flahaut S,et al.Extracellular carbohydrate-containing polymers of a model biofilm-producing strain,Staphylococcus epidermidis RP62A[J].Infect Immun,2005,73(5):3007-3017.
[13]Rogers K L,Rupp M E,Fey P D.The presence of icaADBC is detrimental to the colonization of human skin by Staphylococcus epidermidis[J].Appl Environ Microbiol,2008,74(19):6155-6157.
[14]任晓镤.新疆南疆地区奶牛乳房炎性表皮葡萄球菌生物被膜形成及其影响因素的研究[D].新疆:塔里木大学,2012.
[15]李英.新疆南疆地区奶牛乳房炎性表皮葡萄球菌aap 基因的原核表达及功能研究[D].新疆:塔里木大学,2015.

