唐草片对依非韦伦在大鼠体内药动学的影响Δ
张丽军,姚亚敏,贾小芳,尹 林,刘晓茜,沈银忠,卢洪洲,程能能(.上海市公共卫生临床中心,上海 20508;2.复旦大学药学院,上海 200032)
目前艾滋病(AIDS)的治疗方法主要为抗病毒治疗[1]。然而,发展中国家的患者由于经济问题或其他临床症状,常用中草药进行辅助甚至替代治疗[2-5]。根据一份来自乌干达(Uganda)的报道:63.5%的人类获得性免疫病毒(HIV)阳性患者使用过中草药,同时使用抗病毒药物和中草药者占32.8%。在中国,唐草片是唯一一个被国家食品药品监督管理总局(CFDA)批准用于HIV 感染者的药物[6],正被越来越多的患者所使用。当唐草片与抗病毒药物同时使用时,唐草片能清除氧自由基[7],用于HIV 感染者以及AIDS 患者(CD4 淋巴细胞在100~400个/mm3之间),有提高CD4淋巴细胞计数的作用,可改善乏力、脱发、食欲减退和腹泻等症状,改善活动功能状况。然而唐草片成分非常复杂,其对抗病毒药物的影响令人担忧。为了降低潜在的药物-药物相互作用,药厂建议服用抗病毒药物60 min 后服唐草片。本课题组也通过临床试验验证了两者服用相隔60 min后唐草片不会影响抗病毒药物血药浓度的结论[8]。但如果两药同时服用将极大地方便患者,提高患者的服药依从性。为此,本研究在大鼠模型中研究唐草片与依非韦伦(EFV)同时服用时,唐草片对EFV药动学的影响,以为临床用药提供指导。
1 材料
1.1 仪器
LC-20AD 型高效液相色谱仪(日本Shimadzu 公司);API-3200型质谱仪(美国Biosystems公司)。
1.2 药品与试剂
EFV对照品(美国USP公司,批号:1234103,纯度:99.8%,规格:200 mg/瓶);替米沙坦(内标,北京柏雅方舟医药科技有限公司,批号:040511,纯度:99.5%,规格:500 mg/瓶);EFV片(美国Merck 公司,批号:S2520,规格:600 mg/片);唐草片(上海百岁行药业有限公司,批号:090301,规格:400 mg/片);乙腈、甲醇均为色谱纯,其余试剂均为分析纯,水为Millipore 超纯水。
1.3 动物
2 方法与结果[9-12]
2.1 色谱条件
色谱柱:Eclipse XDB-C18(150 mm×4.6 mm,5 μm),预柱C18(12.5 mm×4.6 mm,5 μm);流动相:0.1%甲酸水溶液-甲醇(20∶80,V/V),流速:0.5 ml/min;柱温:30 ℃;进样量:10 μl。
2.2 质谱条件
离子源:电喷雾电离(ESI);扫描方式:多反应监测(MRM);喷雾气压:35 psi;雾化器温度:550 ℃;气流速度:10 L/min;扫描时间为10 min。用于定量反应的离子对分别为内标替米沙坦:m/z515.2→276.2,EFV:m/z316.0→243.9。
2.3 溶液的制备
2.3.1 对照品溶液的制备 精密称取EFV对照品9.60 mg,用甲醇溶解并定容至10 ml量瓶中,制备成EFV质量浓度分别为750、1 500、3 000、6 000、12 000、24 000、48 000、96 000 ng/ml的对照品系列溶液,4 ℃贮藏,备用。
2.3.2 内标溶液的制备 精密称取替米沙坦10.85 mg,用甲醇溶解并定容至10 ml量瓶中,制备成质量浓度为1.080 mg/ml的内标溶液,用50%甲醇稀释制备内标工作液质量浓度为100 ng/ml,4 ℃贮藏,备用。
2.3.3 质控样品的制备 分别取不同质量浓度的对照品系列溶液10 μl 与100 ng/ml 内标溶液10 μl,加入100 μl 空白血浆中,制得质量浓度为1 500、3 000、7 680 ng/ml质控样品(即高、中、低质量浓度的质控样品),-80 ℃贮藏,备用。
2.4 血浆样品的处理
精密吸取大鼠血浆样品100 μl,置于1.5 ml 离心管中,加入50%甲醇10µl、100 ng/ml内标溶液10 μl、1 ml乙酸乙酯,涡旋混合5 min,以13 400×g离心10 min,吸取上清液(乙酸乙酯层)至另一1.5 ml 离心管中;下层溶液用1 ml 乙酸乙酯按上述方法再提取1 次,上清液合并至相应离心管中,37 ℃氮气吹干,残渣用100 µl 流动相复溶,涡流混合,取上清液10 μl进样。
2.5 方法学考察
2.5.1 方法专属性 分别取EFV 对照品、内标、空白血浆、空白血浆+EFV对照品(24 000 ng/ml)、给药后60 min大鼠血浆,按“2.4”项下方法处理样品后,按“2.1”“2.2”项下色谱、质谱条件进样测定。结果表明,血浆中内源性物质以及EFV 的可能代谢产物不干扰EFV 和内标的测定。质谱见图1;液相色谱-串联质谱见图2。

图1 质谱图A.内标;B.EFV对照品Fig 1 The mass spectrometry profilesA.internal standard;B.EFV control
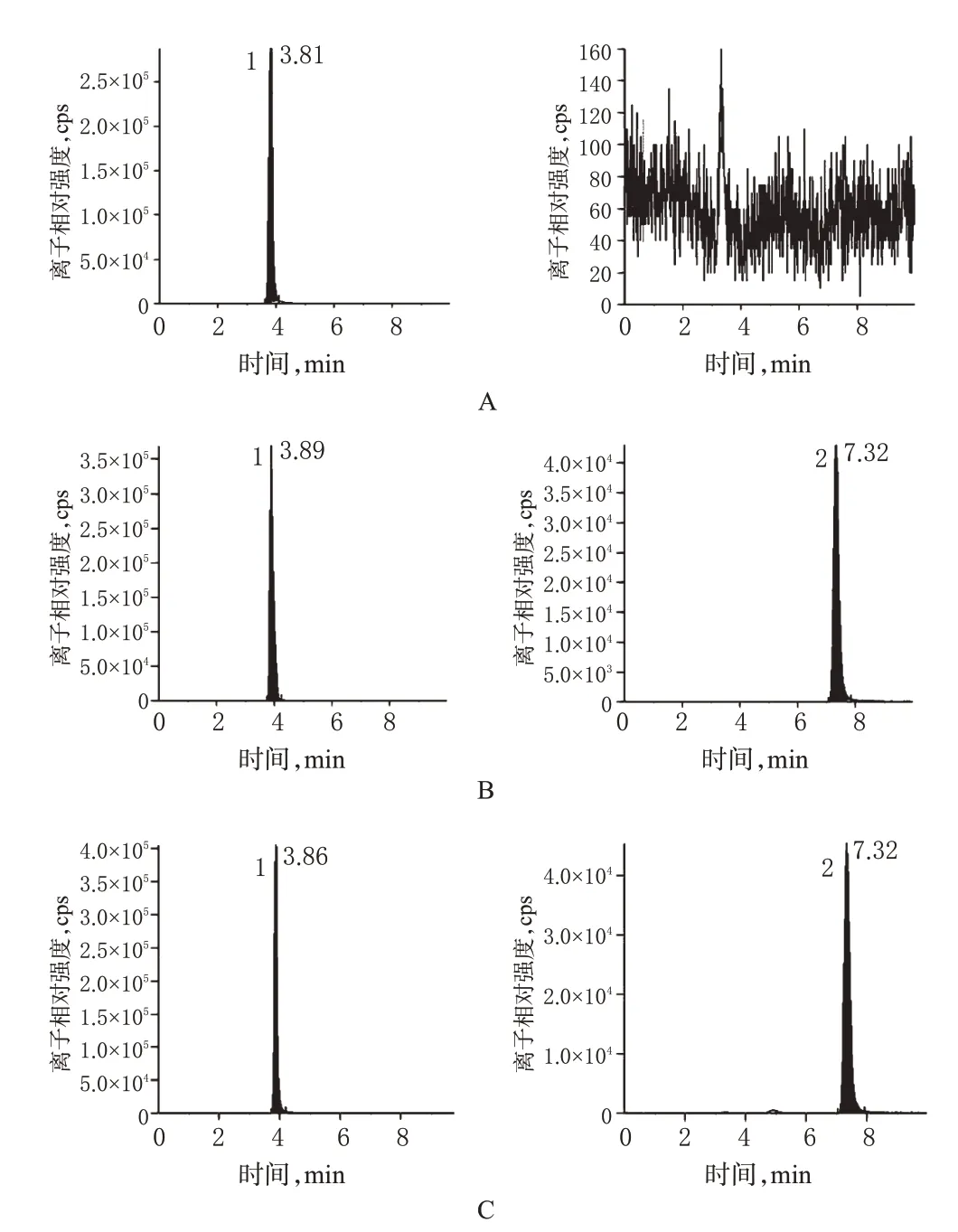
图2 液相色谱-串联质谱图A.空白血浆;B.空白血浆+EFV对照品;C.给药60 min后大鼠血浆;1.内标;2.EFVFig 2 LC-MS/MSA.blank plasma;B.blank plasma+EFV control;C.plasma 60 min after administration;1.internal standard;2.EFV
2.5.2 标准曲线的制备 按“2.3”项下方法制备对照品溶液,按“2.4”项下方法处理,按“2.1”“2.2”项下色谱、质谱条件进样测定。以EFV质量浓度(x)为横坐标、峰面积积分值和内标峰峰面积之比(y)为纵坐标,进行线性回归,得回归方程为y=1.79×10-5x+2.12×10-5(r=0.993 2)。结果表明,EFV 质量浓度在75.0~9 600 ng/ml 范围内与峰面积积分值和内标峰峰面积之比呈良好线性关系。
2.5.3 准确度与精密度试验 按“2.3”项下方法制备高、中、低质量浓度的质控样品各5 份,按“2.4”项下方法处理,按“2.1”“2.2”项下色谱、质谱条件考察日内精密度(5次)、日间精密度(3 d)、准确度(5次)。结果,3种质量浓度的质控样品日内、日间RSD<10%,准确度在92.1%~102.0%之间,表明该试验方法符合目前生物样品分析方法指导原则中的有关规定。精密度与准确度试验结果见表1。
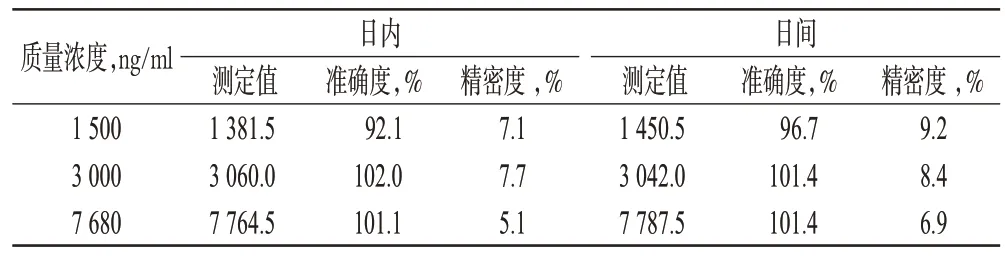
表1 精密度与准确度试验结果Tab 1 Results of precision test and accuraly
2.5.4 提取回收率试验 按“2.3”项下方法制备高、中、低质量浓度的质控样品各5 份,按“2.4”项下方法处理,按“2.1”“2.2”项下色谱、质谱条件进样测定。测得峰面积后与同质量浓度对照品溶液直接进样所得峰面积进行比较,计算提取回收率。结果显示,高、中、低质量浓度的质控样品有着一致的回收率。提取回收率试验结果见表2。
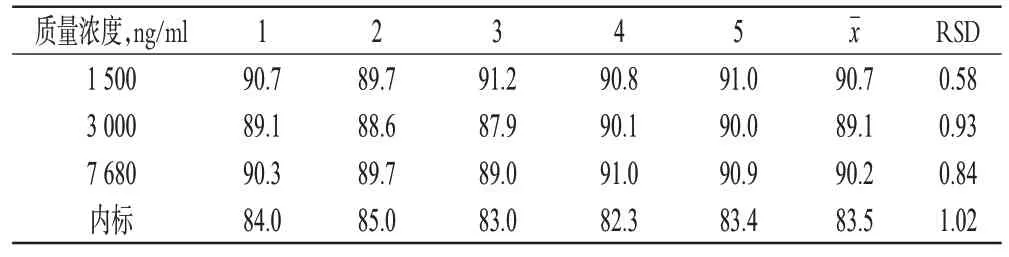
表2 提取回收率试验结果(n=5,%)Tab 2 Results of the extraction recovery test(n=5,%)
2.5.5 稳定性试验 取“2.3”项下高、中、低质量浓度的质控样品各6 份,置于4 ℃保存24 h 后测定,考察血浆样品的短期稳定性;取“2.3”项下高、中、低质量浓度的质控样品各6份,冷冻贮藏于-80 ℃,30 d 后测定,考察血浆样品的长期稳定性;取“2.3”项下高、中、低质量浓度的标准质控样品各6 份,冷冻贮藏于-80 ℃,在室温中充分解冻,然后再次冷冻,每次间隔24 h,重复3个冻融周期后测定,考察血浆样品的3个周期的冻融稳定性。结果,被测物在上述保存条件下测得实际值均在理论值的85%~115%范围波动,RSD<10.0%,表明EFV 在血浆样品中稳定性良好。稳定性试验结果见表3。
表3 稳定性试验结果(,n=6,%)Tab 3 Results of stability Test(,n=6,%)

表3 稳定性试验结果(,n=6,%)Tab 3 Results of stability Test(,n=6,%)
2.5.6 基质效应 取6份不同来源的大鼠空白血浆100 μl,经液-液萃取处理后,加入内标和不同质量浓度的混合溶液,制得高、中、低质量浓度的血浆样品(质量浓度与“2.3.3”项下相同),内标终质量浓度为10 ng/ml;另取流动相100 μl代替空白血浆,按“2.3”项下方法处理。按“2.1”“2.2”项下色谱、质谱条件进样测定,将测得的相应峰面积相比评价基质效应。结果,比值均在93.1%~101.2%之间,RSD<15%,表明大鼠血浆生物基质不影响样品测定。
2.6 药动学研究
18 只SD 大鼠随机均分为3 组,分别单独ig 给予EFV(54 mg/kg,即EFV 组)、同时ig 给予EFV 和唐草片(54 mg/kg+864 mg/kg,即EFV-0T 组)、ig 给予EFV60 min 后ig 给予唐草片(54 mg/kg +864 mg/kg,即EFV-60T 组)。用药剂量按照人体(以60 kg计)与大鼠的每1 kg体质量剂量折算系数6.25进行计算,EFV临床用药剂量为600 mg/次、唐草片为3 200 mg/次,tid;此外适当考虑大鼠的给药体积,最后确定EFV 和唐草片的用药剂量分别为54、864 mg/kg。于大鼠ig 给药前与末次给药后0.25、0.5、1.0、2.0、3.0、4.0、6.0、9.0、12.0、24.0 h 颈动脉取血,测定不同时间血药浓度,用DAS 2.0 软件分析计算药动学参数。采用SPSS 16.0软件处理实验数据。数据以表示;多组间比较先用单因素分析其正态分布,后以双向独立变量样品检测(Two-independent-samples tests)中的Mann-WhitneyU法进行统计。P<0.05为差异有统计学意义。
与EFV组相比,EFV-0T组大鼠体内EFV的血药浓度上升缓慢,但是EFV-60T组的EFV血药浓度-时间的曲线与EFV组基本一致。与EFV 组相比,EFV-0T 组EFV 的AUC0-∞和t1/2降低了近1 倍,MRT0-∞降低,CL/F明显提高。但是EFV-60T 组EFV 的药动学参数与EFV 组一致,差异无统计学意义(P>0.05)。在各组大鼠的tmax、cmax、V/F差异无统计学意义(P>0.05)。EFV 血药浓度-时间曲线见图3;EFV 药动学参数见表4。

图3 EFV血药浓度-时间曲线Fig 3 Plasma concentration-time curve of EFV
表4 EFV药动学参数(,n=6)Tab 4 Pharmacokinetic parameters of EFV(,n=6)

表4 EFV药动学参数(,n=6)Tab 4 Pharmacokinetic parameters of EFV(,n=6)
注:与EFV组比较,*P<0.05,**P<0.01Note:vs.EFV group,*P<0.05,**P<0.01
3 讨论
AIDS 患者有各种并发症,中药有利于患者的治疗[13]。但是中草药含有多种活性成分,且通常作用机制不明,使得中草药-西药的相互作用在所难免,可能会给患者带来危险[14-15]。为了降低唐草片对抗病毒药物的影响,临床上推荐服用抗病毒药物60 min 后服用唐草片。这种服用间隔给患者工作、生活带来不便,影响患者的依从性。因此,本研究在大鼠模型中比较同时ig给予EFV和唐草片或者ig给予EFV 60 min后再ig给予唐草片对大鼠体内EFV 血药浓度的影响。通过LC-MS/MS测定各组大鼠中EFV的血药浓度,发现EFV和唐草片同时服用明显降低了EFV 的血药浓度,因此建议至少要在服用EFV 60 min后再服用唐草片。
本研究首次在大鼠模型中比较研究不同的唐草片服药时间对EFV药动学参数的影响,但其具体机制仍需深入研究。
[1]覃鲁财,黄彩伴,赵凤山,等.某院2010-2012 年艾滋病免费抗病毒药品使用分析[J].中国药房,2013,24(38):3 591.
[2]Chu Y,Liu H.Advances of research on anti-HIV agents from traditional Chinese herbs[J].Adv Dent Res,2011,23(1):67.
[3]Langlois-Klassen D,Kipp W,Rubaale T.Who’s talking?Communication between health providers and HIV-infected adults related to herbal medicine for AIDS treatment in western Uganda[J].Soc Sci Med,2008,67(1):165.
[4]Dhalla S,Chan KJ,Montaner JS,et al.Complementary and alternative medicine use in British Columbia:a survey of HIV positive people on antiretroviral therapy[J].Complement Ther Clin Pract,2006,12(4):242.
[5]Peltzer K,Preez NF,Ramlagan S,et al.Use of traditional complementary and alternative medicine for HIV patients in Kwazulu-Natal,South Africa[J].BMC Public Health,2008,30(8):255.
[6]苏飞群,卢祝新.唐草片治疗艾滋病不良反应的观察与护理[J].现代中西医结合杂志,2010,19(6):739.
[7]殷建华,吴剑,杨克宗,等.抗艾滋病中成药唐草片抗氧化性的研究[J].中国现代中药,2009,11(12):38.
[8]陈军,张丽军,姚亚敏,等.唐草片对HIV感染者中依非韦伦代谢物无显著影响[J].中国艾滋病性病,2012,18(10):645.
[9]姚亚敏,张丽军.利福布汀与依非韦伦在大鼠体内药动学的相互作用研究[J].中国药房,2012,23(41):3 869.
[10]Zhang LJ,Yao YM,Sun JJ,et al.An LC-MS/MS method for simultaneous quantification of seven anti-HIV medicines in plasma of HIV-infected patients[J].Pharm Anal Acta,2010,1(1):1.
[11]Sun JJ,Chen J,Yao YM,et al.Minimum effective plasma concentration of efavirenz in treatment-naïve Chinese HIV-infected patients[J].Int J STD AIDS,2010,21(12):810.
[12]张丽军,姚亚敏,孙建军,等.高效液相色谱串联质谱法同时测定奈韦拉平、拉米夫定、司他夫定、齐多夫定和依非韦伦的血药浓度[J].中国药理学杂志,2010,26(2):133.
[13]曹玺.治疗艾滋病中药复方制剂的进展[J].云南中医中药杂志,2010,31(12):65.
[14]Pearl PL,Drillings IM,Conry JA.Herbs in epilepsy:evidence for efficacy,toxicity,and interactions[J].Semin Pediatr Neurol,2011,18(3):203.
[15]Chen XW,Serag ES,Sneed KB,et al.Clinical herbal interactions with conventional drugs:from molecules to maladies[J].Curr Med Chem,2011,18(31):4 836.

