硫酸吗啡口腔崩解片的稳定性研究Δ
胡 蕾,戴 青,刘 芳,刘松青#(.第三军医大学第一附属医院药学部,重庆 400038;2.重庆市第三人民医院药学部,重庆 40004)
硫酸吗啡口腔崩解片(Morphine sulfate orally disintegrating tablets,以下简称硫酸吗啡口崩片)具有服用方便、起效时间快、生物利用度高、镇痛效用强的特点,特别适用于无水条件下的镇痛治疗和吞水即呕吐的癌症化疗患者的治疗,也可有效地被运用于战伤救治[1-2]。已有研究讨论了吗啡口崩片的制备工艺及处方,本试验在其基础上进一步考察所选处方的质量及稳定性[3]。参考2010年版《中国药典》(二部)硫酸吗啡缓释片[4]项下要求,以高效液相色谱(HPLC)法测定口崩片中硫酸吗啡的含量,且通过影响因素试验、加速试验及长期试验评价该制剂的稳定性,初步确定该制剂贮藏条件及有效期。
1 材料
1.1 仪器
BP211D型电子天平(德国Sartorius公司);3531型离心机(美国Abbott公司);Waters2690液相色谱系统、2487双波长紫外检测器(美国Waters 公司);XMTD-7007 型药品稳定性试验箱(重庆市永生实验仪器厂)。
1.2 药品与试剂
硫酸吗啡口崩片(第三军医大学西南医院自制,批号:100401、100402、100403,片质量:60 mg,含硫酸吗啡:每片10 mg);硫酸吗啡对照品(中国食品药品检定研究院,批号:171238-200907,纯度:99.9%);庚烷磺酸钠、甲醇均为色谱纯,冰醋酸、氢醌均为分析纯。
2 方法与结果
2.1 含量测定HPLC方法学的建立与考察
2.1.1 色谱条件与系统适用性试验[4]色谱柱:Diamosil C18(2)(250 mm×4.6 mm,5 μm);流动相:甲醇-庚烷磺酸钠醋酸溶液(取庚烷磺酸钠2.02 g,加水适量溶解,加冰醋酸5 ml,加水稀释至1 000 ml,摇匀,50 ∶50,V/V),流速:0.8 ml/min;柱温:30 ℃;检测波长:233 nm;进样体积:10 μl。理论板数按硫酸吗啡峰计不低于1 000。
2.1.2 对照品溶液的制备 精密称取对照品适量(硫酸吗啡10.0 mg),加氢醌溶液(取氢醌30 mg,加流动相1 000 ml溶解)10 ml溶解成1 000 μg/ml;精密量取4 ml置于50 ml量瓶中,再以氢醌溶液稀释成80 μg/ml的母液,待用。
2.1.3 供试品溶液的制备 取自制硫酸吗啡口崩片样品20片,精密称定,研细,精密称取适量(60 mg,相当于硫酸吗啡10 mg),置于25 ml量瓶中,加氢醌溶液适量,超声处理使硫酸吗啡溶解,用氢醌稀释至刻度,摇匀,滤过;精密量取续滤液1 ml,置于25 ml量瓶中,加氢醌溶液稀释至刻度,摇匀成16 μg/ml溶液,即得。
2.1.4 方法专属性试验 取相同处方组成但缺主药成分的空白口崩片样品,按“2.1.3”项下方法制得硫酸吗啡阴性对照液,考察辅料对主药的测定是否存在干扰。阴性对照、对照品和供试品溶液(批号:100401)的色谱图见图1。

图1 高效液相色谱图A.阴性对照;B.对照品;C.供试品;1.溶剂;2.吗啡Fig 1 HPLC chromatogramsA.negative control;B.control;C.sample;1.solvent;2.morphine
由图1 可见,在此色谱条件下,硫酸吗啡与其他峰分离较好,且峰形良好,保留时间适中,辅料对其测定无干扰。
2.1.5 标准曲线的制备 分别精密吸取硫酸吗啡对照品母液(80 μg/ml)1.0、1.5、2.0、2.5、3.0 ml至10 ml量瓶中,以氢醌溶液定容成8、12、16、20、24 μg/ml的系列质量浓度溶液,摇匀,分别精密量取10 μl注入色谱仪,记录色谱图,测定峰面积。将峰面积(y)与质量浓度(x)作线性回归,得硫酸吗啡的线性回归方程:y=9.54×103x+1.37×103(r=0.999 9)。结果表明,硫酸吗啡检测质量浓度线性范围为8~24 μg/ml。
2.1.6 精密度考察 按“2.1.5”项下方法,精密制备高、中、低3种质量浓度(8、16、24 μg/ml)硫酸吗啡对照品溶液各5份,进样测定,计算日内精密度RSD 分别为0.38%、0.34%、0.42%(n=5);按上述方法连续5 d 分别进样测定,计算日间精密度RSD分别为0.89%、0.69%、0.31%(n=5)。
2.1.7 加样回收率考察 取硫酸吗啡口崩片样品(批号:100401)20 片,研细,精密称取适量(60 mg,相当于硫酸吗啡10 mg),置于25 ml量瓶中,加氢醌溶液适量,超声处理使硫酸吗啡溶解,用氢醌稀释至刻度(80 μg/ml);分别精密量取上述供试品溶液(80 μg/ml)0.5 ml 15 份置于10 ml 量瓶中,分为3组,分别加入硫酸吗啡对照品溶液(80 μg/ml)0.6、1.5、2.4 ml,分别用氢醌溶液稀释至刻度,定容成质量浓度为8.8、16、23.2 μg/ml的3种溶液,摇匀,离心,取上清液进样10 μl,测定硫酸吗啡含量,计算回收率。结果,平均回收率为98.36%~100.80%,表明该方法回收率较好,能满足含量测定的要求,详见表1。

表1 加样回收率试验结果(n=3)Tab 1 Results of recovery test(n=3)
2.1.8 溶液稳定性考察(1)样品稳定性试验:按照“2.1.3”项下方法进行样品处理后,分别考察其在仪器样品室10 ℃条件下0、6、12、24 h 的稳定性,及在常温下0、1、2、4 h 的稳定性。结果在两种条件下,测得含量的RSD 分别为0.82%和0.13%(n=4),表明样品的稳定性良好。(2)对照品稳定性:取80 μg/ml对照品母液置于-20 ℃下考察其稳定性。分别于0、1、3、6 d时取2 ml,置于10 ml量瓶中用氢醌溶液稀释成16 μg/ml,测定质量浓度,计算含量的RSD为0.88%(n=4),表明对照品溶液在-20 ℃条件下6 d内的稳定性良好。
2.1.9 样品含量测定 分别取3 个批号的样品各20 片研细,分别按“2.1.3”项下的方法制得供试品溶液,每批各3份,摇匀,进样,测定样品中的硫酸吗啡含量,结果分别为(102.40±0.51)%、(102.26±0.59)%、(101.13±2.60)%,RSD为0.68%,表明其含量符合口崩片的制剂标准。
2.2 硫酸吗啡口崩片的稳定性研究
根据2010年版《中国药典》对制剂稳定性考察要求[4],通过影响因素试验、加速试验及长期试验考察硫酸吗啡口崩片的稳定性,确定其贮存条件及有效期。
有关物质检测方法:参考硫酸吗啡缓释片标准中相关方法[4],取本品20片,精密称定,研细,精密称取细粉适量(约相当于硫酸吗啡20 mg),加氢醌溶液(取氢醌30 mg,加流动相1 000 ml溶解)10 ml,超声处理,使硫酸吗啡溶解,摇匀,滤过,取续滤液作为供试品溶液(2 000 μg/ml);精密量取适量,加氢醌溶液溶解并定量稀释制成每1 ml中约40 μg的溶液,作为对照溶液(40 μg/ml)。精密量取供试品溶液和对照品溶液各10 μl,分别注入色谱仪,记录色谱图至主成分峰保留时间的4倍。供试品溶液色谱图中如有杂质峰,各杂质峰面积之和不得大于对照溶液主峰面积(2.0%)。有关物质(%)=各杂质峰面积之和/对照溶液主峰面积×100%。
崩解时间测定方法:在5 ml玻璃小管中预先盛有37 ℃、2 ml蒸馏水,任取片剂1片置于小玻璃管中,即刻计时,静态条件下观察片剂崩解情况。以完全崩解且混悬介质全部通过710 μm筛网为准,记录崩解时间[3]。
2.2.1 影响因素试验 取批号为100402的样品,除去外包装,分别取20 片样品置于2 种高湿条件下[25 ℃、相对湿度(RH)92.5%,25 ℃、RH 75%]放置10 d。于第5 天、第10 天取样测定,并与0 d质量比较,结果见表2。

表2 吸湿增质量结果Tab 2 Results of hygroscopic growth
由表2可知,高湿(25 ℃、RH 92.5%)条件下样品的吸湿增质量率大于5%,因此选择高湿(25 ℃、RH 75%)条件下考察吸湿增质量率。
取批号为100402 的样品,除去外包装,分别取20 片样品置于强光(4 500 lx)、高温(60 ℃)、高湿(25 ℃、RH 75%)条件下,放置10 d。于第5天、第10天取样测定,并与0 d质量比较,结果见表3。

表3 影响因素试验结果Tab 3 Results of influential factors test
由表3可知,本品3种试验条件下放置10 d,外观、含量、有关物质各检查项均无明显变化,表明本品对强光、高温较稳定;另,吸湿增质量研究表明本品有一定吸湿性,但吸湿增质量率未超过规定标准(5%)。因此,模拟的上市包装选择铝塑包装,并于阴凉处密闭保存以维持产品质量稳定。
2.2.2 加速试验 3 批样品模拟上市包装,取适量,在40 ℃、RH75%条件下放置6个月。于1、2、3、6月分别取样测定,并与0月数据比较。结果表明各项检测指标未见明显变化,详见表4。
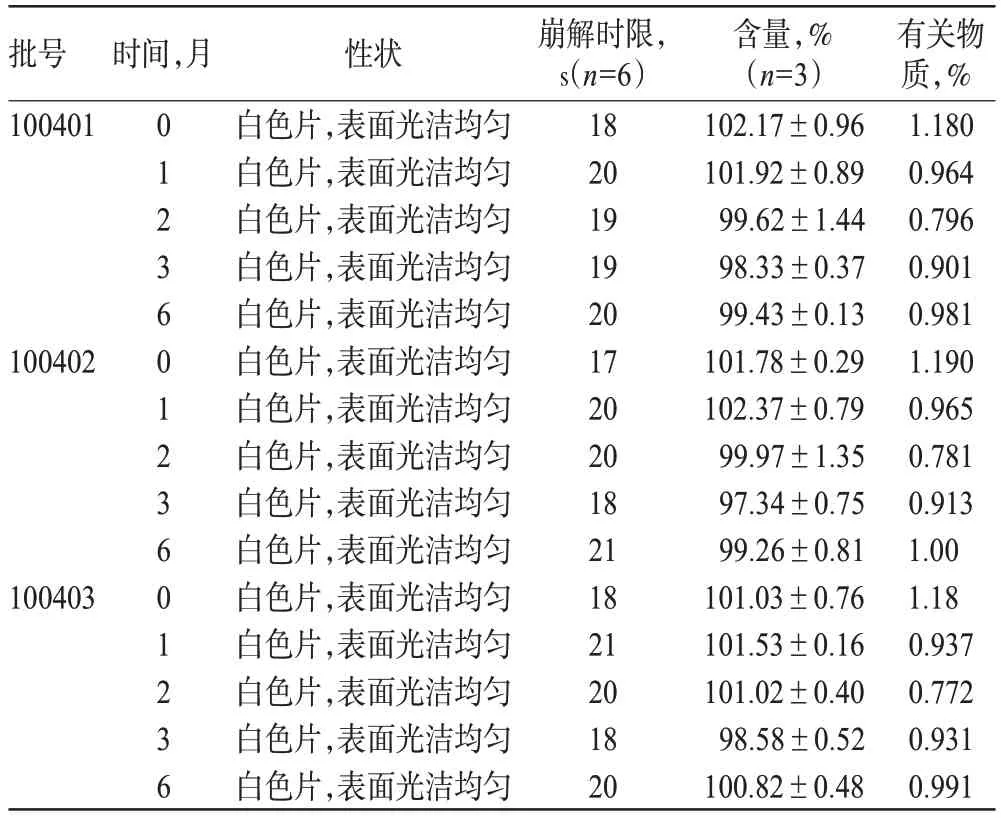
表4 加速试验结果Tab 4 Results of accelerated rest
2.2.3 长期试验 3 批样品模拟上市包装,取适量,在25 ℃、RH60%条件下放置,于3、6、9、12、18、24 个月分别取样测定,并与0 月数据比较。结果表明,各项检测指标结果基本稳定,吸湿增质量率未超过规定标准(5%);体外崩解时限检查结果表明样品在贮存的过程中崩解时限无明显变化趋势,详见表5。因此,长期稳定性考察结果表明本口崩片有效期可定为2年。
3 讨论

表5 长期试验结果Tab 5 Results of long-term test
本研究参照2010年版《中国药典》硫酸吗啡缓释片项下方法,以HPLC法测定硫酸吗啡口崩片中硫酸吗啡的含量。根据方法专属性试验结果表明,口崩片中的空白辅料不影响主药硫酸吗啡的测定,故不需改变方法学中的色谱条件即可准确测定硫酸吗啡含量。硫酸吗啡具还原性,在光照条件下能被空气氧化,可生成伪吗啡和N-氧化吗啡,而其水溶液在中性或碱性条件下易被氧化[5],故使用HPLC法测定硫酸吗啡含量时,流动相中加入了冰醋酸调节pH,且加入具有较强还原性质的氢醌(邻苯二醌)作为抗氧化剂,使检测时样品性质保持稳定[6-7]。
本品为口崩片,由于其制剂工艺的特点,所用辅料具有较强的吸湿性,因此需密封保存[8]。本文模拟上市包装选择泡罩包装(又称水泡眼包装)作为硫酸吗啡口崩片直接接触药品的包装材料。所用材料主要为药用铝箔及塑料硬片(PTP),泡罩包装外加防潮袋,符合原国家药品监督管理局《药品包装用材料、容器管理办法(暂行)》有关各项规定[9]。参考《中国药典》稳定性考察项目,根据影响因素试验、加速试验及长期试验(24 个月)结果,各项指标均符合规定,产品质量稳定,产品有效期确定为2年。
[1]陈新谦,金有豫,汤光.新编药物学[M].17 版.北京:人民卫生出版社,2011:164-165.
[2]陆彬.药物新剂型与新技术[M].2版.北京:人民卫生出版社,2005:636.
[3]胡蕾,刘芳,戴青,等.硫酸吗啡口腔崩解片的制备及处方工艺研究[J].中国药房,2014,25(37):3 493.
[4]国家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:973-974、附录199-201.
[5]郑虎.药物化学[M].5 版.北京:人民卫生出版社,2002:38-39.
[6]Pawula M,Barrett DA,Shaw PN.An improved extraction method for the HPLC determination of morphine and its metabolites in plasma[J].J Pharma Biomed Anal,1993,11(4):401.
[7]Laux-Biehlmann A,Mouheiche J,Vérièpe J,et al.Endogenous morphine and its metabolites in mammals:history,synthesis,localization and perspectives[J].Neuroscience,2013(233):95.
[8]柯学,王小琼,平其能.口腔崩解片及其制备技术进展[J].中国药学杂志,2005,40(11):801.
[9]国家食品药品监督管理局.药品包装用材料、容器管理办法:暂行[S].2000-10-01.

