金黄色葡萄球菌CP8-FnBPB-ClfA偶联蛋白对金黄色葡萄球菌性奶牛乳房炎的免疫效果研究
杨 岚,郝永清,何 焱,潘海婷,许金朋,于自民
(内蒙古农业大学兽医学院 微生物与免疫学实验室,内蒙古 呼和浩特 010018)
奶牛乳房炎(Bovine mastitis)是一种影响奶牛业发展的常见、多发疾病,给奶牛养殖业造成了严重经济损失,并对公共卫生和人类健康造成危害。奶牛乳房炎由多种微生物感染引起,其中最主要为金黄色葡萄球菌(Staphylococcus aureus)[1]。
S.aureus 的毒力因子主要有粘附素、荚膜多糖、毒素和酶[2],其对乳腺上皮细胞的粘附和定植被认为是S.aureus 性乳房炎的致病机制之一[3]。在感染的早期,只有当S.aureus 粘附到宿主细胞上时,荚膜和毒素才能开始表达,因此粘附是感染的关键。范鑫等研究表明,粘附素的纤连素结合蛋白(FnBPs)和凝集因子A(ClfA)在研制S.aureus 性乳房炎疫苗时具有重要意义[4]。而CPs 能够干扰中性粒细胞对S.aureus 的吞噬作用,逃避宿主的免疫防御系统,导致S.aureus 易于感染乳腺组织[5]。研究表明,将免疫原性较好的FnBPB-ClfA 融合蛋白作为载体和CP 偶联免疫小鼠可以产生良好的免疫效果[6]。
脂质体(Liposome)、氢氧化铝(ALUM)及大肠杆菌不耐热肠毒素B(LTB)均为有效的疫苗佐剂[7-10]。关于针对奶牛S.aureus 毒力因子的疫苗研究大多只进行了实验动物免疫保护试验,本实验将脂质体包被的CP8-FnBPB-ClfA、ALUM 乳化的CP8-FnBPBClfA,及ALUM 乳化CP8-FnBPB-ClfA 后与LTB 混合分别免疫泌乳期奶牛,检测免疫后不同期血清中IgG 和IgA、乳汁中IgG 含量、体细胞数(Somatic cell count,SCC),以评价其对S.aureus 性奶牛乳房炎的免疫效果。
1 材料和方法
1.1 主要实验材料 牛源血清IgG ELISA 试剂盒、牛源血清IgA ELISA 试剂盒、牛源牛乳IgG ELISA试剂盒购自R&D SYSTEMS 公司;SCC 检测试剂盒及ADAM-SCC 检测仪购自Digital Bio Technology 公司;快速革兰氏染色液购自珠海贝索生物技术有限公司;24 头健康的同龄(2 岁~3 岁)同胎次并且生产时间差30 d 以内的泌乳期荷斯坦奶牛由内蒙古呼和浩特市和林格尔县恩和牧场提供。
1.2 抗原的制备
1.2.1 CP8-FnBPB-ClfA 的制备 按照文献[6]的方法,将已纯化浓度为72.94 %的CP8 通过EDC 法与FnBPB-ClfA 偶联,制备CP8-FnBPB-ClfA 偶联物,使用BCA 试剂盒测定蛋白浓度,调整蛋白浓度至0.81 mg/mL 进行免疫抗原的制备。
1.2.2 脂质体佐剂抗原的制备 将卵磷脂、胆固醇和磷脂酰乙醇胺按质量比7∶3∶2 溶于体积比为2∶1 的三氯乙烷、甲醇混合溶液中,0.45 μm 滤膜过滤,45 ℃水浴后抽真空干燥。将干燥后所得磷脂片层每100 mg 加入5 mL CP8-FnBPB-ClfA,振荡混匀,制成脂质体佐剂抗原。
1.2.3 ALUM 佐剂抗原的制备 250 mL 5%Al2(SO4)3溶液与100 mL 5 % NaOH 溶液混合,强烈搅拌,生理盐水离心洗涤沉淀2 次,在沉淀中再次加入20 mL生理盐水,使沉淀悬浮成为悬浊液,即得ALUM 佐剂,将其与CP8-FnBPB-ClfA 1∶1(v/v)混合,使用漩涡混合器,以3 000 r/min 的速度振荡30 min,充分混匀,即为ALUM 佐剂抗原。
1.2.4 LTB 佐剂抗原的制备 将LTB 与1.2.3 中ALUM 乳化抗原直接混合,使LTB 终浓度为40μg/mL,制成LTB 佐剂抗原。
1.3 动物分组及实验设计 30 头奶牛随机分为5组,分组及处理情况见表1。

表1 实验动物免疫分组Table 1 Immunization groups of laboratory animals
用不同佐剂抗原进行免疫接种,采取臀部肌肉注射方式,每21 d 免疫一次,共免疫3 次。免疫剂量以抗原量计算,5 mg/头。
1.4 牛乳中SCC测定 采集各时段乳汁样品,采样时弃前3 把乳,每天每次分别在早、中、晚采集,将这3 次取得的乳汁样品均匀混合,吸取中间液面的混合乳汁样品100 μL,与染液1∶1(v/v)混合,上下颠倒混匀,吸取10 μL 至SCC 检测芯片孔道,通过SCC 计数仪进行检测。
1.5 牛血清中CP8-FnBPB-ClfA抗体水平测定采用ELISA 法对牛血清中CP8-FnBPB-ClfA 抗体进行测定。以CP8-FnBPB-ClfA 包被酶标板,分别以免疫牛和对照牛的待测血清为一抗,兔抗牛IgG-HRP为二抗(1∶2 000),TMB 显色,测定OD490nm值。
1.6 牛血清中总IgG、IgA含量及牛乳中IgG含量测定 使用牛源血清IgG ELISA 试剂盒和牛源血清IgA ELISA 试剂盒检测血清中的IgG、IgA 含量,采用牛源牛乳IgG ELISA 试剂盒检测牛乳中的IgG 含量,试验步骤参见试剂盒说明书。
1.7 数据分析 采用SAS 9.0 统计学软件(SAS Institute Inc,Cary,NC)分析实验数据。
2 结果
2.1 牛乳中SCC测定 使用SCC 计数仪对实验组和对照组免疫前后不同时间乳汁样品中的SCC 进行测定。结果显示,各免疫组奶牛乳汁中SCC 保持稳定,低于50 万个/mL,与对照组相比差异极显著(p<0.01),而对照组SCC 呈现波动状态,均高于50万个/mL,伴有患乳房炎的可能;在免疫期间,3、4 组奶牛乳汁中的SCC 低于1、2 组,与之相比差异显著(p<0.05),但3、4 组间差异不显著(p>0.05)(图1)。
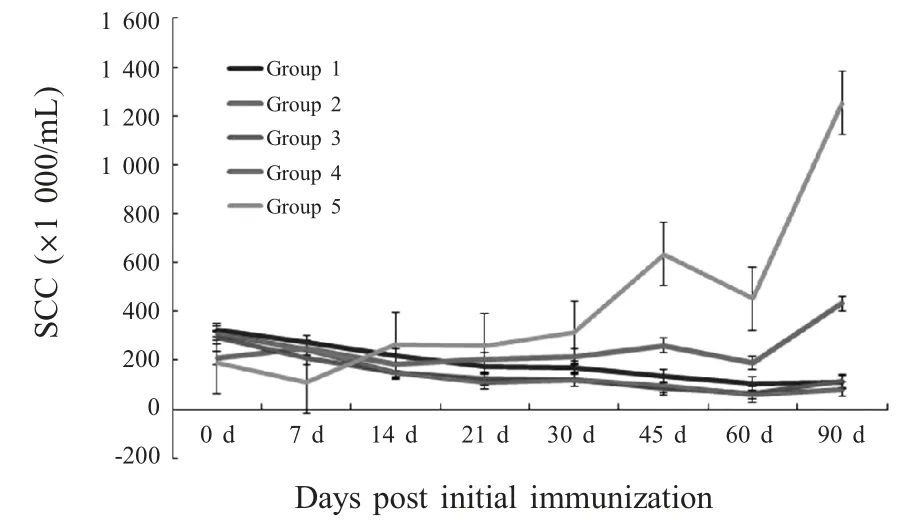
图1 免疫期内SCC 数动态变化Fig.1 The dynamic changes of SCC in immunity period milk
2.2 牛血清中CP8-FnBPB-ClfA抗体测定 采用间接ELISA 法,分别对免疫组及对照组牛血清进行CP8-FnBPB-ClfA 抗体测定。结果显示,免疫14 d后,各免疫组奶牛血清中CP8-FnBPB-ClfA 抗体水平升高,与对照组相比差异极显著(p<0.01);2 组抗体水平升高,与其他各免疫组相比差异极显著(p<0.01),但其水平随时间延长而下降;免疫21 d 后,3、4组抗体水平高于其他各免疫组,与各免疫组相比差异显著(p<0.05),3、4 组间差异不显著(p>0.05)(图2)。
2.3 牛血清中IgG及IgA含量测定 使用牛源IgG ELISA 试剂盒和牛源IgA ELISA 试剂盒对各组奶牛血清中的IgG 及IgA 含量进行测定。结果显示,免疫14 d 后,各免疫组奶牛血清中IgG 及IgA 水平升高,与对照组相比差异极显著(p<0.01);2 组中IgG及IgA 含量升高,与其他免疫组相比差异极显著(p<0.01),但其含量随时间的延长而下降;免疫21 d后3、4 组奶牛血清中IgG 及IgA 水平高于其他各免疫组,与各免疫组相比差异极显著(p<0.01),3、4组间差异不显著(p>0.05)(图3)。
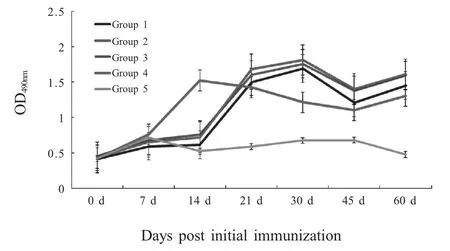
图2 免疫期内牛血清中CP8-FnBPB-ClfA 抗体测定结果Fig.2 The results of test CP8-FnBPB-ClfA antibody in immunity period in bovine serum

图3 奶牛血清中IgG(A)及IgA(B)含量测定结果Fig.3 Test results of bovine IgG(A)and IgA(B)concentration in serum
2.4 牛乳中IgG含量测定 使用牛源IgG ELISA 试剂盒对各组奶牛乳中的IgG 含量进行测定。结果显示,免疫14 d 后,各免疫组奶牛乳汁中IgG 水平升高,与对照组相比差异极显著(p<0.01);2 组乳汁中IgG 水平升高,与其他免疫组相比差异极显著(p<0.01),但其含量随时间的延长而下降;免疫21 d 后3、4组乳汁中IgG 水平高于其他各免疫组,与各免疫组相比差异极显著(p<0.01),3、4 组间差异不显著(p>0.05)(图4)。
3 讨论
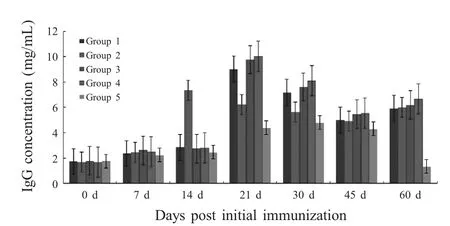
图4 奶牛乳中IgG 含量测定结果Fig.4 Test results of bovine IgG concentration in milk
SCC 主要来自于血液的白细胞(Leucocytes),可分为淋巴细胞和嗜中性白细胞两种[11]。由于乳中的白细胞具有抵御外界微生物感染的作用,因此在细菌入侵乳房后,白细胞通过毛细血管内皮间隙迁移至炎症组织,白细胞数量升高,该乳区的SCC 也随即增多[12]。许多国家均将SCC 作为衡量乳品质的重要指标。通常,国际上规定以SCC 每毫升50 万为界定乳房炎的标准[13]。因此,SCC 可以作为监测奶牛乳房炎的可靠指标之一。
将包含Fnbp 和ClfA 的DNA 疫苗免疫乳腺已感染S.aureus 的奶牛,能够产生针对Fnbp 和ClfA 的抗体[14]。用CP5 免疫奶牛,可以产生持久的免疫学反应[15]。因此,本实验采用CP8-FnBPB-ClfA 免疫泌乳期奶牛具有可行性。
经本研究证明,用CP8-FnBPB-ClfA 或CP8-FnBPB-ClfA 与不同佐剂混合免疫泌乳期奶牛,在免疫期内,能够有效降低奶牛乳汁中的SCC 至正常水平,或使SCC 基本维持在正常范围内不变,在一定程度上预防和治疗S.aureus 性奶牛乳房炎,改善牛乳品质,提高牛乳质量。抗体含量是评价体液免疫效果的关键指标,本实验通过间接ELISA 及双抗体夹心ELISA 法,对奶牛血清及乳汁中的抗体水平进行测定。结果显示,以ALUM 佐剂乳化的CP8-FnBPB-ClfA 或ALUM 佐剂乳化的CP8-FnBPB-ClfA与LTB 混合后免疫泌乳期奶牛时,血清及乳汁中的抗体水平最高,持续时间最长;但ALUM 佐剂乳化抗原是否与LTB 混合,免疫效果差异不显著(p>0.05)。以上结果表明,CP8-FnBPB-ClfA 经ALUM 佐剂乳化免疫奶牛,可提高机体抗体水平,诱导奶牛的体液免疫反应,因此ALUM 佐剂乳化的CP8-FnBPB-ClfA有望用于S.aureus 性奶牛乳房炎亚单位疫苗的进一步研究,为S.aureus 性奶牛乳房炎的免疫防治提供实验依据。
[1]Naidu A S,Forsgren A.Comparison between lactoferin and subepothelial matrix protein binding in Staphylococcus aureus associated with bovine mastitis[J].Dairy Sci,1991,74:3353.
[2]Brouillette E,Talbot B G,Malouin F.The fibronectin-binding proteins of Staphylococcus aureus may promote mammary gland colonization in a lactating mouse model of mastitis[J].Infect Immun,2003,71:2292-2295.
[3]Sinha B,Fraunholz M.Staphylococcus aureus host cell invasion and post-invasion events[J].Int J Med Microbiol,2010,300(2-3):170-175.
[4]Fan Xin,Hao Yong-qing,Zhang Ai-rong,et al.Construction and prokaryotic expression of the co-expression plasmid with FnBPB-CLFA gene encoding Staphylococcus aureus adhesion[J].Chi Vet Sci,2011,41(02):173-177.
[5]Foster T J.Immune evasion by Staphylococci[J].Nat Rev Microbiol,2005,3(12):948-958.
[6]Liu Xiu-li,Hao Yong-qing,Wang Shu-yi,et al.Assessment of immunogenicity of CP8,ClfA-FnBPB antigens[J].Am J Animal Vet Sci,2013,8(3):134-141.
[7]Alving C R.Liposomes as adjuvants for vaccines[R].Walter Reed Army Institute of Research Washington DC:1997.
[8]Gupta R K.Aluminum compounds as vaccines adjuvants[J].Adv Drug Deliv Rev,1998,32(3):155-172.
[9]Millar D G,Hirst T R,Snider D P.Escherichia coli heat-labile enterotoxin B subunit is a more potent mucosal adjuvant than its closely related homologue,the B subunit of cholera toxin[J].Infect Immun,2001,69:3476-3482.
[10]李娜,周伟芳,刘慧敏,等.疫苗佐剂的研究现状和发展趋势[J].中国预防兽医学报,2013,35(1):81-86.
[11]Waage S,Mork T.Bacteria associated with clinical mastitis in dairy heifers[J].J Dairy Sci,1999,82:4712-4719.
[12]Marcus E,Kehrli J R.Factor affecting milk somatic cell and their role in health of the bovine mammary gland[J].Dairy Sci,1994,77:619-627.
[13]William J M,David M,Alan K.Influence of somatic cell count and storage interval on composition and processing characteristics of milk from cows in late lactation[J].Aust J Dairy Technol,2001,56:213-218.
[14]郝建国,梁淑萍.日本学者对体细胞数与乳房炎关系的论述[J].中国奶牛,2002,1:52-54.
[15]Tollersrud T,Zernichow L.Staphylococcus aureus capsular polysaccharide type 5 conjugate and whole cell vaccines stimulate antibody responses in cattle[J].Vaccine,2001,19:3896-3903.

