鸡传染性喉气管炎病毒LJS09株致病性的研究
蒋 露,李慧昕,韩宗玺,孔宪刚,刘胜旺
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/禽呼吸道病创新团队,黑龙江 哈尔滨 150001)
鸡传染性喉气管炎病毒(Infectious larygotracheitis virus,ILTV)为疱疹病毒科、α-疱疹病毒亚科、传染性喉气管炎病毒属成员,也称禽疱疹病毒1型(Gallid herpesvirus1)[1],由该病毒引起的鸡传染性喉气管炎(ILT)是一种以急性上呼吸道症状为主的高度接触性传染病[2]。该病主要感染鸡,以呼吸困难、喘息、流鼻涕、结膜炎、咳出带血分泌物,剖检可见喉头和气管粘膜肿胀出血,气管内有干酪性分泌物堵塞为特征[3]。发病鸡出现体重及产蛋下降,并伴有不同程度的死亡,给养鸡业造成严重经济损失。
从上世纪50年代以来我国大部分地区有不断发生该病的报道,1992年以后在我国一些地区呈地方流行[4]。对于我国分离的一些病毒株如王岗株、烟台株、安徽株和河北株等,已有关于其致病性的相关报道[5]。由于ILTV LJS09分离株分离自现地死亡率较高ILTV感染鸡群,因此为了解该分离株的致病能力,本研究以人工感染SPF鸡的方式通过各项指标评价其致病性。通过对ILTV LJS09分离株致病性的研究,为其他ILTV流行株致病能力的研究提供了参考。
1 材料和方法
1.1 病毒株及实验动物 ILTV LJS09分离株由本实验室分离自江苏省某未经免疫的鸡场;4周龄40只SPF鸡由中国农业科学院哈尔滨兽医研究所实验动物中心提供。
1.2 主要试剂 ExTaqDNA聚合酶、pM18-T载体和SYBR Green qPCR Kit购自TaKaRa公司;DNA GelExtractionKit购自OMEGA公司;PlasmidMiniprep Kit及DNA AxyPrep Body Fluid Viral DNA/RNA Miniprep Kit购自AxyGen公司;ILTV抗体检测试剂盒购自百测公司。
1.3 EID50的测定 将ILTV LJS09株进行10倍倍比稀释,每个稀释度经尿囊膜途径接种5枚9日龄SPF鸡胚,37℃孵育4 d后,观察尿囊膜水肿和鸡胚变化,并PCR检测病毒,采用Reed-Muench的方法测定病毒的EID50,测定的病毒效价为10-3.7EID50。
1.4 实验动物分组及人工感染 将40只4周龄SPF鸡随机分为感染组和对照组,每组20只。感染组以102EID50/只接种ILTV LJS09株,接种途径为滴鼻点眼;对照组以滴鼻点眼途径每只接种相同剂量的正常鸡胚尿囊液。于人工感染后第5 d随机迫杀10只,每只采集18个组织样品(喉头、气管、肝脏、脾脏、肺脏、肾脏、胸腺、胰腺、腺胃、十二指肠、小肠、大肠、盲肠、盲肠扁桃体、法氏囊、脑、哈德氏腺和骨髓),并观察剖检变化。剩余10只鸡,于人工感染后每天观察症状,连续观察20 d,并给予临床评分(评分标准:正常=0分,轻度=1分,重度=2分,死亡=3分)。计算临床指数(总得分/总鸡数)、发病率(发病鸡数/总鸡数)、死亡率(死亡鸡数/总鸡数)。
1.5 嗜性器官病理组织学观察 根据荧光定量PCR检测结果,选取病毒载量较高的组织,包括喉头、气管、脑、肺脏、盲肠、腺胃、大肠和肾脏组织样品,病理组织学检查由本所诊断中心病理组检测,按常规进行组织切片制作与观察。
1.6 血清抗体水平检测 分别于病毒接种后第4 d、8 d、12 d、16 d和20 d采集接种组和对照组鸡血清样品,按照ILTV抗体检测试剂盒说明书操作检测血清抗体水平,在405 nm~410 nm波长读值,并计算S/P值,按试剂盒标准,S/P值>0.5判为阳性,S/P值≤0.5判为阴性。
1.7 荧光定量P C R检测病毒组织分布 荧光定量PCR参考文献[6]所设计的引物和探针,引物序列为:5'-CCTTGCGTTTGAATTTTTCTGT-3'/5'-TTCGT GGGTTAGAGGTCTGT-3';特异探针为:5'-FAM-CA GCTCGGTGACCCCATTCTA-BHQ-1-3'。 利 用 DNA提取试剂盒提取ILTV鸡胚尿囊液的基因组DNA为模板,PCR扩增103 bp的DNA片段,回收扩增片段,克隆于pMD18-T载体中作为重组质粒标准品。测定标准品纯度为1.86,浓度为54.1 ng/μL,换算结果标准品为4.79×1011拷贝/μL。在100 mg采集的组织样品中加入1 mL DEPC水,研磨成匀浆后按DNA提取试剂盒提取其总DNA作为模板,通过荧光定量PCR检测各组织中的病毒载量。荧光定量PCR方法经优化确定20 μL反应体系为:2×premix ExTaq10.0 μL,模板 DNA 2 μL,上下游引物各0.4 μL(10 pmol/μL), 探 针 0.4 μL(10 pmol/μL),ddH2O 6.8 μL,反应条件为:预变性 95℃ 30 s;PCR反应95℃ 5 s,退火60℃ 20 s,40循环。退火延伸时检测荧光信号。以最佳反应模式进行荧光定量PCR标准曲线建立,标准品浓度从108拷贝/μL~101拷贝 /μL具有良好的线性关系(扩增效率E=1.902,直线斜率为-3.583,截距为46.36。即标准曲线:Y=-3.583X+46.36)。利用上述体系检测感染组鸡各组织器官中的病毒载量。
2 结 果
2.1 临床症状、临床得分、临床指数、发病率和死亡率 人工感染组鸡于4 dpi~6 dpi,出现呼吸困难症状,表现为张口呼吸、伸颈、甩头;结膜炎症状表现为流泪、眼睑发红及肿胀等。根据临床评分标准,对发病鸡进行打分并绘制临床得分曲线(图1)。其中,急性症状主要出现在4 dpi~6 dpi,随后症状表现温和,仅表现为轻度的呼吸困难,结膜炎症状于7 dpi逐渐消失。按此评分标准,计算临床指数为1.4(总得分/总鸡数)。此外,感染鸡的发病率和死亡率分别为80%和10%(表1),对照组鸡未出现任何临床症状。
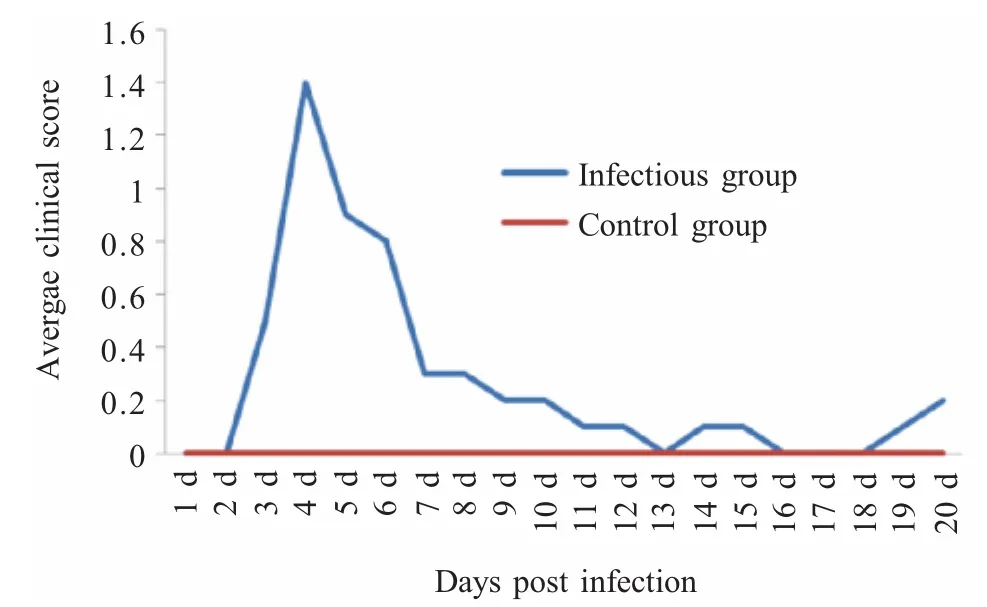
图1 人工感染组感染后1 d~20 d平均临床得分分布图Fig.1 The average clinical score of artificially infected chickens from 1 to 20 dpi
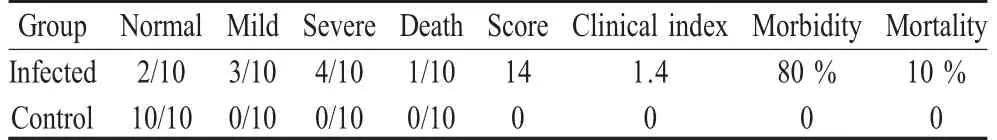
表1 感染组临床指数、发病率和死亡率Table 1 The clinical index,morbidity and mortality of the chicken in the infected group
2.2 剖检变化 于5 dpi,随机迫杀10只鸡。病鸡剖检显示喉头和气管粘膜充血、出血,喉部粘膜肿胀,有多量的粘液,粘液中混有血丝,肺部有实质性病变。对照组鸡未见任何剖检变化。
2.3 病理组织学观察 将人工感染鸡喉头、气管、脑、肺脏、盲肠、腺胃、大肠和肾脏组织切片HE染色后进行组织病理学检查。结果显示:这些器官均表现出明显的炎性变化,各脏器固有层中有大量炎性细胞浸润。并且,喉头和气管局部粘膜上皮细胞脱落;大脑皮质内广泛性的神经细胞萎缩、变性和脱落;肺广泛性淤血;腺胃粘膜层粘液分泌增多,部分粘膜乳头坏死溶解;大肠和盲肠肠绒毛上皮显著脱落(图2)。
2.4 感染组血清抗体检测结果 采用ILTV ELISA抗体检测试剂盒检测感染组第4 dpi、8 dpi、12 dpi、16 dpi和20 dpi血清抗体水平,结果显示,在8 dpi血清抗体水平开始阳转(30%),20 dpi血清抗体全部转阳(100%),对照组鸡只血清抗体水平为阴性(图3)。
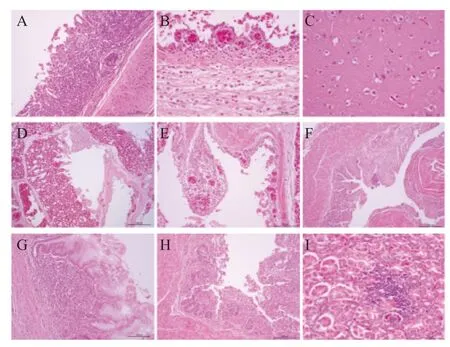
图2 喉头、气管、脑、肺脏、盲肠、腺胃、大肠和肾脏组织病理形态学观察Fig.2 Histopathologic examination of the chicken throat,trachea,brain,lungs,cecum,proventriculus,large intestinal and kindey
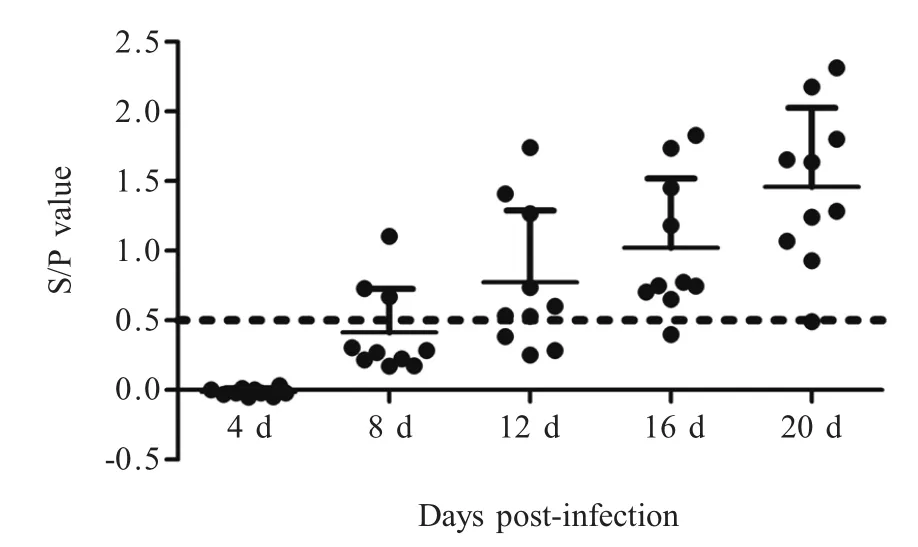
图3 人工感染后血清抗体水平检测结果Fig.3 The serum antibody levels of artificial infected chickens
2.5 感染组鸡体内I L T V组织分布与嗜性 荧光定量PCR检测ILTV在感染组鸡体内各组织中的分布情况,结果表明ILTV在感染鸡各组织中均有分布,但各组织中的病毒载量不同。ILTV的主要嗜性器官为呼吸器官喉头,气管和肺脏;免疫器官哈德氏腺,骨髓和盲肠扁桃体;脑;消化器官盲肠、腺胃和大肠。而在某些组织如肝脏、脾脏、胸腺等组织中病毒载量较低(图4)。
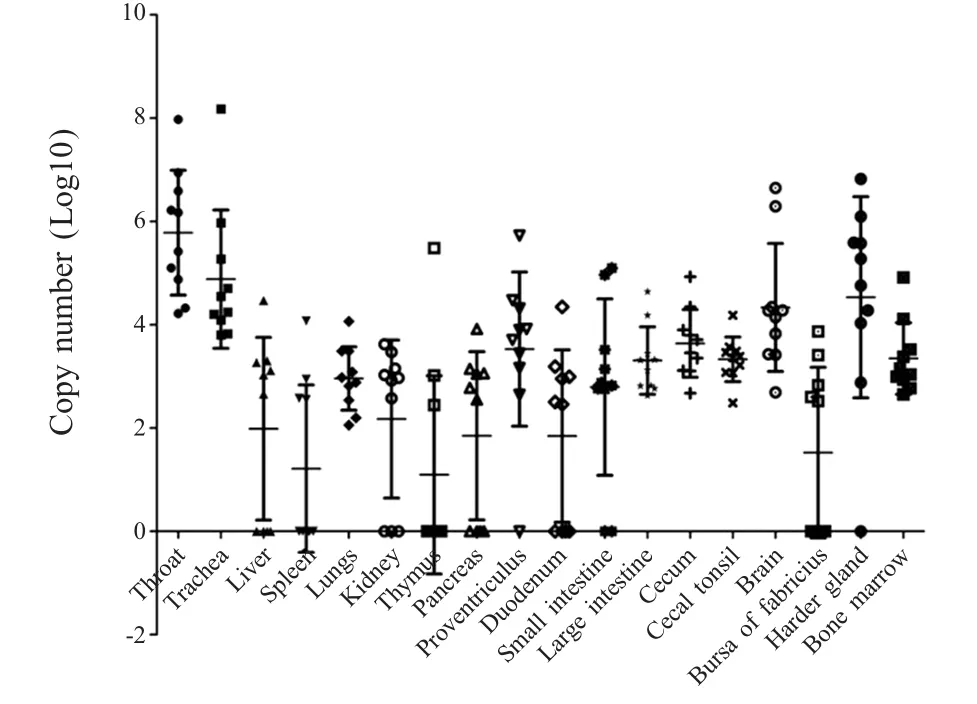
图4 ILTV在感染组鸡体内各组织中分布情况Fig.4 Distribution of ILTV in the internal organs of infected chickens
3 讨 论
本研究将ILTV LJS09分离株人工感染SPF鸡,感染鸡表现出呼吸困难的典型临床症状;剖检时喉头和气管充血、出血,分泌大量粘液并混有血丝;病理组织学检测表明ILTV嗜性器官内有大量炎性细胞浸润,同时各嗜性器官也表现出特异的组织病理变化;临床指数、发病率和死亡率较高。这些指标均与Zhao等报道相符[7],表明了ILTV LJS09对SPF鸡具有较强的致病性。感染鸡血清抗体水平于8 dpi开始转阳,20 dpi全部阳转。这一结果也符合Hitchner等的报道[6]。荧光定量PCR的结果表明ILTV LJS09在感染鸡体内绝大多数器官中均存在,但其嗜性器官主要是喉头、气管、哈德氏腺、脑、盲肠和腺胃,而在法氏囊、脾脏和胸腺中的病毒含量很少,但据Wang等的报道,ILTV GD2011在胸腺中的病毒拷贝数高[8],而在腺胃和脑中病毒含量较少,并且根据Wei等的研究,ILTV JL0806在肾脏中病毒拷贝数较高[9],这可能是由于不同地域不同流行病毒株的差异造成嗜性器官的差异。
本研究以人工感染的方式,通过各个指标的评价表明,ILTV LJS09分离株具有较强的致病性。这些指标为ILTV其他流行病毒株致病性的研究提供了参考和依据。
[1]谢菲,郝满良,王慎行,等.鸡传染性喉气管炎人工感染实验[J].中国畜牧兽医.2008,38(3):106-108.
[2]王云峰,智海东,孙永科,等.抗鸡传染性喉气管炎重组鸡痘病毒基因工程疫苗同居感染试验[J].中国预防兽医学报.2004,26(1):50-53.
[3]陈红英,李新生,张红英,等.应用PCR检测鸡传染性喉气管炎病毒[J].中国畜牧兽医,2007,34(7):83-85.
[4]陈晓月,赵玉军.鸡传染性喉气管炎研究进展[J].中国兽医杂志,1999,38(1):35-38.
[5]岳治权,宋晓平,张德刚.喉炎康对人工感染鸡传染性喉气管炎的防治试验[J].西北农业大学学报,1996,24(3):21-29.
[6]Hitchner W,Veits J,Helferich D,et al.Molecular biology of avian infectious laryngotracheitis virus[J].Vet Res,2007,38(2):261-279.
[7]Zhao Yan,Kong Cong-cong,Cui Xian-lan.et al.Detection of infectious laryngotracheitis virus by real-time PCR in naturally and experimentally infected chickens[J].PLoS One,2013,8:164-173.
[8]Wang Lin-guo,Ma Jun,Xue Chun-yi,et al.Dynamic distribution and tissue tropism of infectious laryngotracheitis virus in experimentally infected chickens[J].Arch Virol,2013,158(3):659-666.
[9]Wei hong-ying,Cui pei,Cui bao-an,et al.Development and comparison of a primer-probe energy transfer based assay and a 5'conjugated minor groove binder assay for sensitive real-time PCR detection of infectious laryngotracheitis virus[J].J Virol Methods,2011,(175):149-155.

