蓝舌病病毒抗原捕获ELISA检测方法的建立
苗海生,李 乐,廖德芳,朱建波,寇美龄,杨永钦,孙 强,李华春
(云南省畜牧兽医科学院,云南 昆明 650224)
蓝舌病(Bluetongue,BT)是由呼肠孤病毒科环状病毒属的BT 病毒(BTV)引起的非接触性传播的虫媒病毒病,主要感染绵羊、牛及野生反刍动物。BTV广泛分布于热带、亚热带地区,目前已知共有24 个血清型。近年来随着该病主要昆虫媒介库蠓分布范围的扩大、数量的增加,BT 不断发生[1-3]。2007~2008 年间欧洲国家大规模暴发BTV-8 型疫情,并造成严重的的经济损失[4-6]。通过BT 流行病学调查,中国共在31 个省、市(区)发现BTV 血清阳性家畜,并从云南、湖北、重庆、山西、新疆、内蒙、广西等地自然感染羊体中分离获得BTV[7]。
目前在我国流行的BTV 以隐性感染为主,在流行病学调查中,将待检动物的血液进行鸡胚接种是监测和分离获得BTV 野生株的重要手段,因此准确快速的区别接种后鸡胚的BTV 状况对于提高抗原的分离效率和流行病学调查的准确度具有重要意义[8]。因此,本研究通过制备BTV 群特异性多克隆羊抗和兔抗血清,经反应条件优化,建立了BTV 抗原捕获ELISA(AC-ELISA)检测方法,为BTV 抗原检测提供了一种快速、实用的检测技术。
1 材料和方法
1.1 主要实验材料及实验动物 BTV-1 云南分离株、山羊痘病毒(GPV)、鹿流行性出血病病毒(EHDV)、赤羽病病毒(AKAV)和BHK-21 细胞均由云南省热带亚热带动物病毒病重点实验室保存;临床样品为采自云南普洱、德宏地区的牛、羊肝素抗凝血液样品;10 日龄白壳鸡胚购自昆明云岭广大种鸡场;体质量为1.5 kg~2.0 kg 的家兔购自云南生物制药股份有限公司实验动物场;6~7 月龄美利奴绵羊购自南省师宗县种羊场。
1.2 主要试剂 BTV RT-PCR 引物为云南省热带亚热带动物病毒病重点实验室设计,并由TaKaRa 公司合成;PS one step RT-PCR 试剂盒购自TaKaRa 公司;HRP 标记羊抗兔IgG(IgG-HRP)购自上海碧云天生物技术有限公司;TMB 购自美国BIO BASIC INC 公司。
1.3 BTV纯化及高免血清的制备 将BHK-21 细胞增殖的BTV-1 采用蔗糖连续密度梯度离心(30 000 r/min、离心4 h)纯化,经ISA206 佐剂乳化,按常规方法分别在0 d、21 d、56 d 免疫兔子和绵羊,于第三次免疫后14 d 采集血清进行检测,当中和抗体效价≥256 后采血并分离血清。
1.4 待检样品处理及鸡胚接种 将采集的牛、绵羊肝素钠抗凝血样品进行离心(1 000 r/min、10 min),弃血浆,以PBS 洗涤细胞后,重悬于双蒸水中,1 h后,取0.1 mL 静脉接种10 d 龄鸡胚。收集2 d~7 d死亡的鸡胚肝脏,加1 mL PBS 研磨离心,将经3 000 r/min 离心后的样品上清液作为待检样品。以同样处理的阴性鸡胚样品作为对照。
1.5 AC-ELISA方法的建立
1.5.1 AC-ELISA 反应条件的优化 将羊抗BTV 血清和兔抗BTV 血清用稀释液分别作1∶500、1∶1 000、1∶2 000、1∶4 000 倍稀释,进行方阵交叉BTV ACELISA 检测,确定最佳稀释倍数。BTV 阳性鸡胚肝脏上清液分别设置25 μL/孔、50 μL/孔、100 μL/孔、150 μL/孔加入量,选择最佳待检样品加入量;同时对上述反应分别设置30 min、1 h、1.5 h 反应时间,确定各步最佳反应时间。TMB 底物设定pH 5.6,按照每毫升底物分别加入20 μL/mL、15 μL/mL、10 μL/mL、5 μL/mL 的1% TMB 二甲基亚砜溶液配制,反应时间分别为10 min、15 min、20 min,通过方阵交叉反应试验,确定最佳配方和反应时间。根据反应条件和剂量的优化结果确定该检测方法的标准操作程序。
1.5.2 判定标准的确定 利用该检测方法同时对已知的27 份BTV 阴性鸡胚样品进行检测,获得阴性样品OD450nm,计算样品的平均OD450nm(X)和标准差(SD),根据公式:阴阳性样品临界值=(X+3SD)/X,确定判定标准临界值。
1.6 特异性试验 将GPV、EHDV、AKAV 和BTV分别各接种1 枚鸡胚,发生病变后收集鸡胚肝脏。应用AC-ELISA 方法对鸡胚肝脏进行检测,验证该检测方法的特异性
1.7 敏感性试验 以BHK-21 细胞增殖BTV-1。按照OIE 规定的方法对病毒悬液进行毒价测定,Karber 法计算病毒的TCID50。将病毒悬液由1∶4 开始进行倍比稀释至1∶2 048,采用BTV AC-ELISA 检测方法对所有稀释度进行检测,确定该检测方法的最低检出量。同时用BTV RT-PCR 方法对各稀释度病毒悬液进行检测,通过二者之间的比较验证AC-ELISA方法的敏感性。
1.8 重复性试验 随机抽取的8 份BTV 阳性鸡胚样品,应用同一批次的试剂在同一ELISA 板上做3个重复,测定OD450nm值,为批内重复性试验;应用3 个批次的试剂分别在3 个ELISA 板上对这8 份血清进行检测,为批间重复性试验。计算变异系数。
1.9 符合率试验 应用建立的AC-ELISA 方法和常规RT-PCR 方法对30 份接种BTV-1 的鸡胚样品和30 份BTV 阴性鸡胚样品同时进行检测,比较二者间的符合率。
2 结果
2.1 AC-ELISA反应条件的优化 采用方阵滴定法确定羊抗BTV 血清的最佳包被浓度(50 μL/孔)和待检血清样品加入量,同时按该原理对各条件进行优化,结果如表1 所示。
2.2 判定标准的确定 利用该检测方法检测已知的27 份BTV 阴性鸡胚样品,测定OD450nm值,制定阴性样品在不同OD450nm区间数量分布图(图1)。经计算27 份BTV 阴性鸡胚样品X 和SD 分别为0.084和0.02,根据公式:阴阳性样品临界值=(X+3SD)/X=1.7,考虑到可能存在的误差,确定阴阳性样品试验判定标准为2,即当样品OD450nm/阴性对照平均OD450nm≥2 时判定为BTV 阳性,当样品OD450nm/阴性对照平均OD450nm<2 时判定为阴性。

表1 BTV AC-ELISA 方法的反应条件优化结果Table 1 The optimized conditions of the BTV AC-ELISA
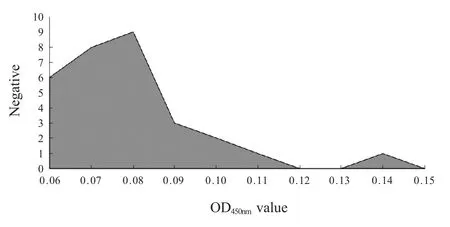
图1 BTV 阴性鸡胚样品在不同OD450nm区间数量分布图Fig.1 The assay of negative samples under OD450nm
2.3 特异性试验 将GPV、EHDV、AKAV 和BTV 分别接种鸡胚,发生病变后进行检测。结果显示,阴性对照平均OD450nm为0.089,GPV、AKAV与建立的AC-ELISA 方法无交叉反应,EHDV 样品有微量交叉反应,但样品OD450nm/阴性对照平均OD450nm均小于2,判定为阴性,不影响结果判定(表2)。
2.4 敏感性试验 经毒价检测,确定敏感性试验用毒毒价为105.5TCID50/50 μL,将其进行倍比稀释后经AC-ELISA 方法和RT-PCR 方法同时进行检测。结果显示,采用AC-ELISA 检测时,病毒液稀释至512 倍时反应结果仍呈阳性,即最低可以检出TCID50为102.79的病毒,而RT-PCR 方法的敏感度为1 024 倍稀释(表3)。AC-ELISA 方法敏感性低于RT-PCR,但在实际的检测中就检测结果的影响微小,该差异可以忽略。
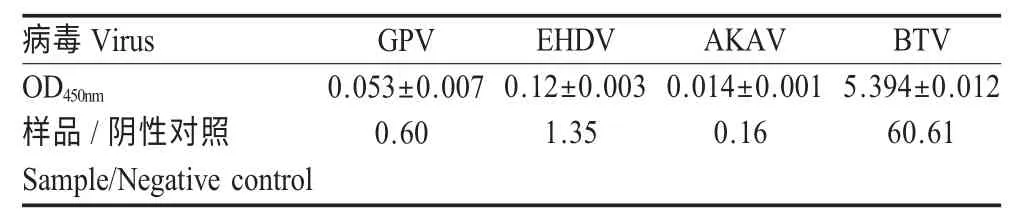
表2 特异性试验Table 2 The specificity test of the AC-ELISA

表3 敏感性试验检测结果Table 3 Sensitivity test of the AC-ELISA
2.5 重复性试验 利用3 批次试剂对8 份BTV 阳性鸡胚样品同时进行检测,结果显示批内和批间变异系数分别为1.44 %~8.46 %和2.26 %~12.44 %,表明本研究建立的方法具有良好的重复性(表4)。
2.6 符合率试验 利用建立的AC-ELISA 方法和RT-PCR 方法对30 份已知BTV 阳性和30 份已知阴性鸡胚进行检测。阳性鸡胚AC-ELISA 符合率为90 %,RT-PCR 符合率为100 %,阴性鸡胚符合率均为100 %。AC-ELISA 方法在判定阳性鸡胚时符合率低于RT-PCR 方法(表5)。
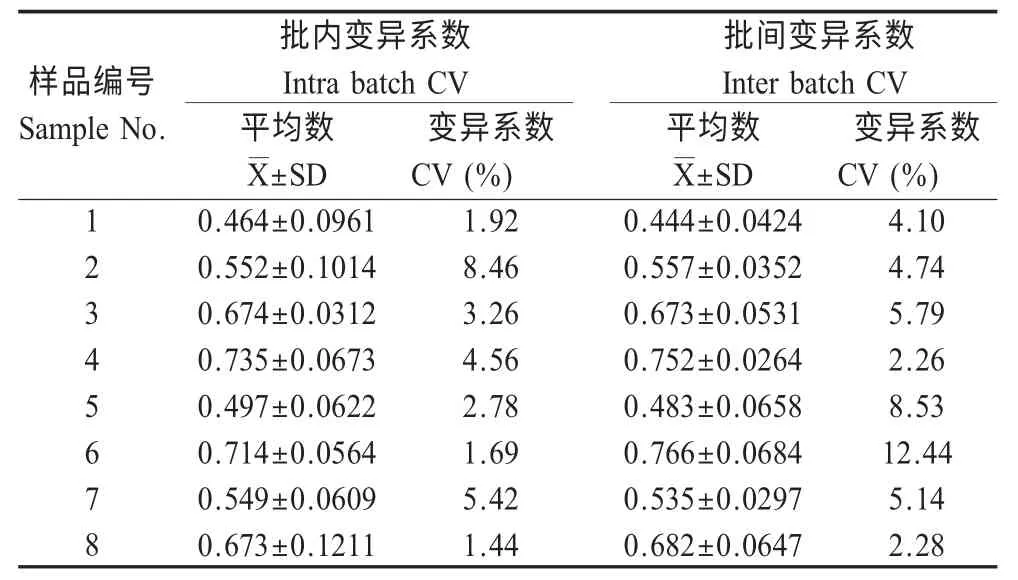
表4 BTV AC-ELISA 重复性试验结果Table 4 The repeatability test of BTV AC-ELISA
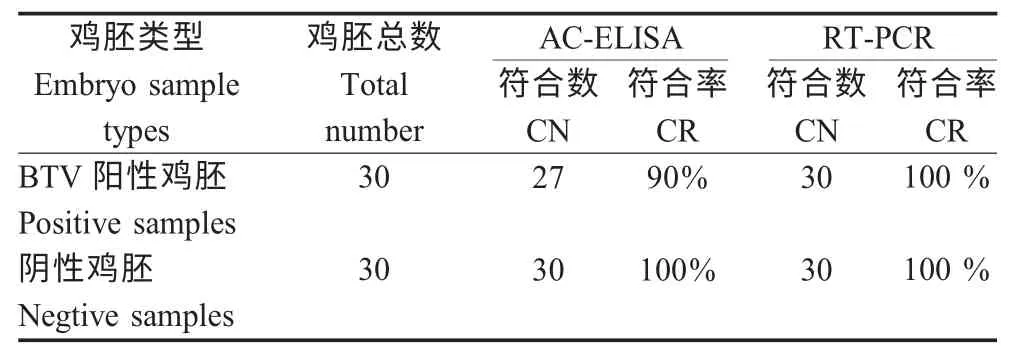
表5 AC-ELISA 方法和RT-PCR 方法检测鸡胚样品符合率比较Table 5 The coincidence rate between AC-ELISA method and RT-PCR method
3 讨论
由于目前BTV 的分布具有广泛性,为研究其流行和分布特点需要建立一种快速高效的检测方法。鸡胚接种是对野外采集的BT 病料样品进行病毒分离的主要方法,本研究建立的AC-ELISA 方法主要针对在鸡胚接种后验证鸡胚的BTV 扩增情况,由于鸡胚肝脏病毒含量较高,并且易于破碎和检测,病毒分离时多采用该部位组织。本研究的关键技术在于抗原的纯化,并在此基础上获得高度特异性的抗体,研究发现BTV 颗粒在蔗糖密度梯度中主要存在于50 %~60 %密度处,在此处病毒的含量不一定最高,但纯净度却最好。通过对27 份不同日龄BTV阴性鸡胚的检测,确立了该检测方法的判定标准,以样品OD450nm/阴性对照平均OD450nm=2 作为临界值在鸡胚检测中具有较好的可靠性,在血液或其它病料样品的实际检测中判断标准可以适当降低。EHDV样品与BTV 检测试剂有微量交叉反应,但根据确立的判定标准并不影响结果判定,本次特异性试验中选用的病毒为羊主要易感或同为虫媒病的病毒,对于其它病毒的特异性试验还需要进一步进行验证。
BTV AC-ELISA 同样面临免疫原性相近已知或未知病毒非特异性反应的影响,当相近病毒的量足够多时也可以影响检测结果。因此,使用BTV RT-PCR 方法和BTV AC-ELISA 方法同时对样品进行检测,将共同的检测结果作为确诊BTV 感染的依据更为科学。本研究建立的BTV AC-ELISA 方法可以用于BTV 分离过程中鸡胚样品的抗原阴阳性判断,明显提高病毒分离效率,对于BT 流行病学调查和致病性病毒株的预防具有重要意义。
[1]Peter M,Matthew B,Philip A.Bluetongue[M].London:Academic Press,2008.
[2]Bhanuprakash V,Indrani B K,Hosamani M,et al.Bluetongue vaccines:the past,present and future[J].Expert Rev Vaccines,2009,8(2):191-204.
[3]Davies F,Mungai J,Pini A,et al.A new bluetongue virus serotype isolated in Kenya[J].Vet Microbiol,1992,31(1):25-32.
[4]Makoschey B,Beer M,Zientara S,et al.Bluetongue control-a new challenge for Europe[J].Berl Munch Tierarztl Wochenschr,2008,121(7-8):306-313.
[5]朱建波,杨仕标,李华春,等.谨防以羊、牛为侵害对象的“杀手”-蓝舌病流行病学及防控技术研究进展[J].中国动物卫生保健,2008,107(1):105-108.
[6]Sotelo E,Llorente F,Rebollo B,et al.Development and evaluation of a new epitope-blocking ELISA for universal detection of antibodies to West Nile virus[J].J Virol Methods,2011,174(1-2):35-41.
[7]Franco O L,Ogas M L,Combessies G,et al.Single dilution Avidity-blocking ELISA as an alternative to the bovine viral diarrhea virus neutralization test[J].J Virol Methods,2011,175(2):228-235.
[8]Al M Z,Bruyas J F,Pellerin J L,et al.Evaluation of bluetongue virus(BTV)decontamination techniques for caprine embryos produced in vivo[J].Theriogenology,2012,78(6):1286-1293.

