一株野鸟源H9N2亚型禽流感病毒的全基因组序列分析及致病性研究
张 芳,王 晶,2,卢昆鹏,2,肖 丽,彭 志,2,崔鹏飞,关立峥,邓国华*,陈化兰
(1.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/农业部动物流感重点开放实验室,黑龙江 哈尔滨 150001;2.湖南农业大学,湖南 长沙 410128)
禽流感(Avian influenza,AI)是由禽流感病毒(AIV)引起的高度接触性传染病。AIV 为负链单股RNA 病毒目正粘病毒科流感病毒属。根据其囊膜上血凝素(HA)和神经氨酸酶(NA)抗原性的不同,可分为16 种HA 亚型和9 种NA 亚型[1]。H9N2 亚型AIV在世界范围内普遍存在,其广泛分布于禽类、野鸟和一些哺乳动物之中,也能够感染人类,其中野鸟被认为是H9N2 亚型AIV 的自然宿主[2]。
H9N2 亚型AIV 虽然是低致病性AIV(LPAIV),但它能够引起上呼吸道感染、产蛋量严重下降,个别病毒株可引发死亡,是影响我国养禽业的主要AIV 亚型。此外,H9N2 亚型AIV 广泛存在变异重组现象,可能为形成新型跨种传播感染人的流感病毒株提供条件。1997 年香港暴发的H5N1 亚型AIV经研究表明,H9N2 亚型AIV 为其内部基因供体[3]。2013 年首次在我国暴发的感染人新型H7N9 以及2014 年报道的感染人新型H10N8 亚型AIV,其内部基因也均来源于H9N2[4-5]。本研究对2014 年从我国南方野鸟粪便中分离到的一株H9N2 亚型AIV 进行全基因组序列测定、进化分析及对SPF 鸡、SPF 鸭和BALB/c 小鼠的感染性试验,初步评价其对家禽和哺乳动物的感染致病情况,并为AIV 的监测和防控提供数据支持。
1 材料和方法
1.1 病毒株和实验动物 AIV Wide Bird/HuN/SC1400/2014(H9N2)(WB/400/14)为2014 年从野鸟粪便中分离鉴定并由国家禽流感参考实验室保存;10日龄SPF 鸡胚及4 周龄SPF 鸡和SPF 鸭均购自本研究所动物中心;6 周龄雌性BALB/c 小鼠购自北京维通利华实验动物有限公司。
1.2 主要试剂 LS TRIzol RNA 提取试剂、反转录酶(MLV)均购自Invitrogen 公司;r Taq DNA 聚合酶、DNA Marker DL2000 购自TaKaRa 公司;胶回收试剂盒购自OMEGA 公司;DNA 测序试剂盒购自Applied Biosystem 公司。
1.3 引物及参考序列 根据GenBank 中各亚型AIV基因节段序列选择同源性最高的区域设计引物,反转录引物序列Uni12:5'-AGCAAAAGCAGG-3',扩增及测序引物均由本实验室设计并保存。
1.4 病毒的增殖及鸡胚半数感染量(EID50)测定 将分离的AIV 经有限稀释后,采用10 日龄SPF 鸡胚纯化3 代后进行病毒增殖;增殖后的H9N2 亚型AIV 采用10 倍倍比稀释,每个稀释度经尿囊腔接种4 枚10 日龄SPF 鸡胚,37 ℃培养48 h 后收集尿囊液并测其血凝价(HA),根据Reed-Muench 法计算病毒的EID50。
1.5 全基因组序列测定与分析 参照文献[6]的方法提取病毒总RNA,反转录成cDNA 后用于目的片段的PCR 扩增,扩增产物经胶回收试剂盒纯化后进行测序。所有序列采用MegAlign 进行同源性比较,采用Meg5 进行进化树的绘制及分析。
1.6 动物感染试验
1.6.1 SPF 鸡、SPF 鸭感染性试验 按每只106EID50/0.1 mL 的剂量鼻腔接种8 只SPF 鸡、SPF 鸭,另设两只同批SPF 鸡和鸭作为同居感染对照,于负压隔离器中饲养。感染3 d 后每个实验组随机迫杀3 只感染SPF 鸡和鸭,并采集组织脏器进行病毒滴定。连续14 d 观察SPF 鸡和鸭的临床表现并采集咽喉和泄殖腔拭子,接种鸡胚进行病毒滴度测定,分析其在SPF 鸡和鸭体内的排毒状况。14 d 后采集存活SPF 鸡和鸭血清,检测血清转阳状况。
1.6.2 BALB/c 小鼠感染性试验 将8 只BALB/c 小鼠轻度麻醉后,每只小鼠鼻腔接种50 μL(106EID50)的病毒稀释液,另设5 只BALB/c 小鼠作对照。感染组接种后3 d 随机迫杀3 只,并采集小鼠的脑、鼻甲、脾、肺和肾脏进行病毒滴定,其余5 只及对照组连续观察14 d 并记录小鼠的体重变化情况。
2 结果
2.1 序列测定及进化分析 将测序后的全基因序列经SeqMan 软件拼接校正,通过Blast 比对显示,各基因片段分别与H9、H6、H5、H3、H11、H4、H1 等多种亚型的LPAIV 高度同源(表1)。
2.1.1 HA 基因序列及进化分析 AIV WB/400/14 分离株的HA 基因开放阅读框为1 683 nt,共编码560个氨基酸,序列分析显示,分离株的HA 蛋白裂解位点基序为333PAASDR↓GL340,不存在多个连续的碱性氨基酸,符合LPAIV 氨基酸序列特征。HA 蛋白存在7 个潜在的糖基化位点,其中5 个位于HA1上,分别为11NST13、123NVT125、200NRT203、280NTT283、287NVS289,另2 个为HA2 的474NGT476和533NGS535。但由于WB/400/14 的127 位氨基酸的突变,导致该位潜在糖基化位点消失,至于该位点的消失是否与病毒的生物学特性差异有关,还需要进一步研究证实。Blast 比对结果显示,与WB/400/14 株HA 基因片段同源性最高的病毒株是A/mallard/Switzerland/WV1070805/2007(H9N2),同源率为98.5 %。进化分析表明分离株属于欧亚分支。
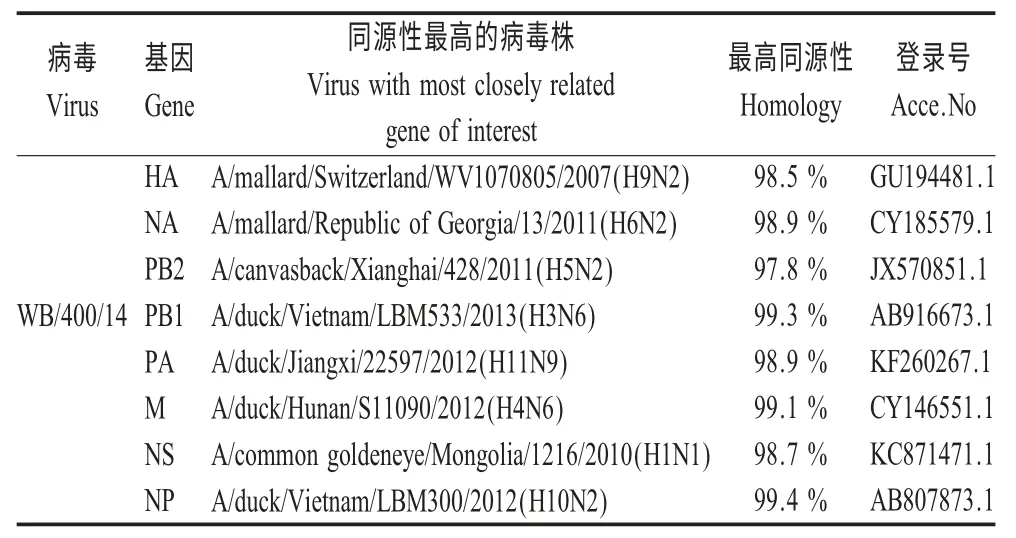
表1 病毒株WB/400/14 的各基因片段Blast 分析结果Table 1 The Blast analysis of genes of WB/400/14 influenza virus isolate
2.1.2 NA 基因的序列及进化分析 WB/400/14 分离株NA 基因无颈部缺失,开放阅读框为1 410 nt,共编码469 个氨基酸。WB/400/14 具有5 个潜在的糖基化位点,分别为61NIT63、69NNT71、146NGT148、200NAT202和234NGT236。WB/400/14 分离株NA 基因片段与A/mallard/Republic of Georgia/13/2011(H6N2)的核苷酸同源性高达98.9 %,但同源性高的片段并不仅仅局限于H6 亚型AIV,同时还有H5、H2 和H3等亚型AIV 的NA 片段(图1)。
2.1.3 内部基因序列及进化分析 内部基因序列分析显示,NS 基因的80~84 位氨基酸未出现缺失现象,PB2 基因的627 位和702 位氨基酸均未发生突变。分离株的内部基因分别与H5、H3、H11、H4、H1、H10 等多种亚型的LPAIV 同源性较高,表明来源较复杂,可能与这些病毒株均存在共同的祖先。
2.2 病毒对SPF鸡的感染性试验 测定WB/400/14株的EID50为108.5/mL。以106EID50/0.1 mL 剂量鼻腔接种SPF 鸡后,所有感染鸡及同居感染鸡均未表现明显的临床症状。病毒滴定结果显示咽喉拭子、泄殖腔拭子及脏器均未检测到病毒,表明WB/400/14感染SPF 鸡后不能通过呼吸道和消化道排毒,并不能够在SPF 鸡体内有效复制。感染后14 d 血清检测结果显示:只有两只感染鸡血清转阳,并且效价较低,表明该株病毒对SPF 鸡的感染性较弱,不具备在鸡群间发生有效传播的能力。
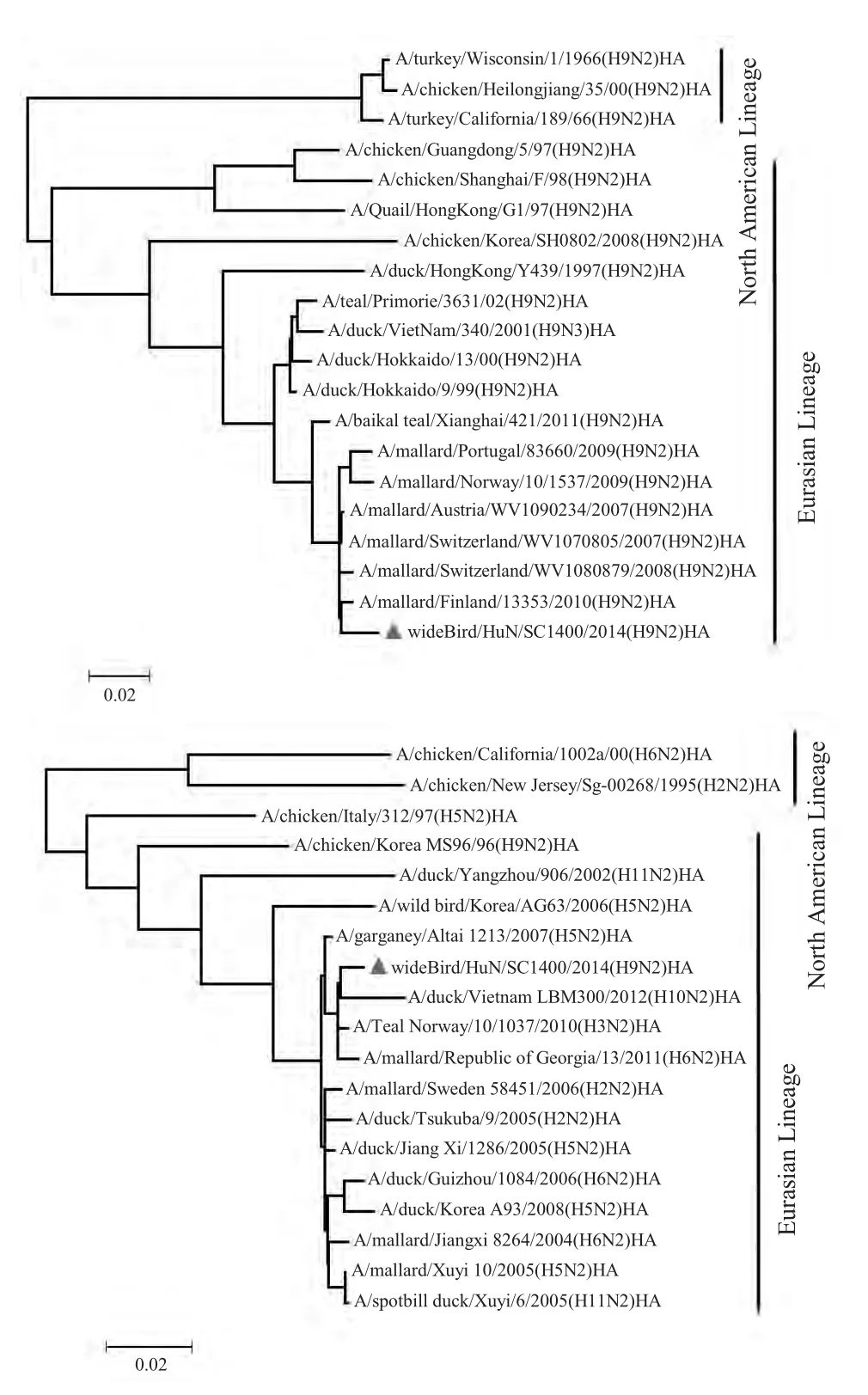
图1 WB/400/14 分离株的HA 和NA 基因进化树Fig.1 Phyogenetic tree based on HA and NA gene of WB/400/14
2.3 病毒对SPF鸭的感染性试验 病毒感染SPF鸭后,所有鸭均未表现明显临床症状。感染14 d 后血清检测结果显示:SPF 鸭血清转阳比例为7/7,同居鸭血清均呈阳性反应,表明WB/400/14 在鸭群中具有较强的水平传播能力。咽喉拭子和泄殖腔拭子的病毒滴定结果显示:WB/400/14 感染SPF 鸭后主要通过泄殖腔向外排毒,排毒周期较短,高峰期在第3 d,第5 d 只在泄殖腔拭子中检测到病毒的存在,第7 d 基本不排毒。而咽喉拭子的病毒只有在第3 d 检测到,表明病毒株的排毒方式为消化道排毒(表2)。感染鸭脏器的病毒滴定结果显示,感染WB/400/14 的SPF 鸭肺脏、气管和肾脏等脏器的滴定结果均为阴性,而仅在盲肠扁桃体、法氏囊和肾脏中检测到病毒存在,表明该病毒能够在消化道中有效复制(图2)。
2.4 病毒对BALB/c小鼠的感染性试验 病毒株以106EID50/50 μL 感染小鼠之后,小鼠并未表现出明显的临床症状,但体重先上升后下降,第8 d 后小鼠体重又逐步上升并恢复至正常水平(图3)。脏器病毒滴定结果显示,小鼠所有脏器滴定结果均呈阴性,表明该株病毒还不具备对小鼠的适应性。
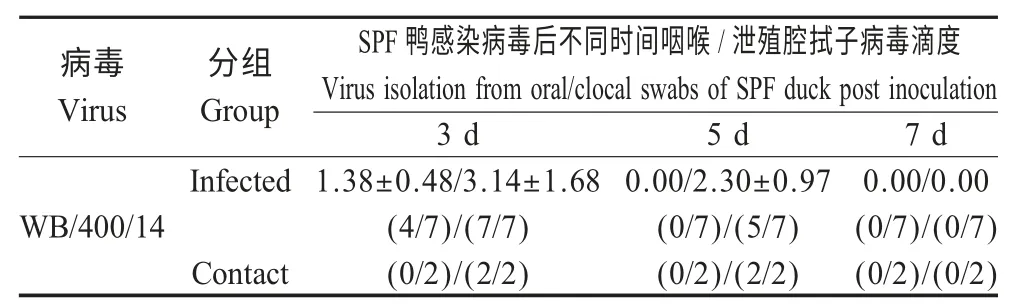
表2 病毒感染SPF 鸭后的排毒检测结果Table 2 Virus shedding post artificial infection

图2 感染3 d 后SPF 鸭脏器滴定结果Fig.2 Virus titer in SPF ducks organs on day 3 post inoculation

图3 小鼠感染病毒后体重变化情况Fig.3 Weight change of mice after inoculated with virus
3 讨论
本研究对2014 年从我国南方野鸟粪便中分离到的一株H9N2 亚型AIV 株的遗传演化分析表明,分离株分别与H9、H6、H4、H1、H11、H10 等多种亚型的LPAIV 同源性较高,表明不同亚型AIV 基因片段在野鸟中的交换和重组现象十分普遍。SPF 鸡和BALB/c 小鼠感染性试验中,分离株不能够在SPF 鸡和小鼠体内有效复制,多脏器病毒滴定均为阴性,表明该分离株还不具备对鸡和小鼠的适应性。在SPF 鸭感染性试验中,感染鸭和同居鸭主要通过泄殖腔向外排毒,脏器滴定结果显示仅在盲肠扁桃体、法氏囊和肾脏中检测到病毒存在,表明WB/400/14 在鸭群中具有良好的水平传播能力,并且对脏器具有特异的亲嗜性,主要通过消化道排毒,这与之前研究的流感病毒在消化道内增殖,产生大量的子代病毒,宿主通常并不表现出临床症状,但能够长期排泄带有病毒的粪便相符[7]。
目前,野鸟在传播AIV 上虽没有直接的证据,但野鸟是AIV 的易感动物,可以感染各种亚型的流感病毒,并且也能从野鸟粪便中分离出病毒,这种能带毒并排毒的事实可以确定野鸟是AIV 的重要传染源[8],而且野鸟尤其是水禽一直以来都被认为是家禽中暴发AI 的潜在来源[9]。因此,加强对候鸟迁徙地和繁殖地AIV 的监测具有重要意义。
[1]Olsen B,Munster V J,Wallensten A,et al.Global patterns of influenza A virus in wild birds[J].Science,2006,312:384-388.
[2]朱光剑.中国南方H9N2 禽流感病毒的分子进化分析及其对小鼠致病性研究[D].上海:华东师范大学,2012.
[3]Guan Y,Shortridge K F,Krauss,et al.Molecularcharacterization of H9N2 influenza viruses:were they the donors of the "internal" genes of H5N1 viruses in Hong Kong?[J].Proc Natl Acad Sci USA,1999,96(16):9363-9367.
[4]Kageyama T,Fujisaki S.Genetic analysis of novel avian A(H7N9)influenza viruses isolated from patients in China,February to April 2013[J].Euro Surveill,2013,18(15):20453.
[5]Qi Wen-bao.Genesis of the novel human-infecting influenza A(H10N8)virus and potential genetic diversity of the virus in poultry,China[J].Euro Surveill,2014,19(25):1-13.
[6]丁晴微,邓国华,施建忠,等.两株鸭源H6N2 亚型禽流感病毒的序列分析及对鸡的致病性研究[J].中国预防兽医学报,2011,33(4):270-275.
[7]Jacob J P,Butcher G D.Avian influenza in poultry[Electronic version][J].University of Florida,2009,PS38,1-4.
[8]李井春,赵凤菊,于学武,等.野鸟在禽流感流行病学中的研究进展[J].中国畜牧兽医,2010,37(7):178-180.
[9]Alexander D J.Ecological aspects of Influenza viruses in animals and theirrelationship to human Influenza:a review[J].J R Soc Med,1982,75:799-811.

