ARHI基因在胰腺癌细胞中的抑癌作用及其机制研究
路新卿,张文娴,李校天,翟建文,沈香荣,刘志军(河北工程大学附属医院消化内科,河北 邯郸 056002)
·论著·
ARHI基因在胰腺癌细胞中的抑癌作用及其机制研究
路新卿,张文娴,李校天,翟建文,沈香荣,刘志军*(河北工程大学附属医院消化内科,河北 邯郸 056002)
[摘要]目的观察ARHI基因对人胰腺癌细胞株(PANC-1和MiaPaCa-2细胞株)生长的影响,探讨其抑制细胞生长的作用机制。方法采用脂质体转染和G418筛选方法建立ARHI基因稳定表达的PANC-1、MiaPaCa-2细胞株,并通过Western blot方法验证ARHI基因在稳定细胞株中蛋白表达;通过生长曲线方法分析ARHI基因对胰腺癌细胞增殖的影响;应用Western blot方法检测ARHI基因对PI3K/AKT信号转导通路的蛋白表达。结果目的基因组PANC-1、MiaPaCa-2细胞株有ARHI蛋白的表达,无转染组和空载体组无ARHI 蛋白表达;随时间延长,无转染组、空载体组和目的基因组细胞生长均呈增长趋势,目的基因组细胞生长速度最慢,差异有统计学意义(P<0.05或<0.01);与空载体组比较,目的基因组蛋白表达后显著下调了PI3K/AKT信号通路中p-AKT蛋白的表达。结论ARHI可以明显抑制胰腺癌细胞的生长,下调与肿瘤发生相关的PI3K/AKT信号传导通路,可能在胰腺癌的发生发展中起了重要的作用。
[关键词]胰腺肿瘤;基因表达;细胞增殖
doi:10.3969/j.issn.1007-3205.2015.12.003
胰腺癌的5年存活率仅为3%[1],病死率和发病率十分接近(0.99∶1),在确诊时,仅10% ~20%患者可以手术切除,且预后很差[2]。近来研究表明,在胰腺细胞恶变过程中,伴随着许多基因的突变或缺失(如K-ras、p53等),从而在各个环节影响细胞信号正常传递过程,引起信号转导的异常与障碍,最终导致胰腺癌的发生[3]。ARHI(aplysia ras homolog I)基因作为肿瘤抑制基因,属于Ras超家族成员,但与大部分Ras家族成员都是癌基因不同,ARHI具有抑癌作用[4]。磷脂酰肌醇-3-羟基激酶(phosphatidylinositol 3 kinase,PI3K)/丝氨酸蛋白激酶(serine-threonine kinase,AKT)通路是Ras的经典通路之一,是Ras维持细胞生存和抑制凋亡的关键途径,在胰腺癌变过程中起着重要的作用[5]。本研究旨在探讨ARHI是否通过与Ras共同的PI3K/ AKT信号通路,抑制胰腺癌细胞的增殖和负向调节细胞生长的机制。报告如下。
1资料与方法
1.1细胞及试验 人胰腺癌细胞株PANC-1、MiaPaCa-2(北京协和医院),细胞增殖检测试剂(普利莱基因技术有限公司),细胞转染试剂LipofectamineTM 2000(Invitrogen公司,美国),RNA酶(RNase)、变性/非变形细胞裂解缓冲液、BCA法蛋白质定量试剂盒(北京普利莱基因技术有限公司),Western blot 实验试剂(普利莱基因技术有限公司),ARHI兔抗人多克隆抗体和ARHI小鼠抗人单克隆抗体(复旦大学郁荫华教授馈赠),β-Actin兔抗人多克隆抗体(Santa Cruze公司,美国),AKT、p-AKT兔抗人多克隆抗体(Cell Sigalling Technology USA)。
1.2细胞培养胰腺癌细胞培养于含胎牛血清的高糖培养基中,当70%~80%细胞融合时予以传代,培养瓶中加入胰酶后,孵箱中消化细胞3~5 min,弃消化液,加入培养基吹打瓶壁上细胞,形成均匀单细胞悬液,计数,按所需浓度转移至新培养瓶或培养板中,进行实验研究。
1.3细胞分组①对照组:正常胰腺组织;②无转染组:细胞无转染质粒;③空载体组:细胞转染核糖体内部位点增强型绿色荧光蛋白(internal ribosome entry site2-enhanced green fluorescent protein,pIRES2-EGFP)质粒;④目的基因组:细胞转染核糖体内部位点增强型绿色荧光蛋白ARHI (internal ribosome entry site2-enhanced green fluorescent protein aplysia ras homolog I,pIRES2-EGFP-ARHI)质粒。
1.4稳定转染胰腺癌细胞株的建立提取pIRES2-EGFP和pIRES2-EGFP-ARHI质粒,应用LipofectamineTM 2000脂质体瞬时转染PANC-1、MiaPaCa-2胰腺癌细胞,新霉素(Neomycin418,G418)药物筛选瞬时转染的细胞,第12~14天时,PANC-1和MiaPaCa-2细胞大部分细胞已死亡,G418浓度减为半量,继续维持筛选压力。荧光显微镜下可见散在绿色荧光细胞,建立了稳定表达ARHI基因和空载体的胰腺癌细胞株。
1.5实验细胞的准备和蛋白提取接种转染空载体和目的基因ARHI的PANC-1和 MiaPaCa-2细胞3×105个于6孔板中,实验前1 d,细胞换为无血清培养基培养24 h后,分别于实验前加入表皮生长因子(epithelial growth factor,EGF)终浓度为50 μg/L刺激不同的时间(0、15、30、60 min),观察 p-AKT和AKT蛋白表达情况,胰腺癌组织或细胞加入蛋白裂解液,孵育20 min,离心,取上清至离心管中,进行蛋白定量和浓度测定。
1.6蛋白的检测制备SDS-PAGE凝胶,样品变性及电泳,转膜,封闭、抗体孵育及曝光等步骤进行检测。
1.7细胞增殖检测接种1×105个PANC-1和MiaPaCa-2细胞于6孔板,分别于0、1、2、3、4、5 d时应用台盘蓝染色后进行活细胞计数。在荧光显微镜下观查细胞生长情况,每天取出细胞进行计数,每组细胞数取出3孔进行计数,计算均值。以培养时间为横轴,细胞数为纵轴,重复3次,绘制PANC-1和MiaPaCa-2细胞增殖曲线。
1.8统计学方法应用SPSS 11.5统计软件进行数据分析,计量资料比较采用重复测量设计资料的方差分析。P<0.05为差异有统计学意义。
2结果
2.1稳定表达多克隆胰腺癌细胞株的荧光表现G418药物进行筛选,14 d后,筛选出稳定表达pIRES2-EGFP-ARHI(ARHI)和pIRES2-EGFP(Vector)基因多克隆胰腺癌细胞株(图1,2),荧光显微镜下可见大量的绿色荧光。
2.2Western blot检测ARHI蛋白表达无转染组和空载体组胰腺癌细胞无ARHI蛋白表达(ARHI蛋白相对分子质量为26 000),目的基因组胰腺癌细胞株和对照组胰腺组织可见ARHI蛋白表达(图3)。

图1 表达Vector和ARHI基因的PANC-1多克隆胰腺癌细胞株的荧光表现(×40)A.pIRES2-EGFP质粒;B.pIRES2-EGFP-ARHI质粒Figure1 StabletransfectedPANC-1pancreaticcancercelllinethatexpressedAR-HIandemptyvector(×40)图2 表达Vector和ARHI基因的MiaPaCa-2多克隆胰腺癌细胞株荧光表现(×40)A.pIRES2-EGFP质粒;B.pIRES2-EGFP-ARH质粒Figure2 StabletransfectedMiaPaCa-2pancreaticcancercelllinethatexpressedARHIandemptyvector(×40)
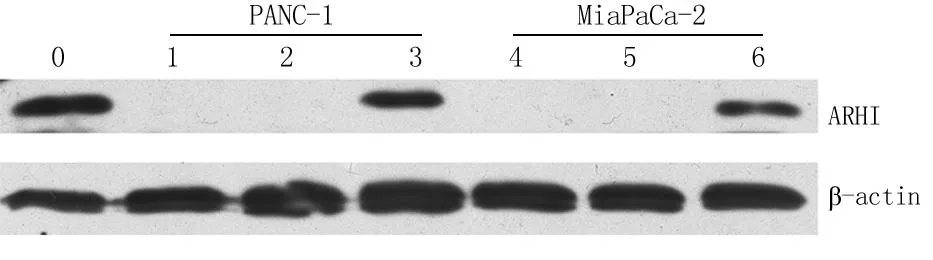
图3PANC-1、MiaPaCa-2细胞中的ARHI蛋白表达
0.对照组;1、4.无转染组;2、5.空载体组;3、6.目的基因组
Figure 3The expression of ARHI protein in PANC-1、MiaPaCa-2 stable transfected pancreatic cancer cell line
2.3稳定转染胰腺癌细胞株的生长曲线将无转染组、空载体组和目的基因组的PANC-1、MiaPaCa-2细胞以每孔1×105个接种于6孔细胞培养板。随时间延长,各组细胞株均呈增加趋势,无转染组增加最快,目的基因组增加最缓慢,组间、时点间、组间·时点间交互作用比较差异有统计学意义(P<0.05或<0.01)。见表1,2。
表1ARHI对PANC-1细胞生长的影响
Table 1The effect of ARHI on the growth of stable transfected PANC-1 cell
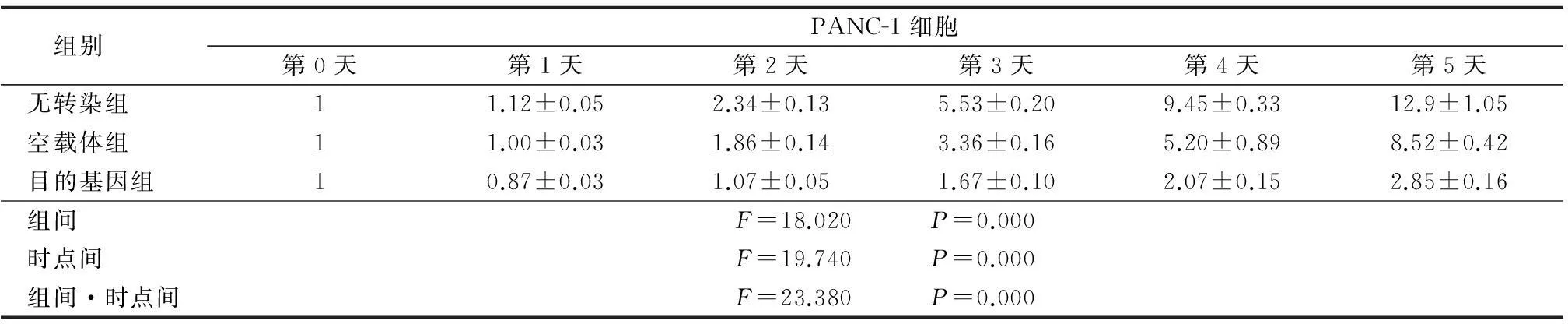
组别 PANC-1细胞第0天第1天第2天第3天第4天第5天无转染组 11.12±0.052.34±0.135.53±0.209.45±0.3312.9±1.05空载体组 11.00±0.031.86±0.143.36±0.165.20±0.898.52±0.42目的基因组 10.87±0.031.07±0.051.67±0.102.07±0.152.85±0.16组间 F=18.020 P=0.000时点间 F=19.740 P=0.000组间·时点间F=23.380 P=0.000
表2ARHI对MiaPaCa-2细胞生长的影响
Table 2The effect of ARHI on the growth of stable transfected MiaPaCa-2 cell

组别 MiaPaCa-2细胞第0天第1天第2天第3天第4天第5天无转染组 11.23±0.063.70±0.207.60±0.9322.60±2.3152.70±3.70空载体组 11.19±0.143.30±0.296.36±0.2412.10±1.1120.50±2.24目的基因组 10.90±0.051.35±0.142.03±0.173.16±0.184.73±0.40组间 F=4.460 P=0.0380时点间 F=25.240 P=0.0000组间·时点间F=36.910 P=0.0000

2.4ARHI基因与PI3K/AKT相关信号转导应用EGF=50 μg/L分别刺激0、15、30和60 min后,观察磷酸化AKT(p-AKT)和总AKT(T-AKT)的表达。结果表明,目的基因组胰腺癌细胞转染ARHI基因后,与空载体组比较,磷酸化的p-AKT蛋白表达明显下调,T-AKT蛋白表达没有变化。ARHI基因下调了p-AKT的表达(图4)。图4ARHI基因对胰腺癌PANC-1、MiaPaCa-2细胞PI3K/AKT通路的影响
Figure 4The effect of tumor suppression ARHI on PI3K/AKT pathway
3讨论
现有资料表明,胰腺癌的发生是多基因参与、多阶段累积渐进的复杂过程。癌基因激活和抑癌基因失活是肿瘤发生最基本的分子事件,这会导致细胞生长失控而发生癌变。在细胞癌变过程中,经常出现1个或多个抑癌基因的缺失,表明抑癌基因失活参与了胰腺癌的发生。ARHI是母源性印迹的抑癌基因,属于Ras超家族中的一员,但与Ras不同,具有抑癌作用。前期研究结果表明将ARHI基因转染导入该基因表达缺失的胰腺癌细胞,可以诱导胰腺癌细胞凋亡[6],其作用可抑制有丝分裂活化蛋白激酶(mitogen activated protein kinases,MAPK)信号通路,降低信号传导及转录活化因子(signal transducers and activators of transcription,STAT3)的活性[7]。
前期工作通过瞬时转染对ARHI基因的作用进行了初步研究,在此基础上,期望建立稳定表达ARHI基因胰腺癌细胞株,进一步详细地研究ARHI基因在胰腺癌中的功能和作用。选择了细胞株PANC-1和MiaPaCa-2是ARHI表达缺失的细胞株。在瞬时转染48 h后,通过G418筛选的方法,大概在筛选12~14 d后,无转染的细胞几乎全部死亡,G418浓度减半,继续维持筛选压力,大概在18~20 d,建立了可以满足实验要求的ARHI表达胰腺癌细胞株。通过RT-PCR 和Western blot的方法,在基因和蛋白水平上验证了稳定转染胰腺癌细胞株ARHI基因的表达,建立了稳定表达ARHI基因多克隆胰腺癌细胞株,这为下一步的研究奠定了基础。
ARHI基因是Ras超家族中第1个发现的抑癌基因,用脂质体包裹ARHI基因正义导入卵巢癌细胞株OVCA433、OVCA429、Hey后具有明显的克隆生长抑制作用。Wang等[8]发现ARHI基因在结肠癌中表达降低,与结肠癌的发生有明显的关系。Yu等[9]研究证明ARHI基因在肾癌细胞中表达明显降低,ARHI基因可以明显抑制肾癌细胞的生长,在肾癌细胞是一个肿瘤抑制基因。将人上皮性卵巢癌细胞株细胞种植于裸鼠皮下成瘤后半包埋缝于裸鼠脾区网膜建立网膜移植瘤模型,将GE7-β-gal 四元复合体经腹腔注入荷瘤鼠体内,ARHI基因导入治疗后瘤体明显小于空质粒对照组,核分裂相亦减少,实验组与空质粒对照组的抑瘤率分别为40.81% 和16.90%,癌组织的有丝分裂指数亦表明该基因治疗可阻止癌细胞进入分裂期,减少从而抑制卵巢癌生长。将人的ARHI基因转入FVB/B鼠体内,ARHI在肌肉、肾脏、脑、肺等都有表达,发现转基因鼠比对照组体质量低10%~40%。还有研究发现ARHI在正常胰腺组织中高表达,而在胰腺癌组织中表达明显降低,与胰腺癌的发生有着密切的关系[10]。
本研究接种了表达空载体和ARHI基因的胰腺癌细胞,观察了接种1~5 d细胞生长情况,绘制细胞增殖曲线。可见目的基因组细胞生长明显减慢,增殖抑制最明显。表明ARHI基因具有抑制胰腺癌细胞增殖的作用,体现了ARHI作为抑癌基因的特点。同样,从MiaPaCa-2细胞的生长曲线数据分析,我们可以得出相同的结论。
多年来,探讨Ras相关的信号传导通路始终是研究肿瘤的热点。大量研究表明Ras信号传导通路在调控正常细胞生长和恶性肿瘤转化过程中起着十分重要的作用,Ras启动的下游信号传导途径中,最经典的2条通路一是Ras-Raf-MAPKK-MAPK途径,另一个是PI3K/AKT途径,该信号通路在调节细胞生长和增殖方面起着与Ras-Raf-MAPKK-MAPK途径同等重要的作用,参与了许多信号通路的调节,并且对肿瘤中许多异常调节的过程有深远的影响[11-12]。刺激信号激活Ras后,可通过Ras上调PI3K/AKT通路的活性。AKT无疑是PI3K下游信号传导通路中的核心,介导了PI3K引起的许多生物反应。PI3K、AKT能够磷酸化并调控许多跟细胞代谢、凋亡、增殖和分化有关的蛋白,进而可通过多种途径调节细胞存活,抵抗细胞凋亡。
研究发现,PI3K/AKT途径在许多人类肿瘤中都是上调的,一些因素引起的肿瘤细胞增殖与该信号通路密切相关[13]。在胰腺癌中伴随着AKT活化,Shi等[14]应用PI3K抑制剂LY294002显示可以明显抑制胰腺癌细胞的生长。Li等[15]发现LY294002还可以导致胰腺癌细胞的凋亡。通过转染突变性的AKT(无ATP结合位点),证明了胰腺癌增殖明显减慢和促进凋亡的形成。以上研究表明PI3K/AKT信号通路在胰腺癌发挥着重要的作用。
ARHI可以抑制细胞的增殖和促进细胞的凋亡,与Ras家族上述信号转导途径作用相反,发挥着负向调节细胞生长作用。本研究观察了ARHI是否通过与Ras共同PI3K/AKT信号通路负向调节细胞的生长,结果显示目的基因组与空载体组相比,p-AKT的表达明显降低,总AKT没有变化,而ARHI组在EGF刺激0、15、30、60 min时,p-AKT没有明显的区别。因此ARHI作为抑癌基因抑制细胞的生长、诱导细胞凋亡,可能与PI3K/AKT信号通路有一定的关系,这为我们进一步研究打下了基础。
[参考文献]
[1]Seicean A,Petrusel L,Seicean R.New targeted therapies in pancreatic cancer[J].World J Gastroenterol,2015,21(20):6127-6145.
[2]Kim VM,Ahuja N.Early detection of pancreatic cancer[J].Chin J Cancer Res,2015,27(4):321-331.
[3]Tang SC,Chen YC.Novel therapeutic targets for pancreatic cancer[J].World J Gastroenterol,2014,20(31):10825-10844.
[4]Fu Y,Chen J,Pang B,et al.EZH2-induced H3K27me3 is associated with epigenetic repression of the ARHI tumor-suppressor gene in ovarian cancer[J].Cell Biochem Biophys,2015,71(1):105-112.
[5]Hubbard PA,Moody CL,Murali R.Allosteric modulation of Ras and the PI3K/AKT/mTOR pathway: emerging therapeutic opportunities[J].Front Physiol,2014,5:478.
[6]Hu YQ,Si LJ,Ye ZS,et al.Inhibitory effect of ARHI on pancreatic cancer cells and NF-κB activity[J].Mol Med Rep,2013,7(4):1180-1184.
[7]Hu Y,Yang H,Lu XQ,et al.ARHI suppresses pancreatic cancer by regulating MAPK/ERK 1/2 pathway[J].Pancreas,2015,44(2):342-343.
[8]Wang W,Chen L,Tang Q,et al.Loss of ARHI expression in colon cancer and its clinical significance[J].Contemp Oncol (Pozn),2014,18(5):329-333.
[9]Yu J,Kong CZ,Zhang Z,et al.Aplasia Ras homolog member I expression induces apoptosis in renal cancer cells via the β-catenin signaling pathway[J].Mol Med Rep,2015,11(1):475-481.
[10]路新卿,张再兴,沈香荣,等.胰腺癌中ARHI蛋白表达及临床意义[J].河北医科大学学报,2012,33(12):1375-1378.
[11]Sever R,Brugge JS.Signal transduction in cancer[J].Cold Spring Harb Perspect Med,2015,5(4):1-22.
[12]Martini M,De Santis MC,Braccini L,et al.PI3K/AKT signaling pathway and cancer: an updated review[J].Ann Med,2014,46(6):372-383.
[13]徐彦楠,周晨明,姚胜杰,等.PI3 K/AKT信号转导通路与肿瘤细胞增殖[J].河北医科大学学报,2015,36(1):107-109.
[14]Shi P,Yin T,Zhou F,et al.Valproic acid sensitizes pancreatic cancer cells to natural killer cell-mediated lysis by upregulating MICA and MICB via the PI3K/AKT signaling pathway[J].BMC Cancer,2014,14:370-379.
[15]Li J,Liang X,Yang X.Ursolic acid inhibits growth and induces apoptosis in gemcitabine-resistant human pancreatic cancer via the JNK and PI3K/AKT/NF-κB pathways[J].Oncol Rep,2012,28(2):501-510.
(本文编辑:赵丽洁)
Tumor suppression of ARHI gene on pancreatic cancer cell and mechanism
LU Xin-qing,ZHANG Wen-xian,LI Xiao-tian,ZHAI Jian-wen,SHEN Xiang-rong,LIU Zhi-jun*
(Department of Gastroenterology,the Affiliated Hospital of Hebei University of Engineering,Handan 056002,China )
[Abstract]ObjectiveTo observe the effects of aplysia ras homolog I(ARHI) gene on pancreatic cancer cell (PANC-1 and MiaPaCa-2)proliferation and to study the inhibition mechanism on the cancer cell growth.MethodsPANC-1 and MiaPaCa-2 cell lines were transfected with the ARHI constructs or with an empty plasmid as a control using lipofectmine 2000,and ARHI or vector stable transfected cell line was established by G418 selection.ARHI protein expression was analyzed by western blot method respectively.The growth curve was used to determine the effect of ARHI on the proliferation of stable transfected cell line.Western blot was used to examine the expression of protein T-AKT,p-AKT.ResultsThe ARHI stable transfected pancreatic cancer cells produced obvious expression of ARHI protein,but failed to induce detectable ARHI expression in empty plasmid transfected cells.The stable transfected pancreatic cancer cells all revealed a trend of increase with time prolonged in the non-transfected group,the empty plasmid transfected group and ARHI group,but pancreatic cancer cells grew most slowly in ARHI group.Statistical difference existed among these groups(P<0.05 or <0.01).The level of phosphorylated AKT in ARHI transfectants was found down-regulated when compared with vector controls in the regulation of PI3K/AKT signaling pathway.ConclusionARHI inhibited the growth of pancreatic cancer cell.ARHI expression blocked the activation of PI3K/AKT signaling in pancreatic cancer cells and may play an important role in the pancreatic carcinogenesis.
[Key words]pancreatic neoplasms;gene expression;cell proliferation
[中图分类号]R735.9
[文献标志码]A
[文章编号]1007-3205(2015)12-1375-05
[作者简介]路新卿(1975-),男,河北邯郸人,河北工程大学附*通讯作者。E-mail:gdyylzj@163.com
[基金项目]河北省科学技术研究与发展计划(13277744D;14277735D);河北省高等学校科学技术研究项目(ZD20131002);河北省医学科学研究重点课题(20110156)
[收稿日期]2015-10-21;[修回日期]2015-11-23
属医院副主任医师,医学博士,从事消化内科疾病诊治研究。

