葡萄籽原花青素对营养肥胖模型大鼠肠道菌群的影响
宋雪琳, 李雅梅, 肖俊松,*, 吴 华, 曹雁平
(1.北京工商大学北京市食品风味化学重点实验室/北京市食品添加剂工程技术研究中心/食品质量与安全北京实验室,北京 100048;2.江汉大学生命科学院,湖北 武汉 430070)
葡萄籽原花青素对营养肥胖模型大鼠肠道菌群的影响
宋雪琳1, 李雅梅1, 肖俊松1,*, 吴 华2, 曹雁平1
(1.北京工商大学北京市食品风味化学重点实验室/北京市食品添加剂工程技术研究中心/食品质量与安全北京实验室,北京 100048;2.江汉大学生命科学院,湖北 武汉 430070)
以高脂膳食喂养大鼠,复制营养肥胖模型,然后灌胃原花青素,采用变性梯度凝胶电泳,实时荧光定量等不依赖微生物培养的手段和多元统计分析方法,研究葡萄籽原花青素对营养肥胖模型大鼠肠道菌群生态的影响。结果表明,低剂量(100 mg/(kg·体重·d))原花青素可以显著抑制大鼠肥胖,处理后大鼠肠道菌群结构与模型组分离;葡萄籽原花青素显著降低了肥胖大鼠肠道菌群中厚壁菌门的含量,提高了拟杆菌门的含量,显著降低了厚壁菌门与拟杆菌门比值;实时荧光定量检测显示,原花青素可以促进拟杆菌增殖,抑制柔嫩梭菌增殖,初步揭示出葡萄籽原花青素可能具有调节肠道菌群的功能;原花青素作用的关键微生物种属为Blautia,Bacteroides,Lactobacillus,Anaerostipes,Clostridium,Anaerofilum。
葡萄籽原花青素;肥胖;肠道菌群;变性梯度凝胶电泳;实时荧光定量PCR
肠道菌群是人体最大的菌库,能够为宿主机体提供本身不具有的酶系和生化代谢通路。肠道菌群不仅有增强免疫、解毒、促进食物吸收与药物代谢等功能,而且能够通过多种途径调节宿主脂肪吸收、转运、存储和代谢全过程。肠道菌群作为人类的共生体,与人类体重及肥胖程度密切相关,可能是同遗传、饮食等导致肥胖基本因子发生偶合的关键因素[1]。
原花青素是一类多酚类物质,是以黄烷-3-醇(flavan-3-ol),如(+)-儿茶素((+)-catechin)和(-)-表儿茶素((-)-epicatechin)为单体,通过C4-C6或C4-C8键连接而成的聚合物。原花青素是植物重要的次生代谢产物,广泛存在于人类膳食中,果蔬中含量尤其丰富。研究表明,原花青素具有良好的抗氧化、清除自由基、减肥消炎等生理作用[2-3]。流行病学调查显示,膳食中的原花青素等多酚类物质的摄入能显著降低肥胖、糖尿病等代谢性疾病的发生概率[4]。Lee等[5]在研究原花青素对体外肠道菌群的影响中发现,原花青素能够有效抑制肠道致病菌,而对益生菌的影响较小。
机体肠道菌群数量庞大,种类繁多,对机体正常生理活动具有重要作用,因此对肠道菌群的认识和研究具有重要意义。大多肠道菌都是厌氧菌,用传统的分离、培养方法难以培养或目前的技术还不能够对其进行培养,相应的分析也难以进行,只有低于30%的细菌可经过目前的体外培养技术获得[6-7]。本实验采用分子生物学手段如变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE),实时荧光定量(real-time fluorescent quantitative polymerase chain reaction,PCR(RT-PCR))等方法研究粪便中菌群DNA的组成变化情况,分析葡萄籽原花青素对营养肥胖模型大鼠肠道菌群微生态环境的影响。
1 材料与方法
1.1 主要材料与试剂
葡萄籽原花青素(纯度≥95%),天津尖峰天然产物公司;琼脂糖,美国赛默飞世尔公司;DNA回收试剂盒、DL2000 DNA Marker、dNTP、10×buffer、Taq DNA聚合酶,宝生物工程(大连)有限公司;引物合成,上海生物工程有限公司;去离子甲酰胺、丙烯酰胺、尿素、过硫酸铵、四甲基二乙胺,北京拜尔迪生物技术有限公司;染料SYBR GreenⅡ,宝生物工程(大连)有限公司。
1.2 仪器与设备
MyCycler型PCR仪,变性梯度凝胶电泳仪和iQ5型实时荧光定量PCR仪,美国Bio-Rad公司;Image Quant 300型凝胶成像仪,美国GE公司。
1.3 实验方法
1.3.1 动物实验
SPF级Wistar雄性大鼠80只(90±10)g,购自北京华阜康生物科技股份有限公司。饲养于SPF级动物房,动物房温度25℃左右,湿度约60%,光照10~12 h/d,5只1笼。将80只Wistar雄性大鼠随机分为2大组,一组70只作为模型组,另一组10只作为正常组。正常组和模型组分别给予基础饲料和高脂饲料、花生、蛋黄喂养。造模期间大鼠自由摄食、饮水。模型组高于正常组体重20%时,认为造模成功,进行分组给药。给药期间,高、中、低剂量组分别按400,250,100 mg/(kg·d)的剂量以无菌水为溶剂给大鼠灌胃葡萄籽原花青素,阳性对照组灌胃低聚果糖1 g/(kg·d),模型对照和正常组灌胃无菌水。灌胃6周后,收集大鼠粪便样本至-80℃冰箱保存。
1.3.2 粪便细菌总DNA的提取
称量约200 mg的粪便样本,加入10 mL 0.1 mol/L,pH值为7.0的无菌磷酸钠缓冲液中,充分震荡悬浮5~10 min,500 r/min离心5 min,收集上清液。重复该步骤2~3次,上清液10 000 r/min离心10 min。收集沉淀,将沉淀悬浮于10 mL的缓冲液中,10 000 r/min离心5 min,洗涤沉淀,重复2~3次,最后收集沉淀。在菌体沉淀中加入570 μL TE buffer,反复吹打使之悬浮,加入30 μL 10%的十二烷基磺酸钠和10 μL蛋白酶K,混匀后37℃温育1 h;加入100 μL 5M NaCl,充分混匀加入80 μL,65℃预热的十六烷基三甲基溴化铵裂解液,混匀后65℃温育10 min;加入等体积的酚/氯仿/异戊醇(25∶24∶1),混匀,12 000 r/min离心10 min,直至有机相和水相间不再有蛋白质;转移上清液至新的1.5 mL EP管中,加入约0.7倍体积的异丙醇,轻轻混匀沉淀DNA至少1 h,12 000 r/min离心5 min;弃上清液,沉淀用70%的乙醇1 mL洗涤,12 000 r/min离心10 min,弃上清液,重复一次;干燥后加30 μL TE buffer,轻弹管壁使其混匀,-20℃保存。
1.3.3 DGGE条件的确定
采用通用引物扩增16S rDNA基因V3可变区。扩增引物序列(上游引物341fGC:5'-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGGC CTACGGGAGGCAGCAG-3'。下游引物518r:5'-ATTACCGCGGCTGCTGG-3')目的片段基因200 bp。PCR反应扩增体系(25 μL):0.13 μL Taq DNA聚合酶(5 U/μL),2.5 μL 10×buffer(Mg2+Plus),2 μL dNTPs(各2.5 mM),上下游引物各0.5 μL,DNA模板0.5 μL,加无菌双蒸水将体积补足至25 μL。采用降落PCR反应程序:94℃预变性4 min;94℃变性1 min,65℃退火1 min,72℃延伸1 min,执行20个循环,每个循环退火温度降低0.5℃;94℃变性1 min,55℃退火1 min,72℃延伸1 min,再执行5个循环。将琼脂糖凝胶电泳检测扩增合格样品进行复原条件PCR(50 μL)扩增,滴入0.25 μL Taq DNA聚合酶(5 U/μL),5.0 μL 10×buffer(Mg2+Plus),4 μL dNTPs(各2.5 mM),上下游引物各1 μL,DNA模板1 μL,加无菌双蒸水将体积补足至50 μL。反应体系:94℃预变性3 min;94℃变性1 min,55℃退火1 min,72℃延伸1 min,进行5个循环;72℃维持5 min。将琼脂糖凝胶电泳检测合格样品进行DGGE。
DGGE采用7.5%的聚丙烯酰胺凝胶,变性梯度范围25%~55%,上样量为40 μL样本和10 μL loading buffer,电泳缓冲液为1×TAE,电压45 V,60℃电泳15 h,电泳结束后溴化乙锭染色20 min,然后用水漂洗20 min,通过凝胶成像系统成像。PCR扩增条带切胶回收纯化,送北京华大基因TA克隆测序。将测序得到的16S rDNA序列在Genebank上进行序列比对,得到每条条带菌所属的类别,并比较不同泳道(组别)样本中不同门类菌的相对含量。
1.3.4 质粒标准品制备
采用特异性引物进行PCR,纯化PCR产物,测定其浓度,并根据其分子量计算其拷贝数,即得相应菌属的质粒标准品。各菌属扩增引物及条件为:
乳酸菌属特异性扩增[8]。引物Lac1:5'-AGCAGTAGGGAATCTTCCA-3'。Lac2:5'-ATTYCACCGCTACACATG-3'。扩增体系同1.3.3中25 μL体系。反应条件:94℃预变性2 min;94℃变性30 s,61℃退火1 min,72℃延伸1 min,进行30个循环;72℃延伸7 min。
拟杆菌特异性扩增[9]。引物Bfr-F:5'-CTGAACCAGCCAAGTAGCG-3'。Bfr-R:5'-CCGCAAACTTTCACAACTGACTTA-3'。扩增体系同1.3.3中25 μL体系。反应条件:95℃预变性2 min;95℃变性30 s,52℃退火30 s,72℃延伸1 min,进行30个循环;72℃延伸5 min。
柔嫩梭菌特异性扩增[10-11]。引物Clep-F:5'-GCACAAGCAGTGGAGT-3'。Clep-R3:5'-CTTCCTCCGTTTTGTCAA-3'。扩增体系同1.3.3中25 μL体系。反应条件:94℃预变性5 min;94℃变性20 s,50℃退火20 s,72℃延伸30 s,进行30个循环;72℃延伸5 min。
1.3.5 特定菌属的RT-PCR检测
质粒标准品进行10倍梯度稀释,获得系列拷贝数梯度的质粒标准品,以此为模板进行RT-PCR。以PCR反应的Ct值为纵坐标,初始拷贝数的对数作为横坐标,构建标准曲线。
不同菌属的实时荧光定量PCR(25 μL)的扩增体系:12.5 μL染料SYBR GreenⅡ,上下游引物各1 μL,DNA模板或者质粒标准品1 μL,双蒸水9.5 μL。乳酸菌实时荧光定量PCR反应程序:94℃预变性3 min;94℃变性10 s,56℃退火30 s,72℃延伸30 s,进行40个循环;55℃保持10 s后,读取反应管中的荧光信号。拟杆菌实时荧光定量PCR反应程序:94℃预变性3 min;94℃变性10 s,60℃退火30 s,72℃延伸30 s,进行40个循环;55℃保持10 s后,读取反应管中的荧光信号。柔嫩梭菌实时荧光定量PCR反应程序:94℃预变性3 min;94℃变性10 s,54℃退火30 s,72℃延伸30 s,进行40个循环;55℃保持10 s后,读取反应管中的荧光信号。每个样本重复3次,根据标准曲线计算样本中该菌初始拷贝数,换算成每克粪便样本中该菌的初始拷贝数。
1.3.6 数据处理
应用Quantity One软件对DGGE图谱进行数字化处理;采用SIMCA 13.0统计软件进行多元统计分析PCA,PLS-DA分析;采用SPSS 17.0软件进行显著性检验;采用Origin 8.5软件绘图。
2 结果与分析
2.1 大鼠体重变化情况
造模成功后,按实验设计给药处理6周,每周测量各组大鼠体重,体重动态变化如图1。

图1 营养肥胖模型大鼠灌胃原花青素期间体重变化Fig.1 Change of body weight of diet-induced obesity rats treated with grape seed procyanidins
从图1可以看出,灌胃初期,灌胃组和模型组体重几乎没有差异,均高于正常组体重20%。随着灌胃时间的延长,高、中、低剂量原花青素灌胃组体重相较于模型组体重均有所减轻。第5周低剂量组体重显著低于模型组(P<0.05),第6周中、低剂量组体重均显著低于模型组(P<0.05)。高剂量组和阳性组体重有降低趋势,但不显著。
2.2 DGGE分析
将检测合格的各组大鼠粪便DNA样品,进行DGGE分析,染色后凝胶成像得到DGGE图谱如图2。
从图2中可以看出,不同组别的DGGE图谱存在相似和不同的条带,但直观上难以看出区别。故采用Quantity one软件数字化处理,每个条带的光密度值可作为该条带所代表的微生物类群的丰度值,归一化处理后得到其相对丰度。不同泳道上相同位置的条带视为相同的微生物类群,作为一个变量,最终分析了33个不同位置条带,故有33个变量。样品按行整理,指标(33个菌群)按列整理,得到了16 ×33的数据矩阵。
采用SIMCA 13.0软件进行数据降维分析和可视化呈现,尝试主成分分析法(PCA,principal component analysis)和偏最小二乘判别分析(PLS-DA,partial least squares-discriminant analysis)。运用PCA尝试发现反映事物主要特征的变量,反应样品的特征,解释实验现象;PLS-DA利用现有的样本判别模型,分析组间差异较小而组内差异较大的数据,消除随机误差,有利于发现组间差异和差异条带。两种模型分析结果如图3。
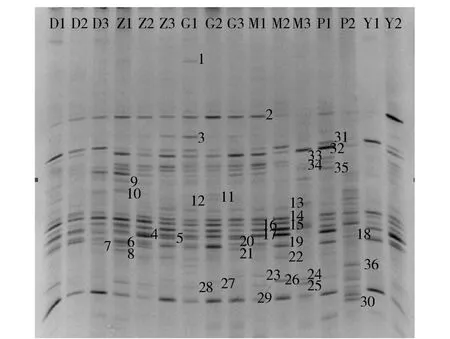
图2 各组大鼠肠道菌群16S rRNA V3可变区DGGE图谱Fig.2 DGGE electropherogram of 16S rRNA V3 variable region of gut microflora in rats
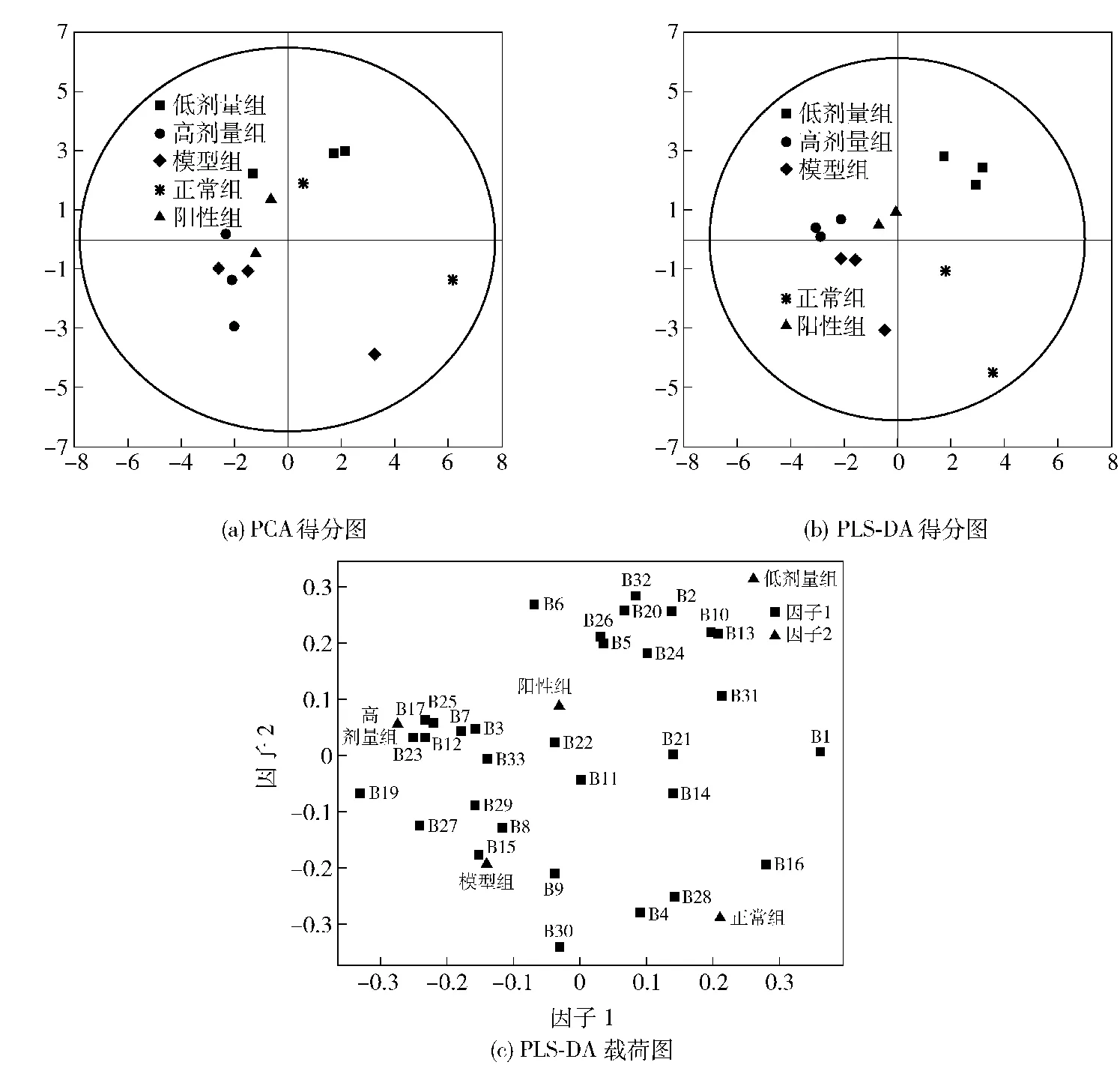
图3 DGGE条带的PCA和PLS-DA分析Fig.3 Analysis of DGGE data using PCA and PLS-DA methods
图3(a)显示,低剂量组、阳性组和正常组较为接近,高剂量组则和模型组较为接近,说明低剂量组和阳性组肠道菌群有向正常转化的趋势。图3(b)显示,模型组与正常组距离较远,说明高脂膳食确实显著改变了肠道菌群;高剂量组与模型组距离较近,说明高剂量组对肠道菌群影响不大;低剂量组、正常组分别分布于第一和第二象限,其肠道菌群结构与模型组有较大区别,说明低剂量原花青素能改变高脂肥胖大鼠体内肠道菌群结构。
图3(c)为因子载荷图。以“VIP”值大于1为标准,初步筛选对解释组间差异重要的条带,共计15条,分别为B1,B2,B12,B13,B16,B17,B18,B19,B23,B24,B25,B27,B28,B31。多重比较显示,与模型组相比,低剂量组B1,B2,B12,B13,B16,B23,B25,B27条带的相对丰度有显著差异(P<0.05,阳性组与正常组因只有2个样本,未作多重比较)。
2.3 各组别的菌群结构分析
所有36个条带割胶测序,在16S rRNA数据库中进行序列比对,以相似度>95%为标准选取参考菌株,用Mega 6.0软件Neighbour-Joint法构建系统发育树,对条带所代表的微生物种群进行鉴定,鉴定结果图4。图4显示,原花青素作用的部分关键菌群为条带B1(Blautia spp.),B2(Bacteroides spp.),B12(Lactobacillus spp.),B13(Anaerostipes spp.),B16(Blautia spp.),B17(Blautia spp.),B18(Clostridium spp.),B19(Anaerostipes spp.),B23(Lactobacillus spp.),B24(Lactobacillus spp.),B25(Lactobacillus spp.),B27(Anaerofilum spp.)。大部分为目前已知的肠道微生物,说明该方法对主要微生物类群有较好的分析效果,但是含量较少的微生物,由于提取的DNA量有限,无法在电泳上分离。
根据鉴定结果,分析各个条带所代表的菌的类群。根据分析结果按照门(phylum),纲(class),目(order)对肠道菌群进行归类,得到肠道菌群主要类群的相对丰度值分布如图5。
从图5可以看出,各组大鼠肠道菌群主要由拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)三个门构成,与Hildebrandt等[10]的研究比较,缺少柔膜菌门(Tenericutes)。各组大鼠的肠道菌群以厚壁菌门所占比例最多,且其中梭状芽胞杆菌纲(Bacillales)所占比例最大,其次为乳杆菌目(Lactobacillales)和芽孢杆菌目(Bacillales)。
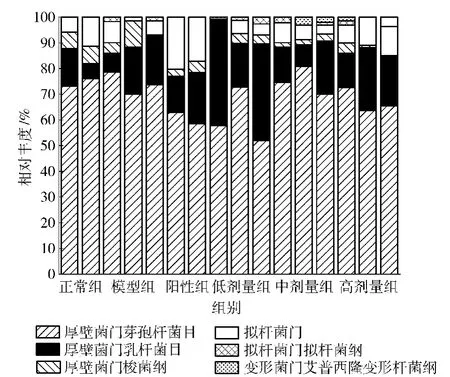
图5 大鼠肠道菌群主要细菌类群的相对丰度分析Fig.5 Relative content of main bacteria groups in gut microflora of rats
对厚壁菌门和拟杆菌门的微生物相对丰度进行比较结果见图6.由图6可以发现,与模型组相比,正常组、阳性对照组、高剂量组厚壁菌门细菌含量显著降低;正常组、阳性对照组、高剂量组拟杆菌门含量显著增加,且以阳性对照组最好;厚壁菌门与拟杆菌门比值各组与模型组相比都有显著降低。

图6 各组大鼠肠道菌群中厚壁菌门和拟杆菌门相对丰度的比较Fig.6 Comparison of Firmicutes and Bacteroidetes and their ratio in gut microflora of different rat groups
2.4 RT-PCR定量
根据DGGE条带计算微生物相对丰度值,受到微生物16S rRNA序列扩增效率的干扰,结果有一定的失真。因此,采用实时荧光定量PCR(RTPCR)对肠道中比较重要的3个微生物类群乳酸菌(lactic acid bacteria)、拟杆菌(Bacteriodes spp.)、柔嫩梭菌(Clostridium leptum)进行定量,结果如图7。
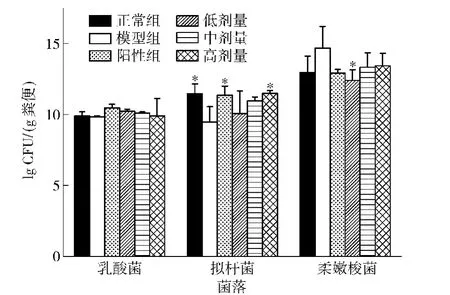
图7 葡萄籽原花青素对营养肥胖大鼠肠道乳酸菌、拟杆菌、柔嫩梭菌丰度的影响Fig.7 Effects of GSP on the content of lactic acid bacteria,Bacteriodes and Clostridium leptum in gut microflora of DIO rats
由图7可见,各组大鼠肠道菌群中乳酸菌丰度无显著区别,提示低聚果糖、原花青素对乳酸菌丰度无显著影响,可能与乳酸菌在肠道中丰度本来就很低有关;原花青素高剂量组拟杆菌丰度显著高于模型组,达到与正常组无显著区别水平,低聚果糖亦有类似效果,说明高剂量原花青素可以促进拟杆菌增殖,达到与正常大鼠相同的水平;低剂量原花青素组柔嫩梭菌丰度显著低于模型组,而其他各组无显著区别。
拟杆菌也称类杆菌,是厌氧、糖发酵、有胆汁抗性且不形成孢子的革兰氏阴性杆菌,是人体肠道内菌群数量最大的微生物之一,大约占肠道内细菌细胞总数的25%以上。拟杆菌具有参与人体的营养吸收以及维持肠道的正常生理的作用。拟杆菌可以吸收和降解膳食中人体不能够降解的多种植物多糖,参与脂肪代谢,调节细菌毒素的产生与增强宿主固有的免疫反应等,有研究表明,拟杆菌丰度的增加可能有益健康,柔嫩梭菌与某些疾病,如结肠癌,溃疡性结肠炎有关,其丰度的减少可能会有助于人体健康[12]。由本实验结果可以得出,葡萄籽原花青素和低聚果糖能够提高机体肠道中拟杆菌的丰度,降低柔嫩梭菌的丰度,具有调整肠道菌群的作用。
3 结 论
近年研究表明,肠道菌群异常可能是肥胖发生的原因[13]。长期的高脂膳食会导致肠道菌群微生态环境的紊乱,肠道通透性异常增加,内毒素、鞭毛蛋白等外界抗原透过肠道壁进入血液,导致慢性炎症反应,诱发肥胖,糖尿病等慢性代谢性疾病[14-15]。本研究表明,即使灌胃期间仍然给予高脂膳食,和对照组相比,葡萄籽原花青素也显著抑制大鼠体重的增长。抑制效果以低剂量组原花青素最佳,说明原花青素可能不是通过抑制相关消化酶类,从而抑制营养物质吸收来抑制体重增长。原花青素可能通过改善肠道菌群结构,修复肠道通透性,从而抑制肠道内毒素进入血液诱发炎症反应来抑制肥胖发生。
对肠道菌群结构的分析部分证实了原花青素通过肠道菌群抑制肥胖的假设,低剂量原花青素能使大鼠肠道菌群结构远离模型组;DGGE的分析结果表明,肠道中各种微生物的相对丰度发生了显著变化。从门的水平来看,高脂膳食喂食的肥胖大鼠肠道菌群中厚壁菌门所占的比例更高,拟杆菌门所占的比例相对较少。葡萄籽原花青素和低聚果糖都能够有效降低营养肥胖型大鼠肠道菌群中厚壁菌门的量,增加拟杆菌门的量,提高F/B比值,说明葡萄籽原花青素能够改善肥胖模型大鼠肠道菌群结构。RT-PCR定量研究也发现,原花青素可以促进有益的拟杆菌增殖,抑制有害的柔嫩梭菌增殖,对优势菌群具有显著的调节作用。
肥胖与肠道菌群中的拟杆菌门和厚壁菌门丰度密切相关,它们能够影响肠道菌群的代谢能力[16-17]。Ley等[11]研究发现肥胖小鼠中厚壁菌门比例增加,拟杆菌门比例降低,比值增加。人体试验也表明,体质指数的下降伴随着肠道拟杆菌门细菌的丰度逐渐升高[16-17]。本研究与Ley等的结果一致,揭示原花青素可能通过降低厚壁菌门,增加拟杆菌门微生物含量,起到减肥效果。
本研究受限于变性梯度凝胶电泳技术本身的精度,无法对肠道中丰富的微生物类群进行深度分析,因此,接下来将采用宏基因组测序技术等,考察原花青素对肠道菌群的具体影响。
[1]杨迎花,李玉峰,寇丽.从葡萄籽中分离纯化原花青素的研究[J].天津科技大学学报,2008,23(4):52 -53.
[2]Decorde K,Teissedre P,Sutra T,et al.Chardonnay grape seed procyanidin extract supplementation prevents high-fat diet-induced obesity in hamsters by improving adipokine imbalance and oxidative stress markers[J].Mol Nutr Food Res,2009,53(5):659-666.
[3]Pinent M,Bladé C,Salvadó M J,et al.Procyanidin effects on adipocyte-related pathologies[J].Crit Rev Food Sci Nutr,2006,46(7):543-550.
[4]Kimberly A G,Joshua D L.Laboratory,epidemiological,and human intervention studies show that tea(Camellia sinensis)may be useful in the prevention of obesity[J]. J Nutr,2010,140(3):3446-3453.
[5]Lee H C,Jenner A M,Low C S,et al.Effect of tea phenolics and their aromatic fecal bacterial metabolites on intestinal microbiota[J].Res Microbiol,2006,157(9):876-884.
[6]Wilson K H,Blitchington R B.Human colonic biota studied by ribosomal DNA sequence analysis[J].Appl Environ Microbiol,1996,62(7):2273-2278.
[7]Suau A,Bonnet R,Sutren M,et al.Direct analysis of genes encoding 16S rRNA from complex communities reveals many novel molecular species within the human gut[J].Appl Environ Microbiol,1999,65(11):4799-4807.
[8]Walter J,Hertel C,Tannock G W,et al.Detection of Lactobacillus,Pediococcus,Leuconostoc,and Weissella species in human feces by using group-specific PCR primers and denaturing gradient gel electrophoresis[J].Appl Environ Microbiol,2001,67(6):2578-2585.
[9]Liu C,Song Y,Mcteague M,et al.Rapid identification of the species of the Bacteroides fragilis group by multiplex PCR assays using group and species-specific primers[J].FEMS Microbiol Letters,2003,222(1):9-16.
[10]Hildebrandt M A,Hoffmann C,Sherrill-Mix S A,et al. High fat diet determines the composition of the murine gut microbiome independently of obesity[J].Gastroenterology,2009,137(5):1716-1734.
[11]Ley R E,Turmbaugh P J,Klein S,et al.Human gut microbes associated with obesity[J].Nature,2006,444(7122):1022-1023.
[12]魏华.不同外源扰动因素对肠道菌群组成结构影响的研究[D].上海:上海交通大学,2008.
[13]Martin F J,Dumas M,Lindon J C,et al.A top-down systems biology view of microbiome mammalian metabolic interactions in a mouse model[J].Mol Syst Biol,2007,3(1):2-16.
[14]Stenman L K,Holma R,Korpela R.High-fat-induced intestinal permeability dysfunction associated with altered fecal bile acids[J].World J Gastroenterol,2012,18(9):923-929.
[15]Moreira A P B,Texeira T F S,Ferreira AB,et al.In-fluence of a high-fat diet on gut microbiota,intestinal permeability and metabolic endotoxaemia[J].Br J Nutr,2012,108:801-809.
[16]Turmbaugh P J,Ley R E,Mahowald M A,et al.An obesity-associated gut microbiome with increased capacity for energy harvest[J].Nature,2006,444(7122):1027-1031.
[17]Turnbaugh P J,Backhed F,Fulton L,et al.Diet-induced obesity is liked to marked but reversible alterations in the mouse distal gut microbiome[J].Cell Host Microbe,2008,3(4):213-223.
Effect of Grape Seed Proanthocyanidins on Gut Microbiota of Diet-Induced-Obesity Rats
SONG Xuelin1, LI Yamei1, XIAO Junsong1,*, WU Hua2, CAO Yanping1
(1.Beijing Key Laboratory of Food Flavor Chemistry/Beijing Engineering and Technology Research Center of Food Additives/Beijing Laboratory for Food Quality and Safety,Beijing Technology and Business University,Beijing 100048,China;2.College of Life Sciences,Jianghan University,Wuhan 430070,China)
Wistar rats were fed with high fat diet to induce the diet-induced obesity model(DIO),and then gavaged with grape seed proanthocyanidins(GSP)of different doses.Culture-independent methods such as denaturing gradient gel electrophoresis(DGGE)and real-time fluorescent quantitative polymerase chain reaction(real-time PCR)were applied,coupled with multivariate analysis,to explore the effect of GSP on the microbiota of DIO rats.Results showed that GSP treatment(100 mg/(kg·bw·d))could inhibit high-fat induced obesity,and its gut microbiota profile was separated from that of the model group. Results also suggested that GSP-treated groups had the lower Firmicutes content and higher Bacteroidetes
content and the ratio of Firmicutes to Bacteroidetes increased in this group.Real-time-PCR results indicated that GSP promoted the proliferation of Bacteriodes spp.and inhibited that of Clostridium leptum.The key genera the GSP might have an effect on were as follows:Blautia,Bacteroides,Lactobacillus,Anaerostipes,Clostridium,Anaerofilum.
grape seed proanthocyanidins;obesity;gut microbiota;denaturing gradient gel electrophoresis;real time-PCR
叶红波)
TS201.3
A
10.3969/j.issn.2095-6002.2015.05.007
2095-6002(2015)05-0039-08
宋雪琳,李雅梅,肖俊松,等.葡萄籽原花青素对营养肥胖模型大鼠肠道菌群的影响[J].食品科学技术学报,2015,33(5):39-46.
SONG Xuelin,LI Yamei,XIAO Junsong,et al.Effect of grape seed proanthocyanidins on gut microbiota of diet-inducedobesity rats[J].Journal of Food Science and Technology,2015,33(5):39-46.
2015-01-11
国家自然科学基金资助项目(31201323);“十二五”国家科技支撑计划项目(2011BAD23B02);北京市属高等学校高层次人才引进与培养计划项目(0142132014)。
宋雪琳,女,硕士研究生,研究方向为功能食品;*肖俊松,男,副教授,博士,主要从事功能食品方面的研究。通信作者。

