慢性阻塞性肺疾病急性加重期患者认知障碍的发生及危险因素分析
李文君,万毅新,王晓平,魏海东,王 虹,陶红艳,黄晖蓉
(兰州大学第二医院呼吸科,兰州730000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是呼吸系统常见的一种可以预防和治疗的疾病,其特征是持续存在的气流受限,气流受限进行性发展,随着病程发展,可导致低氧和(或)高碳酸血症,且急性加重和合并症影响患者整体疾病的严重程度。COPD 不仅可导致肺部一系列的变化,其引起的系统性炎症可导致全身多器官发生功能障碍。近年来,随着人们对COPD 并发症的认识,认知障碍作为COPD 的重要肺外并发症逐渐被重视,其在COPD 患者中的发生率逐渐上升[1],且中至重度认知障碍可导致患者死亡风险增加。本调查主要研究对象为慢性阻塞性肺疾病急性加重期(AECOPD)患者,通过调查分析了解AECOPD 患者发生认知障碍的危险因素,为今后该疾病的治疗及长期预后提供一些临床依据。
1 资料与方法
1.1 一般资料 收集2013年1月至2014年1月本院呼吸科就诊的AECOPD 患者,诊断符合中华医学会呼吸病学分会2011年制定《慢性阻塞性肺病诊治指南》。AECOPD 患者共47例,年龄(65.00±9.14)岁,无支气管哮喘、肺间质纤维化、肺部及其他部位肿瘤史,无严重心血管病及糖尿病史,既往无精神疾病、脑外伤及脑部疾患、严重躯体疾病病史及文盲者。体检中心选40例健康者作为对照组,年龄(65.90±7.92)岁,既往无精神疾病,既往未服用导致认知下降的药物(抗胆碱药、苯二氮卓类、三环类抗抑郁药、抗惊厥、H2 受体阻滞剂、非甾体类抗炎药等)、严重躯体疾病病史及文盲者。两组性别、年龄、文化程度、吸烟指数比较,差异无统计学意义(P>0.05),以上人员为自愿参加测试。
1.2 研究方法
1.2.1 AECOPD 患者的病情严重程度评估 应用BODE 指数(包括BMI、气流阻塞程度、呼吸困难、运动能力)进行评估。
1.2.2 认知功能的评估 采用MocA 量表进行评估,主要包括8个认知领域:执行能力、视空间能力、语言、短时记忆与延迟记忆、注意力、计算能力及抽象思维、定向。最高分为30分,分值小于26分为异常,受教育年限小于12年加1分以修正文化程度引起的偏倚。MocA 量表的评估在患者接受正常治疗并于安静清醒状态下进行,进行问答形式并于10 min内将问卷收回。
1.2.3 肺功能、血气分析的检测 采用德国耶格公司Master Screen肺功能检测系统行肺功能检测,于认知功能评估的当天在不吸氧的情况下进行血气分析检测。
1.3 统计学处理 采用SPSS17.0统计软件进行处理,符合正态分布的计量资料采用±s表示,行两独立样本t检验;非正态分布的计量资料采用中位数(四分位数间距)表示,行两独立样本Mann-WhitneyU检验;所有计数资料采用χ2检验,采用Pearson相关分析进行相关分析,采用多因素Logistic回归分析进行归因分析,以P<0.05表示差异有统计学意义。
2 结 果
2.1 两组认知障碍的发生率比较 AECOPD 组认知障碍30例(63.8%),对照组认知障碍8例(20.0%),两组间认知障碍的发生率差异有统计学意义(χ2=16.875,P<0.01)。
2.2 AECOPD 患者不同分组间认知障碍发生率的比较 肺功能检查:FEV1%预计值大于或等于50%患者共30例,认知障碍19例(63.3%),FEV1%预计值小于50%患者共17例,认知障碍11例(64.7%),两组间比较认知障碍的发生率差异无统计学意义(χ2=0.009,P>0.05)。BODE 指数:1 级19 例,认知障碍7例(36.8%),2级18例,认知障碍14例(77.8%),3级10例,认知障碍9例(90.0%);各组间认知障碍的发生率差异有统计学意义(χ2=10.477,P<0.01),BODE 指数越高,认知障碍的发生率越高。
2.3 AECOPD 患者MoCA 量表评分与PaO2值、PaCO2值 的相关性 Pearson相关分析显示AECOPD 患者MoCA 量表评分与PaO2值之间呈正相关(r=0.396,P<0.01),MoCA 量表评分与PaCO2值之间呈负相关(r=-0.572,P<0.01)。见图1、2。
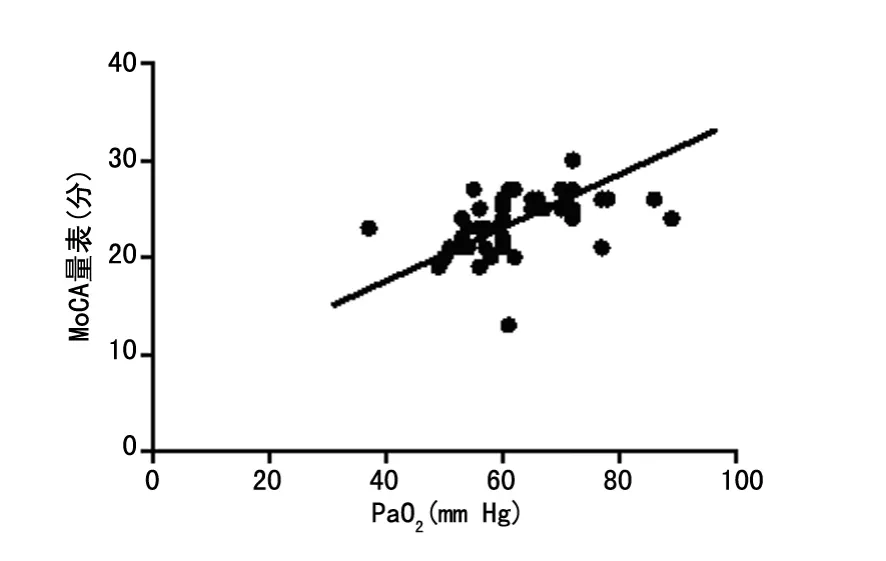
图1 AECOPD 患者MoCA 量表评分与PaO2 值的相关性

图2 AECOPD 患者MoCA 量表评分与PaCO2 值的相关性
2.4 AECOPD 患者认知障碍的危险因素分析 Logistic回归分析示,AECOPD 患者认知障碍的发生与受教育程度、病程、BODE指数相关(P<0.05),受教育程度越低、病程越长、BODE指数越高,AECOPD 患者认知障碍的发生率越高;性别、年龄、吸烟指数与AECOPD 患者认知障碍的发生无相关(P>0.05)。见表1。

表1 Logistic回归分析AECOPD 患者发生 认知障碍的危险因素
3 讨 论
认知功能是可以巩固信息处理的高级神经活动,轻度认知障碍是一种认知功能下降,介于正常认知功能与痴呆的一种认知状态,并不明显影响患者的社会及工作能力,但是对患者的健康水平及日常生活能力可产生影响。轻度认知障碍是痴呆的高危因素,Villeneuve等[2]发现有轻度认知障碍的患者有一半在3年内发展为痴呆。认知障碍在AECOPD 患者中的机制尚不明确,现在认为认知下降主要由于AECOPD 患者发生系统性炎症致脑微血管损伤导致[3]。MocA 量表评估轻度认知障碍,可发现早期可疑的认知障碍[4]。本调查证实AECOPD患者相对于对照组存在着明显的认知障碍,国外一项研究示慢阻肺急性发作患者合并认知障碍的发生率为57%[3],本研究示该发生率为63.8%,稍高于国外研究。FEV1%预计值是气流受限分级的指标,不能全面反映病情变化,并且由于其不能反映该疾病肺外并发症的特征,所以FEV1不能作为判断预后的指标。既往相关文献示肺功能分级不同,认知障碍的发生率无明显差异[5],而有些研究表明肺功能分级越高,认知障碍的发生率越低,且肺功能的下降可增加痴呆的风险,本调查中AECOPD 患者根据肺功能不同分组,结果示FEV1%预计值大于或等于50%组与FEV1%预计值小于50%组患者认知障碍的发生率无明显差异。BODE 指数是用于评估COPD 患者病情严重程度及病死率的一种复合评分系统,在预测COPD 患者的生存率、肺减容术(LVRS)后的生存率、住院率、生活质量,评估COPD 患者的运动耐量、病情、治疗效果等方面有重要意义并取得了良好的效果。Dodd[3]发现,患者的认知受损与健康状况及疾病的严重程度有密切联系,重度COPD 患者较轻-中度COPD 患者认知功能下降的更加明显[6],本调查发现,BODE指数分级的不同,AECOPD 患者各组间认知障碍的发生率有显著性差异,病情越重,认知功能障碍发生率越高。BODE指数全面地反映了AECOPD 患者疾病的严重程度,并且与患者预后相关,同时提示要对COPD 患者及早诊断,及时治疗,以免病情加重导致肺外并发症的发生加重疾病的严重程度。低氧和(或)高碳酸血症是COPD 患者重要的临床表现,重度缺氧的认知障碍会随着时间变得更糟,且血二氧化碳分压水平可提示认知下降,亦可提示疾病的严重程度[7],本调查显示AECOPD 患者MocA 量表的评分与PaO2值呈正相关,与PaCO2值呈负相关,既往国内调查发现,肺性脑病患者认知功能障碍的严重程度与PaO2下降的程度及PaCO2升高的程度呈正相关[8]。COPD 患者的脑灌注障碍主要位于皮质、大脑额叶,慢性缺氧主要影响选择性的认知功能[9],主要表现在记忆力、注意力、执行能力等方面;PaCO2影响记忆力、复杂注意力、处理信息的能力。本研究发现,患者的认知功能下降主要表现在延迟回忆、视空间与执行力等方面,与国外研究发现[10-11]相一致,且合并有认知障碍的AECOPD 患者总体反应时间明显变长。
AECOPD 患者认知障碍发生的危险因素尚不明确,国外研究表明,文化程度越高,认知障碍的发生率越低[12],疾病的严重程度越轻,认知障碍的发生率越低[6],而病程对认知障碍的发生尚无明确影响。本调查显示较长的病程、较低的教育程度、较高的BODE指数是AECOPD 患者发生认知障碍的危险因素,而性别、年龄、吸烟与认知障碍的发生无明显相关性。国外研究显示男性、年龄亦可影响脑功能发挥[11],香烟对于认知功能的损伤是一个具有争议的危险因素,而且是脑血管疾病的一个独立危险因素,吸烟可导致皮层下脑血流动力学的改变,致越来越严重的回忆及执行能力的受损,本调查由于COPD患者处于急性加重期及城市污染等因素,未发现性别、年龄及吸烟对AECOPD 患者的认知障碍的显著影响。
COPD 伴有认知障碍的患者住院率、病死率较无认知障碍的COPD 患者明显升高,认知障碍可促进疾病进展,随着年龄增长,COPD 与认知障碍都可加重,亦可增加老年人的发病率和病死率,COPD 与认知障碍共存具有叠加效应[13]。认知障碍可增加急性加重的概率[11],而急性加重期的认知功能下降是可以恢复的,2006年的一项研究表明,认知障碍是COPD 患者死亡的独立危险因素[12],以慢性缺氧及系统性炎症为特征的COPD 患者或许是阿尔茨海默病的一种亚临床表现。本调查结果与国内外相关研究结果大体一致,表明COPD 患者尤其是处于急性加重期者易并发认知障碍,严重影响患者急性加重期的治疗、增加患者在急性加重期病死率、影响患者长期预后。由于本研究样本量较少,调查结果的准确性仍有一定的局限性,需更深入的调查、随访,了解患者稳定期的认知功能的恢复情况,并且COPD患者的认知障碍的发病机制尚不明确,是急性的、慢性的,可逆还是不可逆需继续深入研究。明确的认知功能下降的诊断及认知功能的锻炼可列入COPD患者的长期康复方案,这对患者的治疗、预后及生活质量提高有重要意义。
[1] Antonelli-Incalzi AR.Screening of cognitive impairment in chronic obstructive pulmonary disease[J].Dement Geriatr Cogn Disord,2007,23(4):264-270.
[2] Villeneuve S,Massoud F,Bocti C,et al.The Nature of episodic memory deficits in MCI with and without vascular burden[J].Neuropsychologia,2011,49(11):3027-3035.
[3] Dodd JW.Cognitive Dysfunction in Patients Hospitalized With Acute Exacerbation of COPD[J].Chest,2013,144(1):119-127.
[4] Villeneuve S,Pepin V,Rahayel S,et al.Mild cognitive impairment in moderate to severe COPD:apreliminary study[J].Chest,2012,142(6):1516-1523.
[5] Thakur N.COPD and cognitive impairment:the role of hypoxemia and oxygen therapy[J].Int J Chron Obstruct Pulmon Dis,2010(5):263-269.
[6] Li JH,Fei GH.The evaluation of cognitive impairment and relevant factors in patients with chronic obstructive pulmonary disease[J].Respiration,2013,85(2):98-105.
[7] Klein M,Gauggel S,Sachs G,et al.Impact of chronic obstructive pulmonary disease(COPD)on attention functions[J].Respir Med,2010,104(1):52-60.
[8] 刘晨,张晓伟,赵雅宁,等.肺性脑病患者认知障碍临床分析[J].河北联合大学学报:医学版,2013,15(1):54-55.
[9] De Carolis A,Giubilei F,Caselli G,et al.Chronic obstructive pulmonary disease is associated with altered neuropsychological performance in young adults[J].Dement Geriatr Cogn Dis Extra,2011,1(1):402-408.
[10] Dodd JW,Jones PW.Cognitive function in COPD[J].Eur Respir J,2010,35(4):913-922.
[11] Kirkil G,Tug T,Ozel E,et al.The evaluation of cognitive functions with P300test for chronic obstructive pulmonary disease patients in attack and stable period[J].Clin Neurol Neurosurg,2007,109(7):553-560.
[12] Kryscio JR.Risk factors for transitions from normal to mild cognitive impairment and dementia[J].Neurology,2006,66(6):828-832.
[13] Goldstein PC.Drawing impairment predicts mortality in severe COPD-A naive approach to COPD mortality prediction[J].Chest,2007,132(4):1411.

