吗替麦考酚酯对SD大鼠抗肾小球基底膜肾炎模型的治疗效果
方 珣,刘昌璇,陈文莉
(武汉市中心医院肾内科 430014)
抗肾小球基底膜(glomerular basement membrane,GBM)相关疾病是由于机体对Ⅳ型胶原的耐受性失调,针对Ⅳ型胶原α3链的非胶原区产生自身抗体,进而引起呼吸系统和泌尿系统等相关器官出现病变的一系列自身免疫疾病[1-2]。GBM 肾炎就是由抗GBM 抗体引起的一类肾脏疾病,该病患者可在外周血中检测到大量的抗GBM 抗体,临床上表现为肾功能严重下降,几周内即可进展至肾功能衰竭,并伴有新月体出现。该病起病急促,病情发展迅速,预后差,没有较理想的治愈方法,病死率较高[3]。
吗替麦考酚酯(mycophenolate mofetil,MMF)是鸟嘌呤核苷酸经典合成途径中的重要限速酶-次黄嘌呤单核苷酸脱氢酶(IMPDH)的选择性抑制剂[4],其代谢产物霉酚酸(MPA)可抑制高度依赖经典合成途径增殖的T、B 淋巴细胞,而对鸟嘌呤核苷酸补救合成途径无影响[5-6]。因此MMF对其他细胞无抑制作用,无肝、肾毒性,不会引起骨质疏松、高血压等不良反应,骨髓抑制作用也大大弱于其他类非选择性免疫抑制剂。作为一种新型免疫抑制剂,MMF多被用于器官移植以及一些自身免疫疾病,如自身免疫性肝病、系统性红斑狼疮和自身免疫性胰腺炎等疾病的治疗[7-9],但在抗GBM 肾炎治疗上的研究报道较少。本文通过观察MMF 治疗组大鼠24h 蛋白尿排泄量、血肌酐、尿素氮、IL-1和TGF-β1等生化指标以及肾脏组织病理形态学变化的情况,研究MMF 对抗GBM 肾炎SD 大鼠模型的治疗作用。
1 材料与方法
1.1 动物及材料
1.1.1 实验动物 40只SD 大鼠,8周龄,体质量200g左右,雌雄各半,购自上海杰思捷实验动物有限公司[许可证号:SCXK(沪)2014-0006]。3只雄性新西兰大白兔,体质量2kg左右,购自上海杰思捷实验动物有限公司。所有动物严格饲养在CL级动物房内,自由进食、饮水,12h交替照明。
1.1.2 实验药物与试剂 注射用MMF购自重庆莱美药业有限公司(批准文号:国药准字H20059282),每瓶用10mL 生理盐水溶解,保存于-20 ℃冰箱内,用前稀释到所需浓度即可。大鼠血肌酐、尿素氮检测试剂盒购自南京建成生物研究所(批号:20130812);大鼠IL-1和TGF-β1ELISA 试 剂 盒 购 自 武 汉优尔生科技股份有限公司(批号:DZP-13611)。
1.1.3 实验仪器 AU5800型生化分析仪购自美国Beckman Coulter公司;Spectra Max M5多功能酶标仪购自美国Molecular Devices公司;GFM-600荧光倒置显微镜、ASP300S 组织脱水机、VT1200S全自动振动切片机购自德国Leica公司。
1.2 方法
1.2.1 可溶性GBM 抗原的制备 参照造模方法[9],用20%乌拉坦麻醉SD 大鼠后,正中切开腹部,无菌条件下游离双肾并剥离肾包膜,取肾皮质于冷无菌0.1 mol/L PBS溶液中涮洗。将清洗过的肾皮质剪碎并放到60目筛网上小心研磨并用冷PBS冲洗,弃去滞留物并收集滤液。依次将滤液经80目和200目筛网过滤,反复用PBS溶液冲洗,最终收集200目筛网上滞留物。取收集物于PBS溶液中重悬,超声40min,使肾小球完全破碎,即可得到可溶性GBM。双缩脲试剂法测量可溶性GBM 抗原溶液的总蛋白浓度,调整浓度为20mg/mL,-20℃保存,待用。
1.2.2 兔抗SD 大鼠GBM 抗体血清的制备 取制备好的GBM 抗原溶液0.5mL,加入等体积的完全弗氏佐剂,涡旋振荡器上充分乳化。取乳化后的乳浊液于新西兰兔背部进行多点皮下注射,首次免疫当天记为第0天。在免疫后第15天进行二次免疫。在免疫后第35 天,经耳缘静脉注射20 mg/mL SD 大鼠GBM 抗原溶液0.1mL,再一次加强免疫。7d后取血检测兔抗SD 大鼠GBM 抗体的效价,效价合适后即可从兔颈总动脉取血,收集兔血清并56 ℃灭活补体30min,-80 ℃保存,待用。
1.2.3 SD 大鼠抗GBM 肾炎模型的建立 实验分为空白对照组、模型对照组和MMF 治疗组,每组10只健康SD 大鼠。实验开始前,收集全部SD 大鼠的24h尿液,检测24h尿蛋白的总量,结果均无异常。取含5mg正常兔IgG 与等体积的完全弗氏佐剂充分乳化,于模型对照组和MMF治疗组SD 大鼠背部多点皮下注射乳浊液,进行预免疫。预免疫5d后,按5 mL/kg剂量的兔抗SD 大鼠GBM 抗体血清经尾静脉注射到模型对照组和MMF治疗组SD 大鼠体内,建立SD 大鼠抗GBM肾炎模型。建模1周后,MMF治疗组每天以500mg/kg剂量腹腔注射MMF 1.0mL,同时空白对照组和模型对照组每天腹腔注射生理盐水10mL。
1.2.4 血清及尿液生化指标的测定 分别于给药第0、1、2、3和4周收集实验动物血液和尿液样本。用20%乌拉坦麻醉动物,眼眶后静脉丛取血,收集血清分装于EP管中,-80℃冰箱内保存,待测。采用小鼠代谢笼收集各组动物24h尿液,低温保存。生化分析仪检测各组动物24h尿蛋白、血尿素氮和血肌酐的水平,ELISA 试剂盒检测各组动物外周血中IL-1 和TGF-β1的水平。
1.2.5 肾脏组织病理分析 经MMF 给药治疗4周后,各组动物脱颈椎处死,立即取出双侧肾脏,剥离肾包膜,固定于4%甲醛溶液中,48h后脱水、石蜡包埋,5μm 切片。石蜡切片进行HE染色和碘酸雪夫氏(PAS)染色。
1.3 统计学处理 采用SPSS19.0软件进行统计学分析。计量资料以±s表示,两组间比较采用t检验,多组的组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 治疗前后各组24h尿蛋白排泄量的比较 与空白对照组比较,在注射兔抗SD 大鼠GBM 抗体血清7d后,模型对照组和MMF治疗组动物的24h尿蛋白排泄量显著性升高(P<0.05),提示造模成功。而模型对照组和MMF 治疗组之间差异无统计学意义(P>0.05)。经MMF 治疗1 周,MMF 治疗组24h尿蛋白的排泄量就开始下降,提示肾功能开始得到改善;MMF治疗4周后,相较于同期的模型对照组,治疗组SD大鼠的24h尿蛋白的排泄量明显下降,见表1。
表1 不同治疗时间点各组24h尿蛋白的排泄量(±s,mg/d)

表1 不同治疗时间点各组24h尿蛋白的排泄量(±s,mg/d)
a:P<0.01,与空白对照组比较;b:P<0.05,c:P<0.01,与模型对照组比较。
组别 第0周 第1周 第2周 第3周 第4周空白对照组 7.31±1.06 8.25±1.13 7.54±1.07 7.03±1.26 6.87±0.98模型对照组 78.62±9.35a 96.33±12.74a 109.76±17.43a 113.86±20.55a 127.63±24.48a MMF治疗组 80.33±11.53 85.54±12.67b 72.62±8.51c 58.83±5.29c 51.73±6.37 c
表2 不同治疗时间点各组血肌酐水平比较(±s,μmol/L)
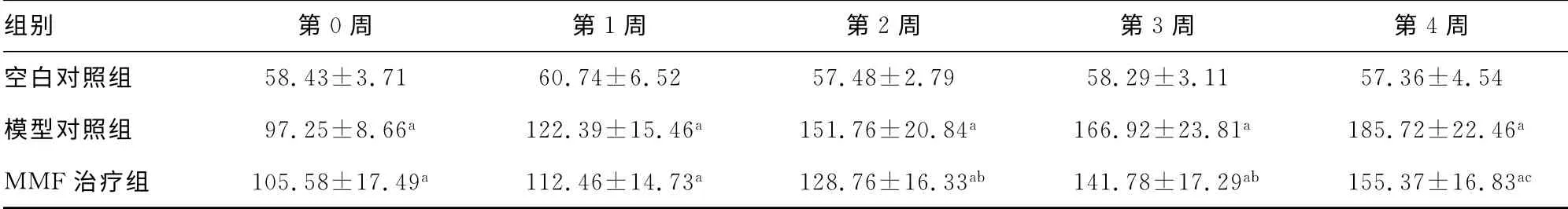
表2 不同治疗时间点各组血肌酐水平比较(±s,μmol/L)
a:P<0.01,与空白对照组比较;b:P<0.05,c:P<0.01,与模型对照组比较。
组别 第0周 第1周 第2周 第3周 第4周空白对照组 58.43±3.71 60.74±6.52 57.48±2.79 58.29±3.11 57.36±4.54模型对照组 97.25±8.66a 122.39±15.46a 151.76±20.84a 166.92±23.81a 185.72±22.46a MMF治疗组 105.58±17.49a 112.46±14.73a 128.76±16.33ab 141.78±17.29ab 155.37±16.83 ac
表3 不同治疗时间点各组血尿素氮水平比较(±s,mmol/L)

表3 不同治疗时间点各组血尿素氮水平比较(±s,mmol/L)
a:P<0.01,与空白对照组比较;b:P<0.05,c:P<0.01,与模型对照组比较。
组别 第0周 第1周 第2周 第3周 第4周空白对照组 8.63±0.72 8.04±0.83 7.29±0.54 6.89±0.67 6.9 1±0.71模型对照组 12.57±3.68a 12.39±2.86a 13.10±3.51a 12.95±3.06a 13.48±3.04a MMF组 12.26±3.37 11.75±2.86 11.36±2.84ab 10.78±2.51ab 9.48±1.65 ac
2.2 治疗前后各组血肌酐、尿素氮的比较 在造摸前,各组动物外周血中血肌酐、尿素氮的水平差异无统计学意义(P>0.05)。注射兔抗SD 大鼠GBM 抗体后1周,相较于空白对照组,模型对照组和MMF治疗组动物的血肌酐、尿素氮的水平显著升高(P<0.05)。随着MMF 腹腔注射治疗后,外周血中血肌酐、尿素氮的水平相较同期模型对照组开始下降,提示肾脏的损伤程度开始得到缓解;经过4 周的治疗后,MMF 治疗组SD 大鼠的血肌酐、尿素氮显著下降,与同期模型对照组比较差异有统计学意义(P<0.05),较空白对照组有轻度增加。见表2、3。
2.3 治疗前后各组动物外周血中IL-1及TGF-β1的比较 本研究采用ELISA 试剂盒测定各组动物外周血中IL-1和TGFβ1的水平。结果表明,注射兔抗SD 大鼠GBM 抗体血清1周之后,模型对照组和MMF治疗组动物IL-1和TGF-β1的水平均较空白对照组有显著性的上升(P<0.05),模型对照组和MMF治疗组之间差异无统计学意义(P>0.05)。MMF 治疗4周后,MMF治疗组动物外周血中IL-1和TGF-β1的水平均显著性低于模型对照组。见表4。
表4 治疗前后各组动物外周血中IL-1和TGF-β1 水平比较(±s,ng/mL)

表4 治疗前后各组动物外周血中IL-1和TGF-β1 水平比较(±s,ng/mL)
a:P<0.01,与空白对照组比较;b:P<0.01,与模型对照组比较。
组别IL-1第0周 第4周TGF-β 1第0周 第4周空白对照组0.37±0.025 0.35±0.039 4.18±1.06 4.77±1.35模型对照组 4.68±0.27a 5.29±0.48a 7.81±1.66a 9.52±2.13a MMF治疗组 4.81±0.35a 3.13±0.17ab 7.92±1.58a 5.36±1.48 ab
2.4 肾脏组织石蜡切片HE 染色和PAS染色显微镜观察 HE和PAS染色表明,模型对照组肾小球系膜细胞增生,形态破坏严重;有大量炎性细胞浸润到肾小球内以及周围间质区;肾小球有新月体形成。经过MMF治疗后,造摸动物肾小球的整体病理变化得到改善,肾小球及其周围间质区炎性细胞浸润减少;肾小球和肾小管的变性得到改善;新月体数量明显下降。见图1。
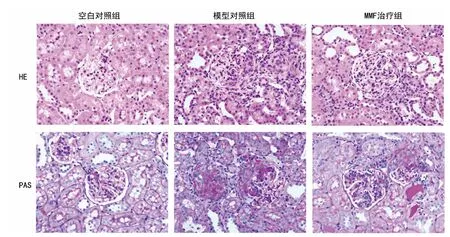
图1 各组动物肾组织HE和PAS染色结果(×400)
3 讨 论
人类新月体肾病和Goodpasture综合征等皆属于抗GBM相关疾病[10],该病是由于机体对Ⅳ型胶原α3链的非胶原区耐受性失调,产生自身抗体,而造成多器官损伤的一类自身免疫疾病,多见于男性[11-12]。常累及肾脏,即为新月体肾小球肾炎,临床表现为血尿、蛋白尿,患者肾功能下降迅速,如不及时治疗,几周内即可进展至肾衰竭。目前该病的治疗手段主要包括血浆置换以及糖皮质类激素联合免疫抑制剂等强化治疗。
本研究参考Bhan等造模方法,先使用正常兔IgG 联合完全弗氏佐剂对造模SD 大鼠进行预免疫,5d后经尾静脉注射兔抗SD 大鼠GBM 抗体血清,1周后发现造模大鼠24h尿蛋白以及外周血尿素氮和血肌酐明显著性高于空白对照组大鼠,并维持在较高水平,与免疫相关的细胞因子如IL-1和TGF-β1也明显提高,提示成功建立SD 大鼠抗GBM 肾炎模型。
MMF是一种新型免疫抑制剂,口服吸收完全,利用度高,在体内可迅速分解为活性成分MPA。MMF耐受性好,无肝、肾毒性,不会引起骨质疏松、高血压等不良反应,骨髓抑制作用也大大弱于其他类非选择性免疫抑制剂。目前,MMF在器官移植、自身免疫疾病等疾病的治疗上应用较多[13-14]。
本研究使用MMF治疗抗GBM 肾炎SD 大鼠1周后,24h尿蛋白的排泄量就开始下降,指示肾功能开始得到改善;治疗4周后,相较于同期的模型对照组,治疗组SD 大鼠的24h尿蛋白的排泄量显著性下降,外周血尿素氮、血肌酐以及与免疫相关的细胞因子IL-1和TGF-β1的水平也远远低于模型对照组。经过MMF治疗后,抗GBM 肾炎大鼠的肾小球及其周围间质区炎性细胞浸润减少,新月体数量明显下降,提示肾小球的整体病理变化得到改善。
综上所述,本研究通过对肾功能和免疫等相关指标的考察,证明了MMF治疗SD 大鼠抗GBM 肾炎疾病的疗效确切,为其在临床上治疗人类相关疾病的应用提供了实验依据。
[1] Iyoda M,Shibata T,Wada Y,et al.Long-and short-term treatment with imatinib attenuates the development of chronic kidney disease in experimental anti-glomerular basement membrane nephritis[J].Nephrol Dial Transplant,2013,28(3):576-584.
[2] Saegusa Y,Sadakane C,Koseki J,et al.TJN-331improves anti-glomerular basement membrane nephritis by inhibiting the production of intraglomerular transforming growth factor-beta1[J].Biol Pharm Bull,2010,33(8):1349-1354.
[3] Olaru F,Wang XP,Luo W,et al.Proteolysis breaks tolerance toward intactα345(IV)collagen,eliciting novel antiglomerular basement membrane autoantibodies specific forα345NC1 hexamers[J].J Immunol,2013,190(4):1424-1432.
[4] Li J,Kelly R.Treatment of pyoderma gangrenosum with mycophenolate mofetil as a steroid-sparing agent[J].J Am Acad Dermatol,2013,69(4):565-569.
[5] Lv W,Zhang Y,Guan G,et al.Mycophenolate mofetil and valsartan inhibit podocyte apoptosis in streptozotocin-induced diabetic rats[J].Pharmacology,2013,92(3/4):227-234.
[5] Zimmerman AB,Berger EM,Elmariah SB,et al.The use of mycophenolate mofetil for the treatment of autoimmune and chronic idiopathic urticaria:experience in 19patients[J].J Am Acad Dermatol,2012,66(5):767-770.
[6] Derniame S,Lee F,Domogala A,et al.Unique effects of mycophenolate mofetil on cord blood T cells:implications for GVHD prophylaxis[J].Transplantation,2014,97(8):870-878.
[8] Park SJ,Kim JH,Shin JI.The influence of age on the clinical features and outcomes of anti-glomerular basement membrane disease[J].Am J Kidney Dis,2011,58(4):678.
[9] Cui Z,Zhao J,Jia XY,et al.Anti-glomerular basement membrane disease:outcomes of different therapeutic regimens in a large single-center Chinese cohort study[J].Medicine(Baltimore),2011,90(5):303-311.
[10] Krishnan MR,Wang C,Marion TN.Anti-DNA autoantibodies initiate experimental lupus nephritis by binding directly to the glomerular basement membrane in mice[J].Kidney Int,2012,82(2):184-192.
[11] Faulhaber M,Mäding I,Malehsa D,et al.Steroid withdrawal and reduction of cyclosporine A under mycophenolate mofetil after heart transplantation[J].Int Immunopharmacol,2013,15(4):712-717.
[12] Chaigne B,Gatault P,Darrouzain F,et al.Mycophenolate mofetil in patients with anti-neutrophil cytoplasmic antibody-associated vasculitis:aprospective pharmacokinetics and clinical study[J].Clin Exp Immunol,2014,176(2):172-179.

