脓毒症患儿早期皮质醇及促肾上腺皮质激素水平变化分析*
舒艳婷,许 峰,祝益民,刘成军△
(1.重庆医科大学附属儿童医院重症医学科 400014;2.湖南省人民医院重症医学科,长沙410007)
脓毒症(sepsis)是感染因素引起的全身炎性反应,严重时可导致器官功能障碍和(或)循环衰竭,也是诱发脓毒性休克、多器官功能障碍综合征的重要原因。脓毒症来势凶猛,病情进展迅速,病死率高。糖皮质激素是维系生命的重要活性介质和机体应激反应的基本组成部分。严重的感染可激活机体产生应激反应,出现下丘脑-垂体-肾上腺(HPA)轴的激活,从而使糖皮质激素水平显著增高,因其具有重要的抗炎和免疫抑制作用,可限制早期炎症细胞的普遍激活,阻断炎症的“瀑布样”连锁反应[1]。在这种炎性介质导致的级联放大应激反应中,糖皮质激素能有效减少机体自身组织的损伤,使机体对应激耐受性显著增强,作为一种保护性反应,体内糖皮质激素的升高为维持生命发挥了重要的作用,也为脓毒症的最终控制提供了宝贵机会。目前对于成人脓毒症HPA 轴研究较多,但对儿童脓毒症和严重脓毒症肾上腺皮质功能状态的研究相对较少。本研究旨在观察脓毒症和严重脓毒症患儿早期血清皮质醇、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)的变化及其对预后的影响,以便进一步探寻小儿脓毒症时肾上腺皮质功能状态。
1 资料与方法
1.1 一般资料 收集2013年2~8月重庆医科大学附属儿童医院重症医学科40例脓毒症患儿资料,根据2005年国际脓毒症会议标准[2]将脓毒症患儿分为脓毒症组和严重脓毒症组。脓毒症组21例,男10例,女11例,基础疾病为肺炎12例,中枢神经系统感染3例,消化道感染5例,软组织感染1例;年龄最大的60个月,最小的1个月,中位年龄14.0(4.0~48.0)个月;体质量12.0(8.0~16.0)kg。严重脓毒症组19 例,男11例,女8例,基础疾病为肺炎11例,消化道感染3例,软组织感染2例,中枢神经系统感染2例,其他部位感染1例;心肌损害占52.6%,神经系统损害占42.1%,肾脏损害占42.1%,肝脏损害占36.8%,肺部损害占36.8%,血液系统损害占36.8%,胃肠道损害占5%;年龄最大的96个月,最小的2个月,中位年龄16.0(4.0~53.0)个月,体质量11.0(6.0~15.0)kg。另选取同期门诊体检儿童20例,其中男7例,女13例,年龄最大的48个月,最小的3个月,中位年龄36.0(18.0~42.0)个月,体质量14.8(10.5~16)kg。3组患儿年龄、性别构成、体质量差异均无统计学意义(P>0.05)。
1.2 排除标准 (1)致命的先天性疾病;(2)原发性肾上腺皮质增生;(3)原发性肾上腺功能不全;(4)有系统性长时间使用皮质激素治疗史;(5)经历重大手术或创伤患者;(6)重度围生期窒息史。
1.3 检测指标及方法 在脓毒症或脓毒性休克患儿入PICU后24h内,于血液制品(血浆、清蛋白、浓缩红细胞等)、糖皮质激素使用前取静脉血3 mL,3 000r/min离心10 min分离血清,-80 ℃保存,测定血清皮质醇、ACTH。对照组儿童统一在上午8:00~9:00进行血液采集,送核医学科检测。一般资料收集:患儿的基本情况包括年龄、性别、体质量、入PICU 时基础疾病、入PICU 时PCIS、记录MODS出现时间、累及系统或脏器数目、病情转归。记录病原学检查资料;患儿住PICU时间;血液检测包括降钙素原(PCT),白细胞计数(WBC),C 反应蛋白(CRP),乳酸(LAC),血糖(GLU),血小板计数(PLT),肌酐(Cr),尿素氮(BUN),活化部分凝血酶时间(APTT),国际标准化比值(INR)。
1.4 统计学处理 采用SPSS17.0软件对数据进行统计学分析,计量资料以±s表示,组间比较采用秩和检验,相关分析采用线性相关分析,如资料服从正态分布则行Pearson相关性分析,若不服从正态分布则行Spearman′s相关性分析,以P<0.05为差异有统计学意义。以预后的好坏为标准,用受试者工作特征(ROC)曲线评价危重评分、CRP、PCT、皮质醇(COR)、ACTH 是否为脓毒症患儿预后影响因素,若面积小于0.5则不能成为其预后影响因素,P<0.05为差异有统计学意义。
2 结 果
2.1 3组患儿血清皮质醇、ACTH 水平变化 严重脓毒症患儿血清皮质醇、ACTH 水平均高于脓毒组和对照组,并且脓毒症组高于对照组,差异具有统计学意义(P<0.05),见表1。
表1 3组患儿血清皮质醇及ACTH 水平比较(±s)

表1 3组患儿血清皮质醇及ACTH 水平比较(±s)
a:P<0.05,与脓毒症组比较;b:P<0.05,与对照组比较。
组别 n 皮质醇(nmol/L) ACTH(pg/mL)严重脓毒症组 19 1 144.32±1 059.00ab 76.66±59.82 ab脓毒症组 21 838.86±332.56b 40.09±24.75b对照组20 334.95±170.19 12.62±4.92
2.2 严重脓毒症组与脓毒症组观察指标比较 脓毒症组与严重脓毒症组患儿皮质醇、LAC、ACTH、危重评分、PCT、CRP、INR、PLT、BUN 差异均有统计学意义(P<0.05),Cr、APTT、WBC、GLU 差异均无统计学意义(P>0.05),见表2。
表2 脓毒症组与严重脓毒症组观察指标比较(±s)

表2 脓毒症组与严重脓毒症组观察指标比较(±s)
项目 脓毒症组 严重脓毒症组Z P COR(nmol/L) 838.86±332.56 1 144.32±1 059.00 2.130 0 0.033 3 ACTH(pg/mL)40.09±24.75 76.66±59.82 2.302 4 0.021 3 LAC(μmol/L) 1.61±1.28 6.32±4.75 3.130 0 0.001 7 GLU(mmol/L) 6.34±3.52 6.36±3.12 0.530 0 5.600 0 WBC(×109/L) 15.91±14.58 20.45±24.13 0.560 0 0.580 0 CRP(mg/L) 19.43±14.21 56.84±57.54 2.104 1 0.035 4 PCT(ng/mL) 4.33±4.98 12.13±10.69 1.979 4 0.047 8 INR 1.42±0.64 1.76±1.04 2.059 5 0.039 4 APTT(s) 49.58±45.96 58.42±30.97 1.950 0 0.051 2 PLT(×109/L)317.95±244.87 168.77±164.90 -2.440 0 0.014 8 BUN(μmol/L) 4.76±3.46 24.03±67.30 2.004 0 0.045 0 Cr(μmol/L) 44.89±43.00 121.04±156.10 1.801 2 0.071 7住院时间(d) 9.71±5.98 9.37±7.25 -0.488 9 0.624 9危重评分(分) 76.38±2.94 69.05±5.86 -3.910 0 <0.01
2.3 按预后分组,脓毒症死亡组与存活组患者观察指标比较 脓毒症死亡组与存活组患儿皮质醇、ACTH、危重评分、LAC比较差异有统计学意义(P<0.05),INR、PLT、BUN、Cr、APTT、CRP、PCT、WBC、GLU 差异均无统计学意义(P>0.05)。
2.4 脓毒症患儿皮质醇、ACTH 与CRP、PCT、WBC、LAC、危重评分的相关性分析 皮质醇水平与ACTH、LAC 呈正相关(r=0.445、0.406,P<0.05),与 危 重 评 分 呈 负 相 关(r=-0.339,P<0.05),与CRP、PCT、WBC 无线性相关性(P>0.05)。ACTH 与 皮 质 醇、LAC、CRP 呈 正 相 关(r=0.445、0.560、0.324,P<0.05),与 危 重 评 分 呈 负 相 关(r=-0.332,P<0.05),与PCT、WBC无线性相关性(P>0.05)。
2.5 脓毒症患儿预后影响因素的ROC 曲线分析 皮质醇曲线下面积0.792,当COR=1 021nmol/L 时,其判断预后敏感性为90.9%,特异性为62.1%;ACTH 曲线下面积0.881,当ACTH=71.3pg/L 时,其判断预后敏感性为81.8%,特异性为86.2%;危重评分曲线下面积为0.787,危重症评分为73分时,其判断预后敏感性为65.5%,特异性为100%。乳酸ROC曲线下面积为0.922,LAC=4.4mmol/L 时,其判断预后敏感性为90.9%,特异性为93.1%。以上数据均有统计学意义(P<0.05)。CRP的ROC曲线下面积为0.603,但其并无统计学意义(P>0.05)。PCT 的ROC曲线下面积小于0.5,且无统计学意义(P>0.05),见表3。
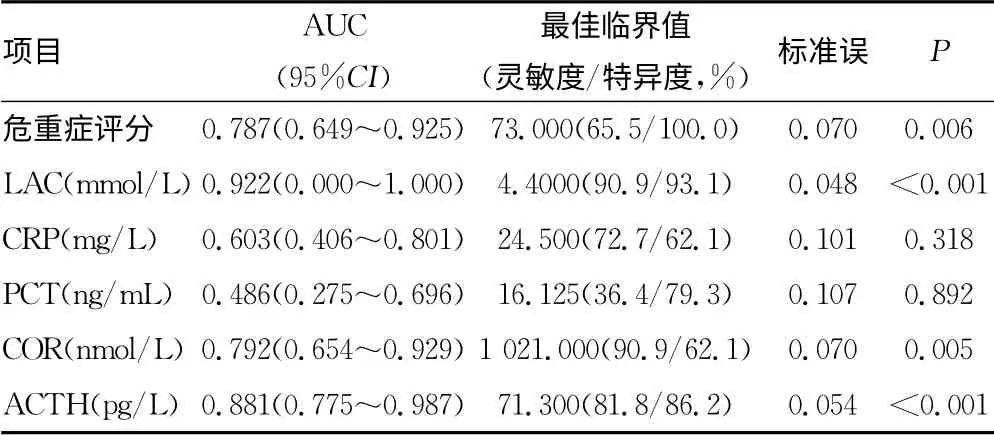
表3 ROC分析结果
3 讨 论
在美国每年多达800 000例重症感染患者入住重症监护病房(ICU),其中与致死相关的脓毒症和感染性休克达50%~70%,也是ICU 患者主要的死亡原因[3]。本研究结果显示:患儿脓毒症早期存在皮质醇、ACTH 水平明显升高,与其他国内外学者研究结果一致[4-5]。脓毒症皮质醇水平升高主要是因为严重感染时循环中细胞因子水平显著升高,细胞因子刺激HPA 轴引起ACTH 分泌增加或直接刺激肾上腺皮质最终导致皮质醇水平显著升高[6-7]。另外,炎性细胞因子还通过改变外周皮质醇代谢水平从而使组织皮质醇水平增加[8]。本研究还发现,严重脓毒症组患儿较脓毒症组患儿皮质醇明显升高,也有国外学者印证了这一点[9],这说明血清皮质醇与病情严重程度密切相关。ACTH 是维持肾上腺正常形态和功能的重要激素。糖皮质激素对下丘脑及垂体前叶起负反馈调节作用,抑制促肾上腺皮质激素释放激素及ACTH 的分泌。在生理情况下,下丘脑、垂体和肾上腺三者处于相对的动态平衡中,ACTH具有控制本身释放的短反馈调节作用。本研究发现,脓毒症、严重脓毒症患儿在发病早期,血清ACTH 浓度较对照组明显增加,说明脓毒症、严重脓毒症机体存在大量的炎症介质释放,激活机体免疫系统,引起炎性反应,对机体神经内分泌系统也是一种持续的强烈刺激,通过应激反应,激活HPA 轴,从而引起ACTH 血液浓度的增加。
同时本研究还发现了严重脓毒症患儿导致多功能脏器损害,促凝活性增加纤维系统抑制,凝血系统过度激活最终引起凝血因子消耗和出血倾向,即发生弥散性血管内凝血(DIC)[10-11]。
通过相关性分析得出,皮质醇水平与ACTH、LAC 呈正相关,与危重评分呈负相关;ACTH 与皮质醇、LAC、CRP 正相关,与危重评分呈负相关;这也证实了严重感染患儿产生应激反应时会导致糖皮质激素释放增加从而使脓毒症在早期得到一定的控制。乳酸作为判断脓毒症患者预后的有效指标已被证实[12],同时,通过ROC 曲线评估,可以看出乳酸、皮质醇、ACTH 对判断脓毒症患儿预后具有较好的敏感性和特异性。
本研究表明,脓毒症患儿早期皮质醇、ACTH 升高越明显患儿预后越差。早期监测脓毒症患儿血清皮质醇、ACTH 可达到早期干预、改善患儿预后的效果。近年有学者关于脓毒症患儿皮质醇水平研究结果与之相反,认为脓毒症休克患者存在相对或绝对肾上腺功能不全,在这些患者中病死者血清皮质醇水平低于存活者[13],本试验因存在样本量小且未进行动态监测的关系尚未发现此现象。因此需进一步对脓毒症患儿进行大样本量动态追踪及肾上腺功能不全的相关研究。
[1] Lehrke M,Broedl UC,Biller-Friedmann IM,et al.Serum concentrations of cortisol,interleukin 6,leptin and adiponectin predict stress induced insulin resistance in acute inflammatory reactions[J].Crit Care,2008,12(6):R157.
[2] Goldstein B,Giroir B,Randolph A,et al.International pediatric sepsis consensus conference:definitions for sepsis and organ dysfunction in pediatrics[J].Pediatr Crit Care Med,2005,6(1):2-8.
[3] Kumar A.Optimizing antimicrobial therapy in sepsis and septic shock[J].Crit Care Clin,2009,25(4):733-751.
[4] Imura H,Fukata J.Endocrine-paracrine interaction in communication between the immune and endocrine systems.Activation of the hypothalamic pituitary adrenalax is in inflammation[J].Eur J Endocrinol,1994,130(1):32-37.
[5] 边毓尧,寿松涛.脓毒症患者早期血浆皮质醇水平变化及其临床意义研究[J].中国全科医学,2013,16(9):1026-1029.
[6] Chrousos GP.The hypothalamic-pituitary-adrenal axis and immune-mediated inflammation[J].N Engl J Med,1995,332(20):1351-1362.
[7] Su JR,Zhang Z,Sun DX,et al.Correlation between nuclear transcription factor(NF-B)and cytokines at 4hs or 18hs in mice with sepsis[J].China Mod Med,2005,15(15):2260-2263.
[8] Franchimont D,Martens H,Hagelstein MT,et al.Tumor necrosis factor alpha decreases,and interleukin-10increases,the sensitivity of human monocytes to dexamethasone:potential reulation lf the glucocorticoid receptor[J].J Clin Endocrinol Metab,1999,84(8):2834-2839.
[9] Ho JT,AT-Musalhi H,Chapman MJ,et al.Septic shock and sepsis:a comparison of total and free plasma cortisol levels[J].J Clin Endocrinol Metab,2006,91(1):105-114.
[10] Levi M,Schultz M.The inflammation coagulation axis as an important intermediate pathway in acute lung injury[J].Crit Care,2008,12(2):144.
[11] Lissalde-Lavigne G,Combescure C,Muller L,et al.Simple coagulation tests improve survival prediction in patients with septic shock[J].J Thromb Haemost,2008,6(4):645-653.
[12] Okorie ON,Dellinger P.Lactate:biomarker and potential therapeutic target[J].Crit Care Clin,2011,27(2):299-326.
[13] Schroeder S,Wichers M,Klingmüller D,et al.The hypothalamic-pituitary-adrenal axis of patients with severe sepsis:altered response to corticotrophin-releasing hormone[J]Care Med,2001,29(2):310-316.

