慢性社会应激模型的构建及其对雄鼠生殖健康影响的研究
姚基伟,张全超,王秀娟,李前伟,付卫华,谌小维,鄢俊安,李为兵△
(1.第三军医大学西南医院全军泌尿外科研究所,重庆400038;2.第三军医大学脑研究中心,重庆400038)
男性的生殖健康呈逐年下降趋势,男性不育症的发生率逐年增高[1];近50年来全球男性的精子密度下降了40%,精液量下降了19%[2]。一项针对重庆3 000多名健康男性的精液质量调查研究发现,近61.1%的健康男性的精液质量参数中有一项指标存在异常[3],且与环境、心理健康(社会压力)、生活饮食习惯等相关[4]。对男性生殖健康损害的众多因素中,慢性社会应激(压力)对男性生殖健康影响的研究仍屈指可数。因此,本研究通过构建慢性社会应激模型模拟社会压力状态,评估其对雄性小鼠生殖健康的影响。
1 材料与方法
1.1 实验动物 8~9周龄清洁级雄性(SPF 级)C57BL/6 小鼠和3~4月龄雄性FVB/N 小鼠均购自第三军医大学大坪医院动物中心;保证充足饮食饮水,室温(22±1)℃,日光灯照明7:00~19:00,应激时间为18:00~20:00,行为学评价时间为14:00~17:30。
1.2 药品与试剂 0.1 M PBS溶液、0.1%戊巴比妥钠、多聚甲醛(Sigma)。
1.3 实验方法
1.3.1 慢性社会挫败应激模型 慢性社会挫败应激模型的构建方法按照文献[5-6]。16只成年雄性FVB/N 小鼠(体质量大于40g)被用于作为“攻击鼠”;将25只C57BL/6小鼠分为应激组(15只)和对照组(10 只),每天相同时段内将应激组C57BL/6小鼠作为“入侵者”放入单独饲养的FVB/N 小鼠的笼内,进行身体接触10 min。10 min后使用透明有孔的有机玻璃板(自制)将2只小鼠隔开进行心理应激24h。第2天将C57BL/6小鼠放入另一只FVB/N 小鼠所在的大号鼠笼,依次循环,使应激持续25d。应激20d后,即可对C57BL/6小鼠进行行为学评价。对照组则使用相同的鼠笼饲养,2 只对照组C57BL/6小鼠成对隔开。
1.3.2 社会交互作用实验 社会交互作用的实验设计按照文献[6]报道进行。社会交互实验分为两个阶段,每个阶段2.5 min。实验在42cm×42cm×42cm(长×宽×高)旷场装置内进行,并设定交互作用区域和远端的两个角落区域,在交互区域内放置一个10cm×6cm×10cm(长×宽×高)的铁笼(自制)。第一阶段将C57BL/6小鼠随机放置在旷场装置的正中央,面对交互区域内的小笼子(笼内不放置FVB/N 小鼠),记录C57BL/6小鼠在装置内的运动情况,记录并分析交互作用区域停留时间、角落内停留时间和运动轨迹。第二阶段,操作同第一阶段,但在交互区域内的小笼子内放置1只FVB/N 小鼠。录制的视频采用自制软件进行分析。
1.3.3 体质量和生殖腺质量的称量 每5天对应激组和对照组C57BL/6小鼠进行体质量称量和记录。经过25d的应激训练后,分离睾丸、附睾和附睾尾,用高精度天平称量并记录。
1.3.4 制备精子悬液和精子计数 利用C57BL/6小鼠的附睾尾内的精子来制备精子悬液。通过运用血细胞计数板(精益公司)在光学显微镜下进行精子计数。按照细胞计数板的操作进行计数。精子计数的计算依照之前的文献进行计算[7]。精子数目=计数板五个格子内精子数目×50 000×100(细胞数目/mL)。
1.4 统计学处理 采用SPSS13.0进行统计处理,计量资料以±s表示,采用t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 慢性社会应激模型影响小鼠社会交互作用 在社会交互作用的第一阶段,对照组和应激组小鼠在交互作用区域和角落的停留时间差异无统计学意义(P>0.05)(图1B和1C),且两组小鼠的运动轨迹相似(图1A),说明两组小鼠的运动能力无明显差别。在社会交互作用第二阶段,在交互作用区域的小铁笼内放置了FVB/N 小鼠,应激组C57BL/6小鼠在交互作用的区域停留时间明显减少(P<0.01),而在远端的两个角落区域停留时间显著增长(P<0.01)(图1B和1C),提示应激组小鼠表现出明显的社会逃避抑郁行为。同时,在实验过程中可以清楚地发现应激组C57BL/6小鼠在发现FVB/N 小鼠后,表现出明显的恐惧反应并迅速逃离至远端角落;而对照组C57BL/6小鼠则表现为频繁且主动地接触FVB/N 小鼠(图1A)。
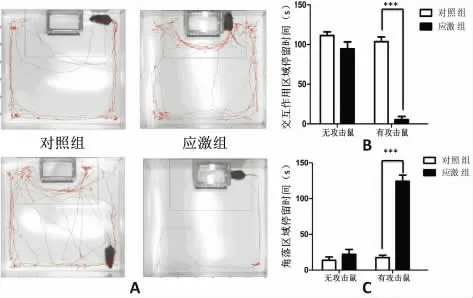
图1 社会交互作用行为学实验
2.2 慢性社会应激影响体质量和生殖腺的质量 通过应激前后体质量的对比,发现应激组(n=10)和对照组(n=10)在训练前体质量差异无统计学意义(P>0.05)(图2A);而经过25d的慢性社会应激后,应激组平均体质量明显减轻。慢性应激也可以使小鼠睾丸和附睾的脏器系数下降,提示应激组小鼠睾丸的质量、附睾的质量下降(表1)。
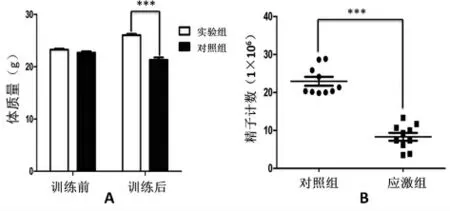
图2 慢性社会应激影响体质量和精子计数的影响
表1 体质量和生殖腺重量及脏器系数变化(±s)

表1 体质量和生殖腺重量及脏器系数变化(±s)
参数 对照组(n=10) 应激组(n=10)P训练后体质量(g)25.680±0.198 21.320±0.596 0.000睾丸质量(g) 0.193±0.002 0.135±0.008 0.000附睾质量(g) 0.050±0.001 0.034±0.002 0.001睾丸/体质量(mg/g) 7.500±0.082 6.295±0.286 0.001附睾/体质量(mg/g)1.950±0.072 2.566±0.069 0.004
2.4 慢性社会应激对精子计数的影响 经过25d的慢性社会应激后,对应激组和对照组小鼠进行了精子数目的评估。统计后,发现大部分的对照组小鼠精子数目均明显高于应激组(P<0.01)(图2B),对照组小鼠精子数目的平均值为(22.95±1.15)×106个/mL,而应激组小鼠精子数目的平均值为(8.32±1.03)×106个/mL,提示慢性应激对附睾尾内精子数目的影响明显。
3 讨 论
慢性社会应激被公认为抑郁症的重要发生原因之一[8],但其与生殖功能的关系仍不明朗。目前,慢性应激的研究主要集中在中枢神经系统[9],然而对外周靶器官的研究相对较少;存在研究报道的有慢性应激对肠易激综合征的研究[10],以及慢性应激对女性生殖系统损伤的研究[11]等。在慢性应激对于男性生殖功能损伤的报道也并不多,且存在一定的争议,有些报道提示慢性应激可损害雄性生殖健康[12]:主要表现在精子数目减少、畸形率上升、精子活力降低,雄激素分泌减少,性欲减退等现象上[13];而有些研究则表示慢性应激对雄性生殖没有影响,选择科学可靠的慢性应激模型成为了明确该科学问题的关键。因此,慢性社会挫败应激模型是认可度高的慢性应激模型,成为了我们最佳的选择。通过社会交互行为学实验和体质量变化的评估,均表明本研究成功构建了慢性社会挫败应激模型。
本课题组采用慢性社会挫败应激模型来研究慢性应激对雄性生殖功能的损害,强度相对其他常见的慢性应激模型高。因此,所带来的影响可能会更加明显:对比两组的体质量可见,应激组小鼠体质量增加缓慢甚至呈负增长;通过行为学实验发现,应激组小鼠的焦虑状态处于较高水平,社会逃避行为十分明显;在对生殖健康的影响上则表现在附睾尾精子数目的下降,且生殖腺出现了明显萎缩等。研究结果与上述应激损伤雄性生殖功能的报道相一致,为慢性社会应激损伤雄性生殖功能提供了有力证据。
目前,越来越多的研究发现,心境障碍乃至抑郁症均可对男性生殖健康带来不利影响[14]。同时,有报道提示不孕不育夫妇处于高度的焦虑和应激状态[15],更加不利于病情的治疗,甚至进入到应激-生殖功能损伤-不育-应激的恶性循环中。因此,对慢性应激与生殖功能关系的研究也同样可以指导临床中不育症的治疗。
综上所述,慢性应激在引发心境障碍、乃至抑郁症的同时,也会对雄性生殖系统产生不良影响。慢性社会挫败应激模型为研究慢性应激对中枢和外周靶器官的影响提供了可靠的模型构建方法,为进一步深入研究慢性应激对生殖系统损伤的机制提供了有利支持。下一步将对应激引发雄性生殖功能损伤的机制进行研究,寻找相应的药物治疗靶点和干预措施。
[1] 李宏军.加强对男性不育的认识及诊治规范化[J].中华泌尿外科杂志,2013,34(6):406-409.
[2] Nordkap L,Joensen UN,Blomberg M,et al.Regional differences and temporal trends in male reproductive health disorders:Semen quality may be a sensitive marker of environmental exposures[J].Mol Cell Endocrinol,2012,355(2):221-230.
[3] Li YF,Lin H,Ma MF,et al.Semen quality of 1 346 healthy men,results from the Chongqing area of southwest China[J].Human Reproduction,2009,24(2):459-469.
[4] Li Y,Li YF,Zhou N,et al.Socio-psycho-behavioural factors associated with male semen quality in China:results from 1 346healthy men in Chongqing[J].J Fam Plann Reprod Health Care,2013,39(2):102-110.
[5] Wang XD,Su YA,Wagner KV,et al.Nectin-3links CRHR1 signaling to stress-induced memory deficits and spine loss[J].Nat Neurosci,2013,16(6):706-715.
[6] Golden SA,Covington HE,Berton D,et al.A standardized protocol for repeated social defeat stress in mice[J].Nat Protoc,2011,6(8):1183-1191.
[7] Parhizkar S,Yusoff MJ,Dollah MA.Effect of phaleria macrocarpa on sperm characteristics in adult rats[J].Adv Pharm Bull,2013,3(2):345-352.
[8] Berton O,Colleen A.Essential role of BDNF in the mesolimbic dopamine pathway in social defeat stress[J].Science,2006,311(5762):864-868.
[9] Vaishnav K,Eric J,Nestler I.The molecular neurobiology of depression[J].Nat Rev,2008,455(7215):894-902.
[10] Xu D,Gao J,Gillilland M,et al.Rifaximin alters intestinal bacteria and prevents stress-induced gut inflammation and visceral hyperalgesia in rats[J].Gastroenterology,2014,146(2):484-496.
[11] Hamilton LD,Meston CM.Chronic stress and sexual function in women[J].J Sex Med,2013,10(10):2443-2454.
[12] Hardy MP,Gao HB,Dong Q,et al.Stress hormone and male reproductive function[J].Cell Tissue Res,2005,322(1):147-153.
[13] Jóžków P,Medraš M.Psychological stress and the function of male gonads[J].Endokrynol Pol,2012,63(1):44-49.
[14] Kocetak P,Chudek J,Naworska B,et al.Psychological disturbances and quality of life in obese and infertile women and men[J].Int J Endocrinol,2012:236217.
[15] Gürhan N,Akyüz A,Atici D,et al.Association of depression and anxiety with oocyte and sperm numbers and pregnancy outcomes during in vitro fertilization treatment[J].Psychol Rep,2009,104(3):796-806.

