DNA 甲基转移酶在宫颈癌组织中的表达及其与HPV 的相关性分析*
黄团明,王 婉,闫晓欢,郑英如
(第三军医大学大坪医院野战外科研究所妇产科,重庆400042)
宫颈癌是女性生殖系统最常见的恶性肿瘤,每年新增患者数约500 000人,新增死亡人数超过270 000例[1]。高危型人乳头瘤病毒(high risk human papilloma viruses,HR-HPV)的持续感染被证实是宫颈癌病因学最重要的危险因素,但其引起宫颈癌变的分子生物学机制尚不十分清楚。近年来,越来越多的研究表明表观遗传学的异常也参与了宫颈癌的发生、发展,特别是DNA 甲基化在宫颈癌的发生、发展中起着重要的作用。DNA 甲基化是在DNA 甲基转移酶(DNA methyltransferase,DNMT)的催化下,使甲基基团共价结合到胞嘧啶5′端碳原子上形成5-甲基胞嘧啶的过程,是真核生物DNA 最普通的一种修饰方式。甲基化以后核苷酸的顺序并没有发生改变,而基因的表达则受到一定程度的影响。在DNA 甲基化过程中,DNA 甲基转移酶的表达水平和功能的改变是导致异常DNA 甲基化模式的关键因素之一。既然HPV 高危亚型的感染和DNA 甲基化均是宫颈癌发生、发展的重要因素,那么它们二者之间是否存在必然的联系,目前国内外鲜见报道。因此,本文拟对宫颈癌、癌旁组织及正常宫颈组织DNMT 的表达情况进行分析,并分析其与HPV 高危亚型感染之间的关系。
1 材料与方法
1.1 标本和试剂 所有组织标本均来自重庆第三军医大学大坪医院野战外科研究所妇产科,宫颈癌组织及对应癌旁组织均经病理证实(38例为鳞癌,2例为腺癌),正常宫颈组织为子宫肌瘤或子宫脱垂并行子宫全切者。TRIzol RNA 提取试剂购自北京康为世纪公司;2×QPCR master mix 购自Takara公司,所有引物均由上海生工生物工程公司合成;RIPA 蛋白裂解液、BCA 蛋白浓度测定盒、GAPDH 内参一抗均购自碧云天技术有限公司;DNMT1、DNMT2、DNMT3a、DNMT3b和DNMT3l抗体购自Abcam 公司,免疫组化与免疫荧光相关试剂、羊抗鼠、羊抗兔IgG 购自北京中杉金桥公司。

表1 各目的基因的引物序列及内参序列
1.2 方法
1.2.1 HPV 分型检测 HPV DNA 检测由深圳华大基因科技有限公司采用飞行时间质谱检测法对宫颈刷片标本进行HPV 亚型测定,包括HPV16、18、31、33、35、39、45、51、52、56、58、59、66、68、6、11,共16种亚型。
1.2.2 荧光定量PCR 检测宫颈癌、癌旁组织及正常宫颈组织的mRNA 表达情况 取30~50mg组织按TRIzol试剂说明提取组织总RNA,Manodrop lite测定RNA 浓度,并取3μg按试剂说明书反转录成cDNA。反应体系:取1μL cDNA 模板,上、下游引物0.5μL,10μL SYB Green Mix及8μL去离子水行定量PCR 反应,以GAPDH 为内参,各引物序列见表1;反应条件为:50 ℃2min、95 ℃10min预变性;随后95 ℃30s,60 ℃30s,共40 个循环;最后72 ℃延伸10 min。根据ABI 7500型荧光定量仪所得Ct值,以GAPDH 为内参,计算各组mRNA 相对表达量,结果用2-δδCt值表示,δCt=Ct目的基因-CtGAPDH,δδCt=δCt实验组-δCt对照组。
1.2.3 免疫组织化学法检测宫颈癌、癌旁组织及正常宫颈组织的蛋白表达情况 新鲜组织标本用甲醛固定并行石蜡包埋,切片机切片;40 ℃水浴伸展,60 ℃烘箱烤片2h,脱水,柠檬酸钠高压锅行抗原修复,3%H2O2室温孵育15min,PBS洗片5 min×3次,滴加一抗(工作浓度均为1∶100),4 ℃孵育过夜;PBS冲洗3次,二抗37 ℃孵育25min,PBS冲洗2min×3次,DAB显色(1min),自来水冲洗1min×3次,苏木精染色20s,盐酸乙醇分化,自来水冲洗1 min×3次,脱水、透明、封片、镜检(Olympus)。
1.2.4 Western blotting 检测宫颈癌组织、癌旁组织及正常宫颈组织的蛋白表达情况 取30~50mg组织,加入RIPA 裂解液(含10∶1cocktail)400μL,冰上裂解30 min,取上清液于1.5mL离心管中,BCA 法酶标仪测定蛋白浓度,并标准化样品,100 ℃水浴15min使蛋白变性。按照每孔60μg蛋白进行SDS-PAGE电泳(80V跑过上层胶,120V跑至溴酚蓝刚跑出即终止),半干转法[横流,电流(mA)=膜面积(cm2)×2(mA)]将蛋白转印到0.2μm PVDF 膜上,然后用含5%脱脂奶粉的PBST 缓冲液室温封闭2h,漂洗后与一抗4 ℃缓慢摇动过夜;次日用PBST 洗膜3×10min,洗脱后与相应HRP标记的二抗室温孵育2h,相同条件再次洗膜后用化学发光试剂显影,凝胶成像系统曝光获取图像,并用Quantity one计算目的条带与内参GAPDH 的灰度比值。
1.3 统计学处理 采用SPSS17.0统计软件进行处理,组间的差异显著性检验采用t检验,样本阳性率比较采用卡方检验,相关性分析采用Spearman等级相关分析,以P<0.05 为差异有统计学意义。
2 结 果
2.1 HPV 分型检测结果 60 例标本中有40 例检出HRHPV,其中癌组织38 例,正常宫颈组织2 例。宫颈癌组织中HR-HPV 感染率为95.0%,正常宫颈组织感染率为10.0%,两组相比差异有统计学意义(P<0.01)。在宫颈癌组中,HPV 16,52,58,31,18感染率较高;而2例正常宫颈组织的HPV 检出亚型均为HPV 16。所有HPV 阳性的宫颈组织中,单一亚型感染23 例,占57.5%;双重感染及多重感染17 例,占42.5%。
2.2 宫颈癌组织、对应癌旁组织及正常宫颈组织中DNMTs的mRNA 表达情况 各目的基因表达情况如图1所示,癌组织及癌旁组织与正常宫颈组织相比,DNMT1、DNMT3a、DNMT3b、DNMT3l表达显著升高,DNMT2 表达显著降低(P<0.05)。
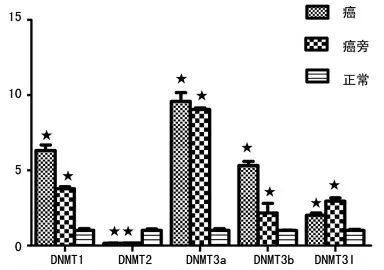
图1 各目的基因中宫颈癌、对应癌旁组织及正常宫颈组织mRNA 的表达情况
2.3 宫颈癌组织、对应癌旁组织及正常宫颈组织DNMTs的蛋白表达情况 各目的蛋白的免疫组化结果见图2。癌组织DNMT1表达率90.0%(36/40),DNMT2 表达率12.5%(5/40),DNMT3a表达率85.0%(34/40),DNMT3b表达率70%(28/40),DNMT3l表达率80.0%(32/40);癌旁组织DNMT1表达率87.5%(35/40),DNMT2 表达率17.5%(7/40),DNMT3a表达率85.0%(34/40),DNMT3b 表达率72.5%(29/40),DNMT3l表达率77.5%(31/40),正常宫颈组织DNMT1表达率25%(5/20),DNMT2表达率85.0%(17/20),DNMT3a表达率15.0%(3/20),DNMT3b表达率20.0%(4/20),DNMT3l表达 率30.0%(6/20)。可见除DNMT2外,其余DNMT 在宫颈癌、癌旁组织的表达率均明显高于正常组织(P<0.05)。5种蛋白的表达部位均在细胞核内。
宫颈癌组织、对应癌旁组织及正常宫颈组织中DNMTs的Western blotting情况如图3所示。癌组织DNMT1 表达率90.0%(36/40),DNMT2 表达率15.0%(6/40),DNMT3a表达率85.0%(34/40),DNMT3b表达率70%(28/40),DNMT3l表达率80.0%(32/40);癌旁组织DNMT1表达率87.5%(35/40),DNMT2表达率10.0%(4/40),DNMT3a表达率80.0%(32/40),DNMT3b 表达率75.0%(30/40),DNMT3l表达率77.5%(31/40);正常宫颈组织DNMT1表达率20.0%(4/20),DNMT2表达率90.0%(18/20),DNMT3a表达率15.0%(3/20),DNMT3b表达率20.0%(4/20),DNMT3l表达率25.0%(5/20),与免疫组化结果基本吻合。除DNMT2外,其余DNMT 在宫颈癌、癌旁组织的表达率均明显高于正常组织(P<0.05)。

图2 DNMT3a和DNMT2在宫颈癌组织、癌旁组织和正常宫颈组织的表达(SP×400)
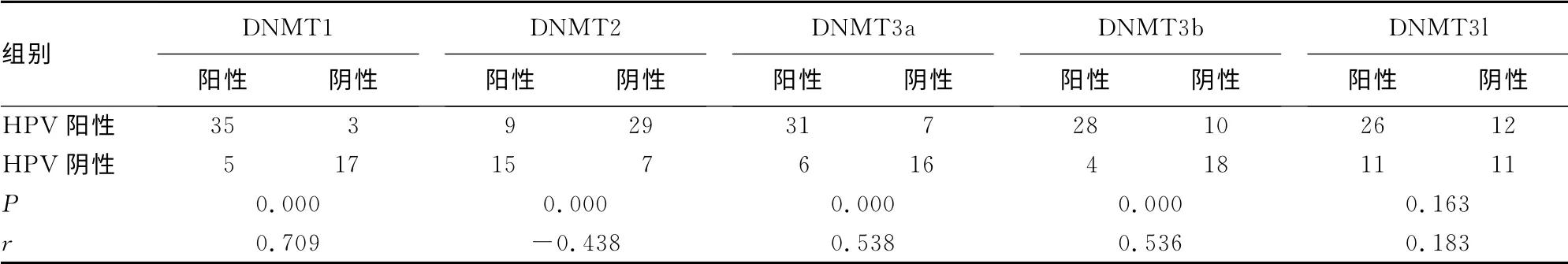
表2 HPV 感染与DNMT 蛋白阳性表达之间的相关性(n)

图3 各DNMT 蛋白的Western blotting检测情况
2.4 DNMT 的阳性表达与宫颈组织HPV 感染的相关性 各DNMT 蛋白的表达情况与HPV 感染的相关性分析见表2。可见,DNMT1、3a、3b的阳性表达与HPV 感染呈明显的正相关(r值分别为0.709、0.538和0.536,P<0.05),而DNMT2的阳性表达与HPV 感染呈明显的负相关(r=-0.438,P<0.05),DNMT3l的阳性表达则与HPV 感染无明显关系(r=0.163,P>0.05)。
3 讨 论
3.1 甲基转移酶及其与宫颈癌的关系 目前已知的DNA 甲基化转移酶家族包括DNMT1、DNMT3a、DNMT3b、DNMT3l和DNMT2。DNMT3a和DNMT3b是胚胎早期发育中建立起DNA 甲基化模式的重新甲基转移酶,主要参与甲基化从头合成[2];DNMT1是作用于半甲基化DNA 的维持甲基化转移酶,它对新合成的DNA 单链进行甲基化修饰,并将甲基化信息传递给子代细胞。DNMT3l不具有酶活性,主要作用是调节DNMT3a和3b的活性从而调节从头甲基化[3]。而DNMT2实质上是一种tRNA 甲基化转移酶,在体外无酶活性,但因其结构与其他DNMT 相似,故也归类在DNMT 家族中。关于DNMT2的作用目前尚不清楚[4],也有研究称DNMT2具有微弱DNA 甲基转移酶活性[5]。一般认为,DNMT 在胚胎早期为高表达,随着细胞分化的成熟和基因组甲基化模式的稳定,DNMTs就在体细胞中表达降低甚至是消失。早在1999年Robertson等[6]就发现DNMT1、3a、3b 在宫颈癌组织的mRNA 表达水平高于正常宫颈组织,并且揭示DNMTs的表达异常是引起宫颈癌发生、发展的重要因素。本研究结果显示DN-MT1、3a、3b、3l无论是在mRNA 水平还是蛋白水平上,癌组织中表达水平均高于正常宫颈组织,而DNMT2在癌组织中表达水平明显低于正常宫颈组织,同样提示DNA 甲基化转移酶尤其是DNMT1、3a和3b的过表达在宫颈癌的发生、发展中扮演了重要角色,而DNMT2 不具备DNA 甲基转移酶活性,可能与宫颈癌的发生、发展无明显关系。但是,宫颈癌组织中是什么导致了DNMT 的表达增高,目前机制尚不明确。
3.2 HPV 感染及其与宫颈癌的关系 HPV 感染是导致宫颈发生癌变最主要的原因,然而大部分HPV 感染者只是一过性感染,只有不到10%的HPV 感染者会发展为重度损伤、甚至是浸润性宫颈癌,90%以上的HPV 急性感染者虽在初期会有轻度损伤,但在3年内可以自发清除其感染及伤害[7]。浸润性宫颈癌患者最常见的HPV 感染亚型为HPV 16/18,总检出率高达70%,亚洲地区其他常见的HPV 高危亚型还包括HPV 52、58和33[8-9]。本实验检测结果显示,HPV 感染最常见的亚型依次为HPV 16、52、58、31 和18,与其他文献报道基本相符。其中单一亚型感染以HPV 16多见,大多数学者认为,这部分HPV 通过整合到宿主细胞,进而引起其发生改变,可能机制为:(1)HPV 16整合到宿主细胞后导致E6/E7的永久表达,通过使原癌基因p53和Rb及其他一些参与细胞黏附、凋亡、细胞周期、DNA 修复、细胞代谢、调节转录和翻译的信号转导通路的蛋白失活,进而促进细胞的转化和无限增殖;(2)病毒整合到基因内或其附近会最终导致细胞生长及分化的改变;(3)病毒整合可以诱导病毒和宿主基因表观遗传学的改变,进而影响其表达[10]。
3.3 甲基化与HPV 感染之间的关系及其对宫颈的作用 有学者认为,HPV 感染与DNA 甲基化的分子机制存在着相互联系,这种联系既有可能是宿主对外来基因的一种防御方式,也有可能是DNA 甲基化直接参与了病毒的复制周期。Chen等[11]发现丙型肝炎病毒相关性肝癌中,DNMT1、3b的异常表达与丙型肝炎病毒感染密切相关。同时,亦有研究证实宫颈癌细胞的HPV 特定基因启动子存在异常甲基化,如IGF2、PEG1/MEST、DAPKⅠ、RARβ、TWISTⅠ、CDH13 等[12-13]。Yeung等[14]通过敲除宫颈癌细胞株中的HPV16E6,观察到DNMT1的表达下降,且E6过表达时,其DNMT1的表达也升高,说明了HPV16E6 对DNMT1 表达的作用。这些均证明HPV 的感染确实与DNA 的异常甲基化存在关系。Burgers等[15]认为HPV E7蛋白有可能通过两种途径影响DNMT 的表达:(1)E7蛋白间接的结合到pRb上,进而释放E2F转录因子,从而引起DNMT 启动子的活性增高;(2)E7蛋白直接结合到DNMT 上,形成E7/DNMT 复合物,使得DNMT的激活位点暴露,促进DNMT 与DNA 和腺苷蛋氨酸的结合。这种甲基化的改变会使得某些抑癌基因表达沉默,进而导致宫颈癌的发生。本研究中发现HR-HPV 阳性和阴性者,其DNMT 的表达谱存在明显异常,这可能提示了宫颈癌中DNMT 的表达与HPV 高危亚型的感染存在一定的相关性,二者之间的相互作用最终导致了宫颈癌的发生、发展。但HPV 感染引起DNMT的表达谱发生变化的具体机制目前尚不清楚,需待进一步的研究。
综上所述,5种DNMT 在宫颈癌组织中的表达谱发生明显改变,以DNMT1、DNMT3a、DNMT3b为主,HR-HPV 感染与宫颈癌组织中DNMT1、DNMT3a、DNMT3b的过表达呈正相关,提示HR-HPV 感染可能影响宫颈癌组织中DNMT 的表达,进而引起宫颈癌的发生、发展,但HR-HPV 感染引起DNMT 异常的机制及此机制是否与宫颈癌相关均需进一步探索。
[1] Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008[J].Ann Oncol,2011,22(12):2678-2686.
[2] Okano M,Bell DW,Haber DA,et al.DNA methyltransferases Dnmt3aand Dnmt3bare essential for de novo methylation and mammalian development[J].Cell,1999,99(4):247-257.
[3] Hermann A,Goyal R,Jeltsch A,et al.TheDnmt1DNA-(cytosine-C5)-methyltransferase methylates DNA processively with high preference for hemimethylated target sites[J].J Biol Chem,2004,279(46):48350-48359.
[4] Defossez PA.Ceci n′est pasune DNMT:recently discovered f unctions of DNMT2and their relation to methyltransferase activity[J].Bioessays,2013,35(12):1024.
[5] Goll MG,Kirpekar F,Maggert KA,et al.Methylation of tRNA Asp by the DNA methyltransferase homolog Dnmt2[J].Science,2006,311(5759):395-398.
[6] Robertson KD,Uzvolgyi E,Liang G,et al.The human DNA methyltransferases(DNMTs)1,3aand 3b:coordinatem RNA expression innormal tissues and overexpression in tumors[J].Nucleic Acids Res,1999,27(11):2291-2298.
[7] Ho GY,Bierman R,Beardsley L,et al.Natural history of cervicovaginal papillomavirus infection in young women[J].N Engl J Med,1998,338(7):423-428.
[8] Bao YP,Li N,Smith JS,et al.Human papillomavirus type distribution in women from Asia:a meta-analysis[J].Int J Gynecol Cancer,2008,18(1):71-79.
[9] Woodman CB,Collins SI,Young LS.The natural history of cervical HPV infection:unresolved issues[J].Nat Rev Cancer,2007,7(1):11-22.
[10] Jimenez-Wences H,Peralta-Zaragoza O,Fernandez-Tilapa G.Human papilloma virus,DNA methylation and microRNA expression in cervical cancer(Review)[J].Oncol Rep,2014,31(6):2467-2476.
[11] Chen C,Pan D,Deng A,et al.DNA methyltransferases 1 and 3Bare required for hepatitis C virus infection in cell culture[J].Virology,2013,441(1):57-65.
[12] Vidal AC,Henry NM,Murphy SK,et al.PEG1/MEST and IGF2DNA methylation in CIN and in cervical cancer[J].Clin Transl Oncol,2014,16(3):266-272.
[13] Sova P,Feng Q,Geiss G,et al.Discovery of novel methylation biomarkers in cervical carcinoma by global demethylation and microarray analysis[J].Cancer Epidemiol Biomarkers Prev,2006,15(1):114-123.
[14] Yeung CL,Tsang WP,Tsang TY,et al.HPV-16E6upregulation of DNMT1through repression of tumor suppressor p53[J].Oncol Rep,2010,24(6):1599-1604.
[15] Burgers WA,Blanchon L,Pradhan S,et al.Viral oncoproteins target the DNA methyltransferases[J].Oncogene,2007,26(11):1650-1655.

