90例青年肺癌患者的临床特征及预后分析
岳 渝,肖 何,金 丰,陈 川,杨雪琴,单锦露,仲召阳,杨镇洲,谢家印,王 阁,王 东
(第三军医大学大坪医院野战外科研究所肿瘤中心,重庆400042)
目前在肺癌仍是全球最常见的恶性肿瘤之一,多发生于中老年人。近年来,由于环境污染的日益严重和世界吸烟人口的年轻化,尤其是青年肺癌的发病率呈逐年上升的趋势。根据大量的外国文献报道青年肺癌多定义在40岁以下(包括40岁),而且其病理类型、治疗反应及预后可能不同于常见肺癌,在临床治疗实践中值得特别注意。本文回顾性分析了本院2003~2014年经病理学确诊的90例青年肺癌患者的病历资料,探讨其病理特征,并对手术患者的无病生存期(DFS)、总生存时间(overall survival,OS),非手术患者综合治疗后的无进展生存(pro-gression-free survival,PFS)及一线治疗的疗效进行评估。
1 资料与方法
1.1 一般资料 回顾性分析2003年1月至2014年3月本院收治的90例40岁及以下的肺癌患者的临床资料。所有病例均经组织学或细胞学确诊,信息完整、诊疗过程详实。患者的临床资料包括年龄、TNM 分期、病理类型、接受治疗情况及疗效等。主要观察指标为患者的一线治疗疗效、PFS、OS。
1.2 治疗方法 90例患者中手术患者58例,非手术患者32例。非手术患者接受一线治疗方法包括化疗和放疗。
1.3 疗效评价及生存情况 以CT、MRI等影像学手段对目标病灶及非目标病灶进行疗效评价。按照RECIST 标准进行疗效评价,(1)完全缓解(complete response,CR):所有目标病灶和非目标病灶均消失,且肿瘤标志物正常;(2)部分缓解(partial response,PR):基线病灶长径总和缩小大于或等于30%;(3)疾病稳定(stable disease,SD):缩小未达PR 或增加未到疾病进展,1个或多个非目标病灶和/或标志物异常;(4)疾病进展(progression disease,PD):基线病灶长径总和增加大于或等于0%或出现新病灶,或(和)非目标病灶进展。以CR+PR 计算客观有效率(objective response rate,ORR),CR+PR+SD 计算疾病控制率(disease control rate,DCR)。PFS定义为患者开始治疗至疾病进展或疾病尚未进展的末次随访时间。OS定义为患者开始治疗至患者死亡或末次随诊时间。失访或存活作为截尾数据。DFS定义是指从随机化开始至疾病复发或由于疾病进展导致患者死亡的时间。
1.4 统计学处理 采用SPSS 19.0统计软件进行数据处理。率的比较采用Pearsonχ2检验和Fisher′s精确概率检验进行分析。生存分析采用Kaplan-Meier法,各因素水平间比较用Log-rank分析,Cox回归模型(向前法)分析预后相关因素。计算每个因素的死亡相对风险值(odds ratios,OR)及其95%可信区间(CI)。所有统计检验均为双侧概率检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 在90例患者中,手术患者58例(64.4%),非手术患者32例(35.6%)。女40例(44.4%),男50例(55.6%)。组织学类型:腺癌64例(71.1%),鳞癌9例(10.0%),其他(大细胞癌、类癌等)17例(18.9%)。临床分期:ⅠA~ⅡB期共31例(34.4%),Ⅲa~Ⅳ期共59例(65.6%)。
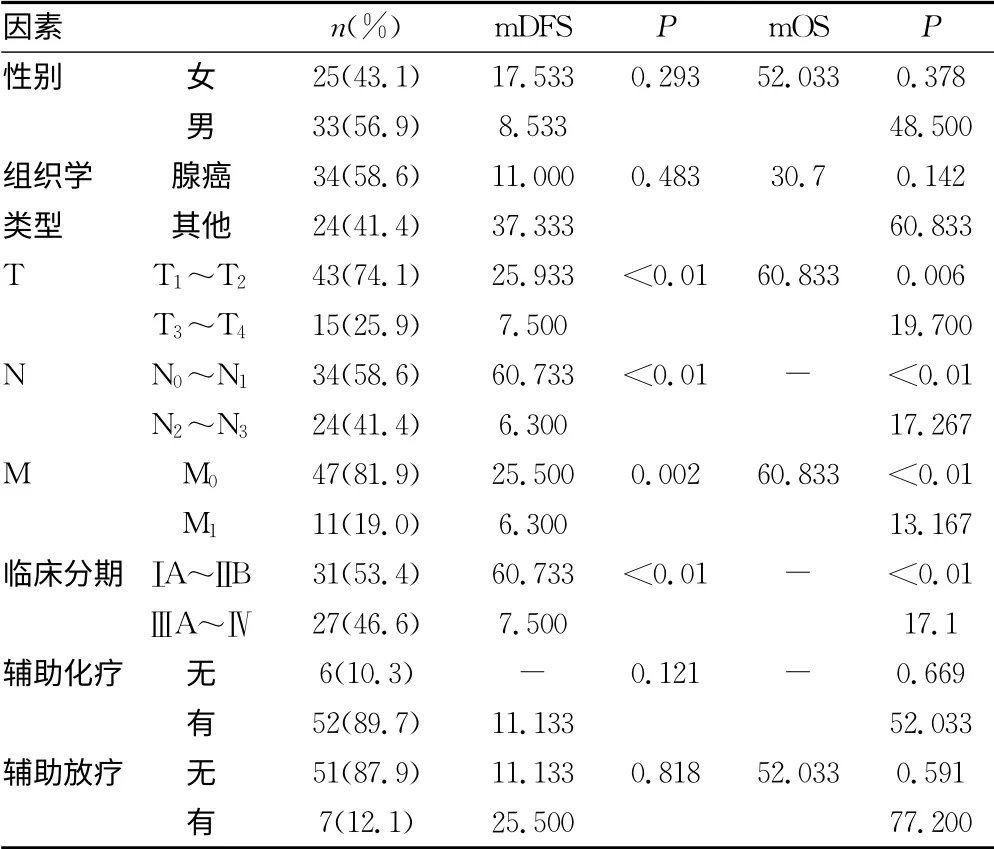
表1 58例手术组患者的DFS和OS分析
2.2 手术组结果 手术组58例,其中腺癌34例(58.6%),术后行辅助化疗52例(89.7%),行辅助放疗7例(12.1%)。总体中位随访时间24个月。总体中位DFS为11.8个月,总体中位OS为52.0 个月。3年和5年生存率分别为59.76%、40.90%(表1)。单变量Cox回归表明,T、N、M 和临床分期是进展的风险因素。逐步向前Cox回归表明T 和临床分期是独立预后因素。对OS分析表明,临床分期是总生存的独立预后因素(图1)。有远处转移患者的死亡风险显著增加(HR=2.684,P=0.035),同时,ⅢA~Ⅳ的死亡风险是ⅠA~ⅢB 的7.813倍(HR=7.813,P<0.01)。

图1 手术患者的临床分期和DFS、OS分析
2.3 非手术组结果 非手术组共32例,初诊时骨转移18例(56.2%),双肺转移10例(31.2%),脑转移7例(21.8%),肝转移1例(3.1%),胸腔积液3例(9.4%)。非手术治疗组中腺癌29例,鳞癌2 例,细支气管肺泡癌1 例。一线化疗方案中TP(紫杉醇注射液+铂类)有21例,PP(培美曲塞二钠+铂类)有8例,其他3例。没有完全缓解的病例,7例达到部分缓解,稳定和进展分别有6例和19例。总体中位随访时间8个月,总体中位PFS为7.0个月,总体中位OS为25.7个月。对化疗方案的反应,PP方案有3例达到部分缓解(37.5%),TP 方案有4例到达部分缓解(19.0%),而2例一线使用TKI治疗和1例吉西他滨+铂类(GP)方案患者均为进展。因例数限制,缓解率与基线特征间均没有显著相关性。PP 方案患者中位PFS为10.2个月,而TP方案仅有6.3个月(Log-RankP=0.013)。见表2、图2。
单变量Cox回归表明,接受PP化疗方案的患者进展风险相对于包括TKI治疗在内的其他治疗方案显著下降(HR=0.219,P=0.017)。化疗周期数越多也显著降低进展风险(HR=0.788,P=0.021)。对单因素分析所有指标作为候选变量,逐步向前Cox回归表明,只有组织学类型、化疗方案以及是否达到PR 和SD 是独立预后因素。PP 方案和达到疾病控制显著降低进展风险,相反,腺癌相对于其他组织学类型进展风险显著增高。对OS的多变量分析表明,化疗周期数是唯一的独立预后因素,患者死亡风险随着化疗周期数增多而显著下降(HR=0.374,P=0.002)。

表2 非手术治疗组基线特征及不同亚组间 中位PFS的比较
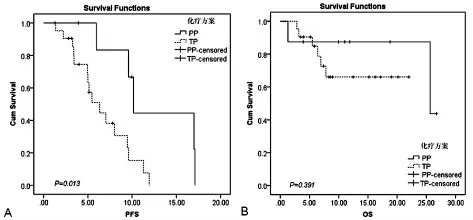
图2 非手术患者不同化疗方案与PFS、OS分析
3 讨 论
随着社会的发展,环境污染,肺癌的发病率逐年增加,约占所有肿瘤的12.4%[1],已跃居恶性肿瘤病死率的首位[2]。相关文献[3-4]显示,肺癌在中老年患者的发病率趋于平稳甚至有下降趋势,青年人发病率却呈现出逐年上升的趋势。目前有关青年NSCLC的年龄界定尚未有统一的国际标准。美国及欧洲各国40 岁以下的青年NSCLC 占全部患者的1.2%~10.0%[5],我国具体数值尚要依靠大型的流行病学调查来证实。本研究以绝大多数文献中采用的年龄小于或等于40岁作为青年NSCLC的年龄界定标准。
本文肺癌中男女比例1.25∶1,这与Maruyama等[6]的报道男女比例为2∶1相比稍低。这可能与环境污染、烹调高温油烟、被动吸入二手烟、女性就业压力的加大所致近10年来女性肺癌患者的增加有关。
研究中观察到青年肺癌患者病理类型中以腺癌最多见,占71.1%。这与女性患者的增加、腺癌发生率较高有关。而腺癌多为血行转移,故就诊时往往分期偏晚,手术根治性切除率低,错过最佳手术时机。但因为患者年纪轻、心肺功能较好、术后及化疗后并发症少,且患者及家属治疗态度相对积极,故绝大多数都进行了相对完整的治疗。本文中手术患者占64.4%,本组整体的3年和5年生存率分别为59.76%、40.90%。
大量的临床研究显示年龄与预后有很大关系,多数的报道指出青年肺癌患者相对于老年肺癌组生存率较低[7],有研究指出二者生存率相同[8-10],也有青年肺癌高于老年肺癌生存率的报道[11-13]。而本文的研究结果显示青年肺癌中手术患者中位OS为52.0个月,非手术患者中位OS为25.7 个月。多个研究的差异可能是因为青年肺癌研究例数较少,一些报道的研究设计上有的只是手术病例或者只是非手术的病例,以及每个研究中截止年龄不一致,或环境及种族的差异有关。
本研究显示手术组中,单因素及多因素分析均显示确诊时的T、N、M 和临床分期是影响预后的因素,而组织学类型不是影响预后的因素,这与文献一致。
在晚期非手术治疗组中,一线化疗方案中PP方案患者中位PFS为10.2个月,而TP方案仅有6.3个月,且具有统计学意义。初步的结果提示培美曲赛联合铂类方案在无疾病进展期上较紫杉醇联合铂类方案有优势,这与本中心另一针对所有年龄段腺癌患者的研究[14]结果一致,可能因为非手术组中腺癌占多数有关。该结果需增加样本量予以进一步证实。
本研究还显示,随着化疗周期数的增加,进展风险显著降低。对OS的多变量分析表明,化疗周期数是唯一的独立预后因素。提示青年肺癌的治疗应该受到足够的重视,需更加积极的治疗,提高患者生存率。
目前社会的激烈竞争,环境污染,抽烟喝酒过度,生活不规律,青年肺癌发病率逐年增加,因青年患者症状轻,容易误诊漏诊,故早期诊断、早期手术治疗显得尤为重要。对于不能手术的患者,应首选PP 方案化疗且延长化疗周期能降低进展风险。同时,由于本研究仅是一项回顾性分析,样本量不够大,有必要扩大样本量进行进一步的分析或者进行前瞻性的研究分析。
[1] Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2] Jung KW,Park S,Kong HJ,et al.Cancer statistics in Korea:Incidence,mortality and survival in 2006-2007[J].J Korean Med Sci,2010,25(8):1113-1121.
[3] Jemal A,Murray T,Ward E,et al.Cancer Statistics,2005[J].CA Cancer J Clin,2005,55(1):10-30.
[4] Bryant AS,Cerfolio RJ.Differences in outcomes between young and older patients with non-small cell lung cancer[J].Ann Thorac Surg,2008,85(5):1735-1739.
[5] Subramanian J,Morgensztern D,Goodgame B,et al.Distinctive characteristics of non-small cell lung cancer(NSCLC)in the young:a surveillance,epidemiology,and end results(SEER)analysis[J].J Thorac Oncol,2010,5(1):23-28.
[6] Maruyama R,Yoshino I,Yohena T,et al.Lung cancer in patients younger than 40years of age[J].J Surg Oncol,2001,77(3):208-212.
[7] Green LS,Fortoul TI,Ponciano G,et al.Bronchogenic cancer in patients under 40years old:the experience of a Latin American country[J].Chest,1993,104(5):1477-1481.
[8] Liu NS,Spitz MR,Kemp BL,et al.Adenocarcinoma of the lung in young patients:The M.D.Anderson experience[J].Cancer,2000,88(8):1837-1841.
[9] Blanco M,Garcia-Fontan E,Rivo JE,et al.Bronchogenic carcinoma in patients under 50years old[J].Clin Transl Oncol,2009,11(5):322-325.
[10] Skarin AT,Herbst RS,Leong TL,et al.Lung cancer in patients under age 40[J].Lung Cancer,2001,32(3):255-264.
[11] Kuo CW,Chen YM,Chao JY,et al.Non-small cell lung cancer in very young and very old patients[J].Chest,2000,117(2):354-357.
[12] Subramanian J,Morgensztern D,Goodgame B,et al.Distinctive characteristics of non-small cell lung cancer(NSCLC)in the young:a surveillance,epidemiology,and end results(SEER)analysis[J].J Thorac Oncol,2010,5(1):23-28.
[13] Tian DL,Liu HX,Zhang L,et al.Surgery for young patients with lung cancer[J].Lung Cancer,2003,42(2):215-220.
[14] 彭宇,李峥,熊艳丽,等.晚期非小细胞肺癌不同含铂两药方案一线化疗预后因素的分析[J].第三军医大学学报,2014,36(16):1703-1708.

