肺母细胞瘤临床病理特征分析
宫惠琳,张娇娇,汪圆圆,梁 华,王 凯,杨 喆,郑 瑾
(1.西安交通大学医学院第一附属医院 病理科,陕西 西安710061;2.西安交通大学医学院第一附属医院 肾脏病医院,陕西 西安710061)
肺母细胞瘤(pulmonary blastoma,PB)是一种罕见的组织起源未明确的恶性肿瘤,具有独特的病理特征、临床表现和预后,占所有肺原发恶性肿瘤0.25% ~0.5%[1]。根据发病年龄不同,肺母细胞瘤可分为成人型和儿童型两类。成人型又分为双相型和单相型,前者即经典的双相型肺母细胞瘤(classic biphasic pulmonary blastoma,CBPB),由类似于肺胎儿型腺癌的恶性原始上皮成分和原始间叶成分共同构成,后者(单相型)又称上皮型肺母细胞瘤或分化好的胎儿型腺癌(well differentiated fetal adenocarcinoma,WDFA),仅含有类似于胎儿肺小管的原始上皮成分;儿童型肺母细胞瘤即胸膜肺母细胞瘤(pleuropulmonary blastoma,PPB),也是一种单相型肿瘤,仅含原始间叶成分[2]。本文对西安交通大学医学院第一附属医院1987年1月至2013年9月收治的8 例肺母细胞瘤患者的临床病理资料进行分析,对肿瘤组织进行免疫组化染色及EGFR 基因突变检测,探讨其临床病理特点。
1 资料与方法
1.1 研究对象
本组8 例中有6 例为成人型肺母细胞瘤患者,年龄27 ~53 岁,平均年龄42 岁,其中男性4 例、女性2 例,主要症状有胸痛、咳嗽、痰中带血,CT 检查显示均为肺外周型肿块,边缘不规整,考虑肺癌;肿瘤位于右肺者2 例、左肺者4 例,6 例患者均行肺叶切除及区域淋巴结清扫术。另2 例为儿童型肺母细胞瘤患者,其中1 例为2 岁女童,因右侧气胸收住院,后行剖胸探查术发现右肺下叶有一囊实性肿物;另1 例为1 岁9 个月男童,因咳嗽气短半月余入院,查体发现左胸隆起、呼吸音低、心音右移,CT 示左肺上叶后侧巨大囊肿,两例均行肺叶切除术。
1.2 病理检查
对切下的肿瘤组织标本进行大体病理观察,及HE 染色后镜下观察病理变化。
1.3 免疫组化染色
8 例肺母细胞瘤标本均经10%福尔马林固定,常规取材,石蜡包埋制片,免疫组化染色,免疫组化采用MaxVision 二步法。广谱CK、EMA、Nse、CgA、Syn、Vimentin、SMA、Des、S100、CD34、TTF1、β-catenin 单克隆抗体均购自福州迈新公司,DAB 显色、苏木素复染。用已知的中等程度阳性片作阳性对照,PBS 取代第一抗体作为阴性对照,以≥5%的肿瘤细胞质、胞膜或胞核染成棕黄色为阳性。
1.4 EGFR 基因突变检测
8 例标本均做EGFR 基因突变检测,其中3 例是在术后即行检测;另外5 例是用存档标本蜡块进行检测,标本蜡块存放时间3 ~27年不等。先由有经验的病理医师对切片进行评估,保证肿瘤细胞的数量满足检测方法的最低要求,即至少包含200 个肿瘤细胞。一般切取4 μm 石蜡切片3 ~6 张,放入1.5 mL 离心管中,二甲苯脱蜡后用Qiagen DNA Mini Kit(51304)按试剂盒说明书操作步骤提取基因组DNA。用A260、A260/A280 值评估DNA 含量与纯度。按照EGFR 基因突变检测试剂盒(厦门艾德生物医药科技有限公司)所提供的扩增阻滞突变检测方法(amplification refractory mutation system,ARMS 法)进行检测。该试剂盒可以检测出EGFR基因外显子18 ~21 的29 种常见突变类型。在Bio-Rad CFX96 PCR 仪上进行即时定量PCR 扩增。反应结束后即时定量PCR 仪自动以扩增曲线的形式输出结果。根据EGFR 突变检测试剂盒的使用说明书判读结果。
1.5 随 访
术后随访至2014年12月,观察患者肿瘤的复发及转移情况。
2 结 果
2.1 病理检查
2.1.1 巨检:6 例成人型肺母细胞瘤均为单发,体积由5 cm×4.5 cm ×3 cm ~16 cm ×15 cm ×5 cm不等,其中3 例侵及肺膜;肿瘤无包膜,边界不清,切面呈灰白色灰黄色,质地软到中等硬度,伴灶状出血、坏死。2 例儿童型肺母细胞瘤体积分别为9.5 cm×5 cm ×3 cm 及11 cm ×9 cm ×3.5cm,呈囊实性,囊性区内壁光滑,实性区切面呈灰白灰红色,质地软。
2.1.2 镜检:6 例成人型肺母细胞瘤组织学分为两型:(l)上皮型肺母细胞瘤/分化好的胎儿型腺癌2例(图1),瘤细胞呈柱状、无纤毛,排列成腺管状及分支管状结构,形态类似子宫内膜样腺体,细胞质透亮或淡嗜酸性,部分可见核上或核下空泡,核呈圆形或卵圆形,无明显异型性,染色质呈细颗粒状,有的可见小核仁;在腺体基部或腺体间可见桑葚状细胞团,并可见排列呈菊形团样的小腺体;肿瘤间质量少,由分化成熟的纤维母细胞及肌纤维母细胞构成。(2)经典的双相分化型肺母细胞瘤4 例(图2),由恶性原始间叶和恶性上皮两种成分组成,原始间叶细胞呈梭形,弥散性分布于粘液样背景中,胞界不清,胞质少,核呈梭形或卵圆形、深染,核分裂相易见,局部区域可见软骨分化;在原始间叶组织中分布着恶性上皮细胞成分,其形态结构类似上皮型肺母细胞瘤。2 例儿童型即胸膜肺母细胞瘤(图3),肿瘤呈囊实性,囊性区呈多房囊性,内衬分化良好的柱状上皮,上皮下为排列密集的原始间叶样小细胞,细胞呈圆形或短梭形,胞质少、核深染;实性区除了排列成片的原始间叶样小细胞外,还可见大量分化不同阶段的横纹肌母细胞,局灶软骨结节形成,部分区域可见陷入或残留的成熟的细支气管及肺泡上皮。
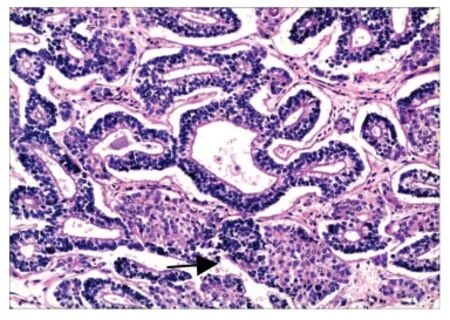
图1 上皮型肺母细胞瘤 (×100)Fig 1 Epithelial type PB (×100)

图2 经典的双相型肺母细胞瘤 (×100)Fig 2 CBPB (×100)
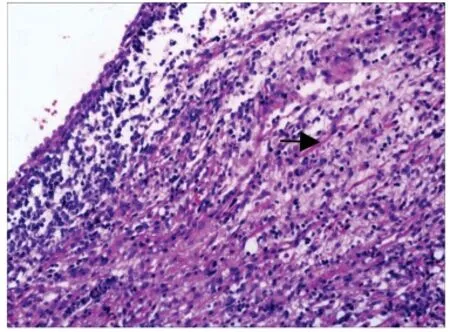
图3 胸膜肺母细胞瘤 (×100)Fig 3 Pleuropulmonary blastoma (×100)
2.2 免疫组化结果
8 例PB 均做广谱CK、EMA、Nse、CgA、Syn、Vimentin、SMA、Des、S100、CD34、TTF1、β-catenin 染色,免疫组化标记染色结果见图4~7。8 例肿瘤中上皮成分广谱CK、EMA、TTF1 均呈阳性,Nse 均为阴性,桑葚体结构呈CgA、Syn 阳性;4 例CBPB 和2 例PPB的间叶成分Vimentin 阳性,SMA、Des 灶状阳性,软骨分化区显示S100 阳性,间质血管CD34 阳性;6 例成人型PB 中的上皮成分显示β -catenin 细胞核、质阳性。
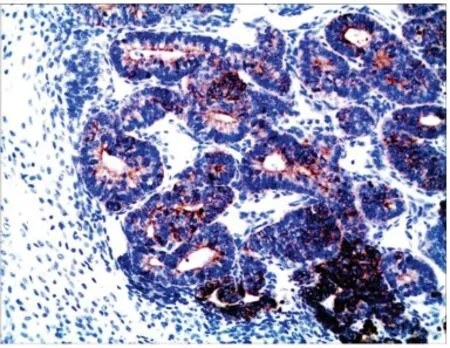
图4 肺母细胞瘤中原始上皮成分显示Pan-CK 阳性(Max-Vision,×100)Fig 4 The primitive epithelial component in PB is positive for Pan-CK (MaxVision,×100)
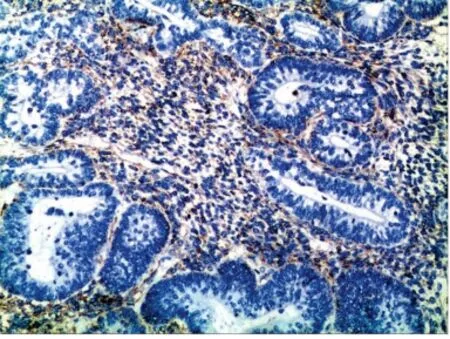
图5 肺母细胞瘤中原始间叶成分显示Vimentin 阳性(MaxVision,×100)Fig 5 The primitive mesenchymal component in PB is positive for Vimentin (MaxVision,×100)
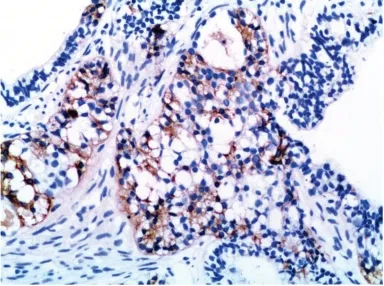
图6 桑葚体结构显示Syn 阳性 (MaxVision,×200)Fig 6 The structure of morula is positive for Syn (MaxVision,×200)
2.3 EGFR 基因突变检测结果
8 例患者EGFR 基因18 ~2l 外显子均无突变,为野生型,见图8。
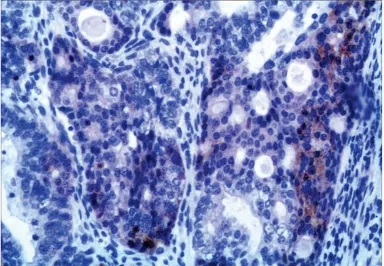
图7 PB 内上皮成分显示细胞核及细质浆表达β -catenin(MaxVision,×200)Fig 7 Both nuclei and cytoplasm of the epithelial component in PB are positive for β-catenin (MaxVision,×200)

图8 肺母细胞瘤EGFR 基因突变检测Fig 8 There was no signal of the genetic mutation of EGFR could be detected
2.4 随访结果
6 例成人患者中1年内死亡2 例;2 ~3年内死亡2 例;1 例生存期已满5年,无复发迹象;另外1例随访11 个月,现因出现胸膜及骨的肿瘤转移再次入院,2014年12月仍在治疗中。儿童型肺母细胞瘤患者1 例在术后进行化疗,已经存活12 个月;另1 例在手术后未进行治疗,出院4 个月后死亡。
3 讨 论
3.1 组织来源及病理类型
PB 的组织来源仍有争议,有学者认为由中胚层和内胚层共同发生,PB 的间质成分来源于中胚层,上皮成分来源于内胚层,在此基础上肿瘤可向不同方向分化;也有学者认为PB 起源于单一的多潜能干细胞,全基因组等位基因失衡研究也揭示双相型PB 的单克隆起源,肿瘤内部的异质性是由于每一种成分所累积的基因改变不同而导致其组织学分化的差异[3]。目前肺母细胞瘤分为3 种类型:上皮型肺母细胞瘤/分化好的胎儿型腺癌(WDFA),胸膜肺母细胞瘤(PPB)和经典的双相型肺母细胞瘤(CBPB)。WDFA 是由Kradin 等[4]在1982年提出,根据2004年WHO 分类被列入肺变异型腺癌亚型,2011年国际肺癌研究协会/美国胸科学会/欧洲呼吸学会国际多学科肺腺癌分类仍沿用此名字[5]。PPB 由Manivel 等[6]在1988年提出,绝大多数发生于儿童,不仅发生于肺部,也发生于肺外组织如胸膜和纵隔,目前被认为是与成人型肺母细胞瘤不同的肿瘤实体。CBPB 是双相分化亚型,被WHO 分类列入肺肉瘤样癌亚型。
3.2 临床特征
CBPB 和WDFA 主要发生于成年人,40 ~50 岁多见,男性略多于女性,常有吸烟史,本组4 例男性成人病例均有长期吸烟史;PPB 好发于婴幼儿,约93%的患者<6 岁,男女性别没有明显差异,约1/4是遗传性的[7]。各型PB 临床表现主要为咳嗽、咯血、胸痛等,约40% 患者无症状[8]。影像学检查CBPB 和WDFA 多表现为肺单发周围型肿块,边界清楚,肿瘤边缘多无粗毛刺或分叶,纵隔及肺门淋巴结转移少见;PPB 通常发生于胸膜下的肺实质,表现为肺内单发的巨大单囊或多囊性肿物,也有一些表现为囊实混合性或实性肿物,边界清楚,缺乏特异性征象[9]。
3.3 病理特点
WDFA 由类似胎儿肺的分化好的管状或分支管状腺体构成,在某些区域瘤细胞可形成筛状或菊形团样结构;瘤细胞呈立方形或柱状,无纤毛,单层或假复层排列,胞质呈弱嗜酸性或因富于糖原而透亮,核下和核上的糖原空泡使腺体形态似子宫内膜样,细胞核为均一的圆形或卵圆形、染色淡;在肿瘤性腺体基部或腺体间常见圆形桑葚体,由富含嗜酸性细颗粒状胞质的多角形细胞组成;肿瘤的间质量较少、分化成熟[10];免疫组化CK、EMA (+),部分瘤细胞尤其是桑葚体细胞团常有Nse、CgA、Syn(+),提示它们可能为神经内分泌分化的始基。本组病例中桑葚体结构神经内分泌标记CgA、Syn 呈现不同程度的阳性,但Nse 均为阴性,其意义有待于进一步探查。CBPB 是由类似于WDFA 的上皮成分和原始间叶成分共同构成,偶尔有灶状软骨肉瘤或横纹肌肉瘤分化;上皮成分散在分布于幼稚的原始间叶成分中,间叶细胞呈圆形、短梭形及星芒状,胞质少、核深染,可有黏液样变;免疫组化染色显示上皮成分表达情况同WDFA,间叶成分除表达vimentin 外,有的亦表达SMA、desmin 及S100 蛋白。PPB 分为3 型:Ⅰ型为多囊型,呈多房囊性结构,囊腔内衬成熟呼吸道上皮,上皮下为原始恶性小细胞,可表现为连续或不连续的形成层样区,常伴横纹肌母细胞分化,发现像胎儿软骨的小结节或透明变性的间质间隔是其特点,在Ⅰ型中还有一退化亚型,表现为囊壁内仅含有少量梭形细胞及营养不良性钙化灶,缺乏原始恶性细胞形成层,这一亚型仅有8% 进展为Ⅱ型或Ⅲ型[11];Ⅱ型为多囊伴实性结节型,是在Ⅰ型基础上出现了局灶实性区,由成片的无明显分化的原始小细胞、胚胎性横纹肌肉瘤或伴有斑块、结节形成的束状梭形细胞肉瘤构成;Ⅲ型为实性型,具有混合性母细胞瘤和肉瘤的特点,其细胞往往呈幼稚的圆形或梭形,组织学组成一般包括胚基样岛、恶性软骨结节、横纹肌肉瘤灶;免疫组化学显示瘤细胞表达vimentin,如有横纹肌分化,则desmin、MyoD1、Myoglobin阳性,如有软骨分化,则S100 阳性,而上皮标记CK、EMA 染色阴性。
3.4 鉴别诊断
CBPB 需要与肺的癌肉瘤鉴别,后者多见于老年人,一般为中心型,癌成分可为低分化鳞癌或腺癌,肉瘤成分可表现为纤维肉瘤、恶性纤维组织细胞瘤或肌源性肉瘤等,两种成分均有明显异型性,缺乏幼稚性。WDFA 首先要与肺原发普通型腺癌鉴别,后者细胞异型性显著,排列结构较复杂,呈腺泡状、乳头状等,缺乏胚胎性腺上皮、子宫内膜样腺体及桑葚体结构,此外文献报道β -catenin 在WDFA 中瘤细胞核、质内均表达,而在普通型腺癌中不表达,有助于两者的鉴别[12],本组4 例CBPB 的上皮成分和2 例WDFA 瘤细胞中细胞核、细胞质均表达β -catenin(图7),而对照组肺普通型腺癌表达阴性,提示β - catenin 可作为鉴别诊断的标记物;其次因WDFA 与子宫内膜腺癌组织像相似,并且桑葚体与子宫内膜腺癌的鳞状化生也很相似,因此对于女性患者还要询问有无子宫内膜腺癌的病史,排除转移可能,此外TTF1 在WDFA 中表达阳性,而在子宫内膜腺癌中不表达也有助于鉴别。Ⅰ型PPB 需要与先天性肺气道畸形相鉴别,后者为末端气道畸形,临床和影像学改变与Ⅰ型PPB 有重叠,镜下以大囊肿为特征,囊壁被覆扁平上皮或者立方上皮,上皮下无原始恶性小细胞成分。Ⅱ型和Ⅲ型PPB 主要需与肺部原发性肉瘤如横纹肌肉瘤和滑膜肉瘤等鉴别,胚胎性横纹肌肉瘤镜下主要为未分化的间叶细胞和早期幼稚发育阶段的横纹肌母细胞,无其他肉瘤成分,而PPB 不但可见横纹肌肉瘤成分,还可见纤维肉瘤、恶性软骨结节等;滑膜肉瘤以双向分化为特点,且上皮成分亦为肿瘤性成分,一般不见原始间叶细胞及横纹肌母细胞分化。
3.5 EGFR 基因突变与肺母细胞瘤
表皮生长因子受体(epidermal growth factor receptor,EGFR)是一种受体型酪氨酸激酶,在许多肿瘤中过表达和(或)发生突变,通过信号转导促进肿瘤生长,并与肿瘤的侵袭和转移等密切相关。国内多项研究显示,在中国未经选择的非小细胞肺癌中约有30%,腺癌中约有42. 5%,非腺癌中约有9.5%发生EGFR 基因突变[13]。EGFR 基因突变在CBPB 和PPB 中的研究罕见报道,WDFA 属于肺变异型腺癌亚型。王艳芬等[14]报告3 例WDFA 中未检测到EGFR 基因突变。在本组8 个病例中,EGFR基因突变检测结果也均为阴性,提示PB 可能不同于一些经典类型的非小细胞肺癌,不易使用常规EGFR 酪氨酸激酶抑制剂类靶向药物如吉非替尼等进行治疗。但由于本组病例数量少且部分病例蜡块存放时间超过20年,不能排除其对EGFR 突变检测结果的影响,而文献中也缺乏大样本量PB 的EGFR基因突变相关研究,故PB 与EGFR 基因突变的关系仍需今后进一步探讨。
3.6 治疗及预后
目前尚未达成有关PB 治疗的一致意见,迄今为止,外科手术仍是主要治疗方式,常联合化疗和放疗。大多数学者认为PB 有高度侵袭性,因此手术不宜保守,应以肺叶切除术加淋巴结清扫术作为常规术式,慎用楔形切除术[15]。PB 预后较差,5年生存率16%,10年生存率8%,预后与其病理类型、肿瘤分期、肿瘤部位等有关[16]。WDFA 预后较CBPB和PPB 好,PPB 侵袭性较强,预后最差,中位生存期仅14 个月[17]。不同病理类型的PB 其生物学特性差异较大,需进一步明确其生物学特性从而对其有更深入认识。
[1] Robert J Smyth,Aurelie Fabre,Johnathan D Dodd,et al.Pulmonary blastoma:a case report and review of the literature[J].BMC Res Notes,2014,7:294.
[2] Van Looa S,Boeykensb E,Stappaertsb I,et al. Classic biphasic pulmonary blastoma:A case report and review of the literature[J].Lung Cancer,2011,73:127 -132.
[3] Ramakant Dixit,Nalin Joshi,Lokendra Dave. Biphasic pulmonary blastoma:An unusual presentation with chest wall,rib,and pleural involvement[J].Lung India,2014,31(1):87 -89.
[4] Kradin RL,Young RH,Dickersin GR,et al. Pulmonary blastoma with argyrophil cells and lacking sarcomatous features(pulmonary endoderma tumor resembling fetal lung)[J].Am J Surg Pathol,1982,6(2):165 -172.
[5] Travis WD,Brambilla E,Noguchi M,et al.International association for the study of lung cancer/American thoracic society/European respiratory society international multidisciplinary classification of lung adenocarcinoma[J]. J Thorac Oncol,2011,6(2):244 -285.
[6] Manivel JC,Priest JR,Watterson J,et al. Pleuropulmonary blastoma. The socalled pulmonary blastoma of childhood[J].Cancer,1988,62(8):1516 -1526.
[7] 徐升,刘光,王瑾,等.婴儿胸膜肺母细胞瘤临床病理观察[J].诊断病理学杂志,2012,19(1):19 -22.
[8] Magistrelli P,Ambra LD',Berti S,et al. Adult pulmonary blastoma:Report of an unusual malignant lung tumor[J].World J Clin Oncol,2014,5(5):1113 -1116.
[9] Park JS,Lee Y,Han J,et al.Clinicopathologic outcomes of curative resection for sarcomatoid carcinoma of the lung[J].Oncology,2011,81(3 -4):206 -213.
[10] El Ouazzania H,Jnienea A,Bouchikhb M,et al. Well -differentiated fetal adenocarcinoma:A very uncommon malignant lung tumor[J]. Rev Port Pneumol,2012,18(1):39 -41.
[11] Amjad Ali Khan,Ahmed Kamal El - Borai,Mohammad Alnoaiji. Pleuropulmonary Blastoma:A Case Report and Review of the Literature[J]. Case Rep Pathol,2014,2014:509086.
[12] Li JZ,Bai XH,Zou YF,et al.Aberration of the Wnt signaling pathway in pulmonary fatal adenocarcinoma:a case report[J].Chin J Cancer Res,2014,26(1):13 -16.
[13] 冯勤,李向红,陈钊,等.非小细胞肺癌表皮生长因子受体基因突变检测及其与临床病理特征的相关性[J].中华病理学杂志,2011,40(10):660 -663.
[14] 王艳芬,刘标,徐艳,等.肺低级别胎儿型腺癌3 例临床病理观察[J].诊断病理学杂志,2014,21(1):19 -22.
[15] Xu XX,Du Y,Yang HF,et al. Pulmonary blastoma:One case report and review of the literature[J].Eur J Radiol,2010,75(3):97 -99.
[16] Camerlingo R,Franco R,Tirino V,et al. Establishment and phenotypic characterization of the first human pulmonary blastoma cell line[J]. Lung Cancer,2011,72(1):23 -31.
[17] Maeda R,Isowa N,Onuma H,et al. Biphasic pulmonary blastoma with rapid progression[J]. Gen Thorac Cardiovasc Surg,2009,57(2):104 -107.

