胃肠间质瘤c-kit 基因表达和外显子11 突变与临床病理关系的研究
姬荣伟,李 晖,王莉芬,唐 颖
(1.西安西电集团医院 病理科,陕西 西安710077;2.郑州大学西亚斯国际学院护理学院,河南 新郑451150;3.大连医科大学附属第二医院 病理科,辽宁 大连116027)
胃肠间质瘤(gastrointestinal stromal tumor,GIST)是近十年来逐渐被认识的独立的临床病理实体,它包括了以往大部分的胃肠道平滑肌瘤、平滑肌肉瘤、神经鞘瘤等,是发生于胃肠道的最常见的间叶源性肿瘤,占胃肠道肿瘤的1% ~4%,近年来其发病率有增高的趋势[1]。目前,多数病理学家和临床肿瘤学家都认为,所有GIST 都有转移的风险,只有低危恶性的GIST,没有绝对良性的GIST[2]。GIST对常规化疗和放疗极不敏感,治疗主要依赖于手术,但术后复发与转移率较高,可以产生众多的带瘤生存患者,常常需要对肿瘤实施多次手术。目前一致认为,GIST 的主要发病机制是c - kit 原癌基因突变,导致酪氨酸激酶持续活化,细胞增殖、分化失控所致[3]。研究表明c -kit 基因突变位点主要在外显子9、11、13、17,其中以外显子11 最为常见。外显子11 突变与GIST 的生物学行为、预后以及药物治疗效果密切相关。有关c-kit 基因表达和基因突变与GIST 临床病理特点的关系,研究报道较多,但结果差异较大,尤其外显子11 突变与c-kit 基因表达量以及它们与GIST 临床病理的关系,研究报道较少。本研究的目的是从蛋白水平和mRNA 转录水平研究胃肠间质瘤c -kit 基因表达和外显子11 突变与临床病理的关系,尤其外显子11 突变和c -kit基因表达之间的关系,探讨从基因表达(蛋白和mRNA)水平预测c -kit 基因突变和肿瘤生物学行为的可能性,为GIST 的治疗和判断预后提供参考依据。
1 材料和方法
1.1 研究对象
选取2010—2014年大连医科大学附属第二医院病理资料完整、诊断明确的GIST 组织蜡块60 例(其中包括2009年手术切除新鲜GIST 组织标本15例),对照组标本为正常胃壁组织、胃平滑肌瘤、胃神经鞘瘤及胃神经纤维瘤各1 例。所有患者术前均未接受化疗和放疗。
1.2 药物和试剂
兔抗人CD117 多克隆抗体工作液(基因科技有限公司)。P0013 Western 及IP 细胞裂解液、P0012A SDS-PAGE 凝胶配置试剂盒(碧云天生物技术研究所)。总RNA 提取试剂(invitrgen 公司)。K1611 反转录试剂盒、外显子11 RT-PCR 引物(上海生物工程技术服务有限公司)。GAPDH 引物、150 bpDNA Ladder Marker 和DR001AM taq 酶(宝生物工程有限公司)。
1.3 主要仪器
MG25 +基因扩增仪(杭州朗基科学仪器有限公司)。KDC -160HR 高速冷冻离心机(科大创新股份有限公司中佳分公司)。PCR 仪(香港Termo Hybaid)。琼脂糖电泳仪JM - 250 型、单垂直板式PAGE 电泳仪MV - Ⅲ型(大连捷迈科贸有限公司)。UV-2450 岛津紫外可见分光光度仪(岛津国际贸易有限公司)。
1.4 方 法
1.4.1 GIST 分化程度和侵袭危险性分级:根据肿瘤细胞的密度、异型性、有无出血和坏死等,将肿瘤分为高分化组和低分化组;同时采用2006年Miettinen 分级方案[4]进行GIST 危险性分级,在核分裂最活跃的区域随机观察50 个高倍镜视野(HPF)计数核分裂。
1.4.2 免疫组织化学染色检测KIT(即CD117)的表达:按照EnVision 二步法试剂盒说明,同时以PBS代替一抗作阴性对照。KIT 阳性判断标准:KIT 表达部位为细胞质或细胞膜,阳性表达呈黄色或棕黄色颗粒。根据染色强度由淡黄色至棕褐色定为(+)~(+ + +)。
1.4.3 蛋白质免疫印迹(Western -blot)检测KIT的表达:对手术切除15 例新鲜GIST 组织标本提取全蛋白。40 μg 总蛋白质进行10%SDS -PAGE 分离,电转移至NC 膜 上,印迹膜用5%脱脂奶粉4 ℃封闭过夜,1∶100稀释的兔抗人KIT,1∶100稀释的兔抗人Actin 一抗37 ℃水浴箱保温2 h,TBS 洗涤3次,每次5 min。1∶2000稀释的羊抗兔二抗室温摇床温育1 h,TBS 洗涤3 次,DAB 避光显色。结果扫描,用Quantity One 图像分析软件进行灰度分析,以目的条带(KIT)与内参(Actin)条带灰度值的比值判断KIT 蛋白的表达量。实验重复3 次。
1.4.4 半定量RT -PCR 检测KIT 的mRNA 表达水平:对手术切除15 例新鲜GIST 组织标本及3 例石蜡包埋标本提取总RNA。3 μg 总RNA 用K1611反转录试剂盒合成cDNA。PCR 反应条件如下:95℃4 min 预热变性;然后进行35 个循环,循环参数为94 ℃30 s,56 ℃30 s(石蜡包埋组织则为50 ℃30 s),72 ℃30 s;72 ℃10 min。RT -PCR 产物经1%琼脂糖凝胶电泳(含0.5 μg/mL 溴化乙锭),紫外凝胶成像系统观察结果并照相,用Quantity One图像分析软件进行灰度分析,以目的条带(外显子11)与内参条带(GAPDH)的比值判断c - kit 基因mRNA 表达量。实验重复3 次。所用引物见表1。
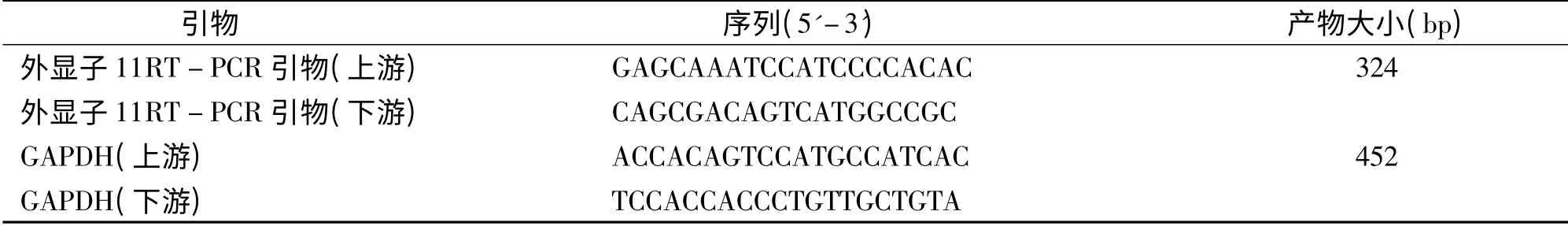
表1 RT-PCR 引物序列Tab 1 RT-PCR primer sequence
1.4.5 聚合酶链式反应-单链构象多态(PCR -SSCP)法进行c-kit 基因外显子11 突变判定:对石蜡包埋标本及手术切除15 例新鲜GIST 组织标本提取基因组DNA 并制备c-kit 基因外显子11PCR 产物(外显子11 引物设计参照文献[5],上游序列:5’CCAGAGTGCTCTAATGACTG 3’,下 游 序 列:5’TGACATGGAAAGCCCCTGTT 3’,全 长225 bp)。PCR 反应条件如下:95 ℃4 min 预热变性,然后进行40 个循环,循环参数为94 ℃30 s,52 ℃30 s(石蜡包埋组织为50 ℃30 s),72 ℃30 s,72 ℃10 min。取3 μL PCR 产物进行10%非变性聚丙烯酰胺凝胶电泳,140 V 恒压18 h 后银染色至条带清晰。凡是SSCP 条带有单链条带泳动变位、缺失或多带提示该标本存在突变。
1.4.6 c -kit 基因外显子11 测序对PCR -SSCP检测结果进行验证:选择4 例标本,包括PCR -SSCP 结果显示c -kit 基因外显子11 突变1 例、未突变3 例(GIST2 例和对照组1 例),同上制备外显子11 的PCR 产物,送宝生物工程(大连)有限公司测序。
1.5 统计学方法
用SPSS11.5 统计分析软件进行数据分析和统计学处理,不同临床病理特征GIST 患者KIT 蛋白表达的比较应用秩和检验,不同临床病理特征GIST 患者c - kit mRNA 表达的比较采用两独立样本t 检验,不同临床病理特征GIST 患者c-kit 基因外显子11 突变的比较应用秩和检验,检验水准a=0.05。
2 结 果
2.1 不同临床病理特征GIST 患者KIT 蛋白表达强度的比较
60 例GIST 中,KIT 蛋白全部阳性表达,4 例对照组织KIT 蛋白全部阴性表达。不同临床病理特征GIST 患者KIT 蛋白表达强度的比较见表2。
2.2 蛋白质免疫印迹(Western -blot)检测KIT 表达
15 例GIST、4 例对照组的结果显示,GIST 均表达KIT 蛋白,由分子量分别为120 kD 和145 kD 的两条带组成,前者为KIT 前体蛋白,后者为KIT 成熟蛋白(图1);4 例对照组标本均未见KIT 蛋白表达。KIT 前体蛋白、KIT 成熟蛋白表达强度与GIST 临床病理参数的关系见表3。

图1 Western-blot 显示KIT 蛋白表达情况Fig 1 Expression of KIT protein detected by Western-blot
2.3 c-kit 基因mRNA 的表达
RT-PCR 结果显示4 例对照组标本可检测到c-kit基因mRNA 表达;18 例GIST 标本(15 例新鲜组织、3 例石蜡包埋组织)均检测到c -kit 基因mRNA 表达,其表达量明显高于对照组。见图2。
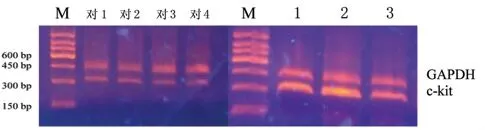
图2 对照组及GIST 组c-kit 基因mRNA 表达Fig 2 mRNA expression of c - kit gene in control groups and GIST groups
2.4 c-kit 基因外显子11 突变检测结果
2.4.1 PCR -SSCP 检测结果:c -kit 基因外显子11 基因组DNA 的PCR 产物经1%的琼脂糖电泳,显示为225 bp 条带(图3)。PCR-SSCP 结果显示,对照组c-kit 基因外显子11 呈两条形状整齐的单链DNA(ssDNA)条带;均未检出外显子11 突变;60例GIST 中共检出c -kit 基因外显子11 突变者31例(突变率52% ),表现为c - kit基因外显子11DNA 单链条带泳动变位、缺失或多带,见图4。经验证,PCR 产物测序结果与PCR-SSCP 结果一致。
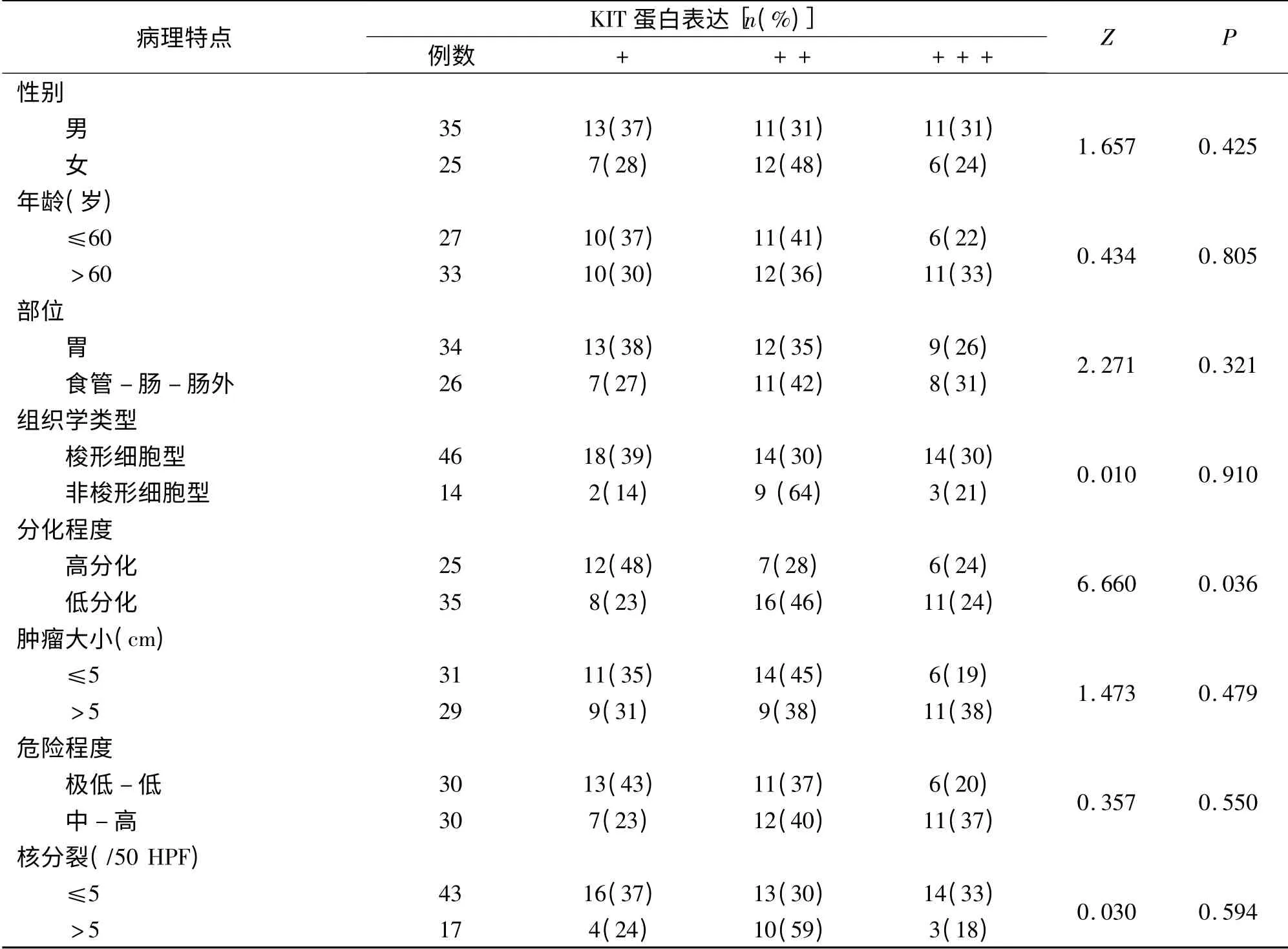
表2 KIT 蛋白表达强度与GIST 临床病理参数的关系Tab 2 Relation between expression intensity of KIT protein and clinical pathological parameters in GIST

图3 c-kit 基因外显子11 PCR 产物Fig 3 c- kit gene exon 11 PCR products
2.4.2 c-kit:基因外显子11 突变与GIST 临床病理特点的关系:c-kit 基因外显子11 突变发生在女性、肿瘤最大径>5 cm、核分裂数>5/50HPF 及中高度侵袭危险性的GIST 外显子11 突变率较高,见表4。
2.5 c-kit 基因外显子11 突变与KIT 蛋白表达的关系
Western-blot 检测KIT 成熟蛋白在c-kit 外显子11 突变与未突变之间的表达量差异有显著性意义(P <0.05),见表5。
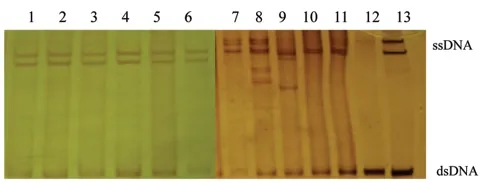
图4 银染PCR-SSCP 显示外显子11 突变检测结果Fig 4 The PCR - SSCP silver stain showed exon 11 mutation test results
2.6 外显子11 突变与c-kit 基因mRNA 表达的关系
外显子11 突变与c -kit 基因mRNA 表达之间未见相关性(P >0.05)。
3 讨 论
c-kit 基因的表达产物KIT 蛋白,作为GIST 的特征性标记物首先得到了人们广泛重视。KIT 蛋白分子量为145 kD,它由细胞外区、跨膜区、近膜区和1 个酪氨酸激酶(TK)区组成。由于KIT 蛋白对GIST 的诊断具有良好的敏感性和特异性,已经成为GIST 病理诊断的主要依据。但是有关KIT 蛋白表达量是否与GIST 的临床病理特点相关,是否可提示GIST 的危险程度及预后等研究较少。曹晖等[6]报道,免疫组织化学研究显示,KIT 蛋白表达水平在恶性、良性GIST 间无明显差异。郑松等[7]的免疫组化结果也显示,KIT 蛋白表达水平在不同危险程度GIST 间无显著性差异。本研究中免疫组化结果显示60 例GIST 全部表达KIT 蛋白,阳性率100%,KIT 蛋白的表达强度在低分化组中高于高分化组(P <0.05),而在GIST 各临床病理参数以及各级侵袭危险程度之间无明显差异,与文献报道一致[6-7]。提示免疫组化方法检测KIT 蛋白表达是诊断GIST的主要依据之一,其表达强度也有提示GIST 分化程度的作用。由于免疫组织化学方法对蛋白表达半定量敏感性较差,因此,本研究用Western -blot 方法对15 例GIST 的KIT 蛋白表达量进行了检测,结果发现,KIT 蛋白呈分子量为120 kD 和145 kD 的两种形式,即KIT 前体蛋白和KIT 成熟蛋白。KIT 成熟蛋白在中-高侵袭危险程度组与极低-低危险程度组表达差异具有显著性意义(P <0.05)。冯菲等[8]报道用Western - blot 方法检测KIT 蛋白,在高、低危险程度组间KIT 蛋白表达量没有差异,但未涉及KIT 前体蛋白和成熟蛋白。本研究发现在GIST 中KIT 蛋白表现为前体(120 kD)和成熟(145 kD)两种形式与文献报道相同[9],前体蛋白是未成熟蛋白,缺少作用于细胞表面所必需的糖基化基团[10],但是有关KIT 成熟蛋白和前体蛋白形式与GIST 临床病理特点以及c -kit 基因突变的关系鲜见报道。本研究组发现KIT 成熟蛋白在中-高侵袭危险组的表达量明显高于极低- 低危险组,提示KIT 成熟蛋白表达量增加在GIST 的发展过程中有着重要作用,可能成为判断GIST 预后的参考指标。有关在转录水平研究c -kit 基因表达与GIST 临床病理特点及生物学行为的关系,文献报道甚少。本研究RT-PCR 检测结果显示,c-kit 基因mRNA 的表达GIST 显著高于平滑肌瘤、神经鞘瘤等,但是其表达量与GIST 临床病理特点之间无明显关系,在GIST 各级危险程度中表达也无明显差异,与文献报道相同[8]。
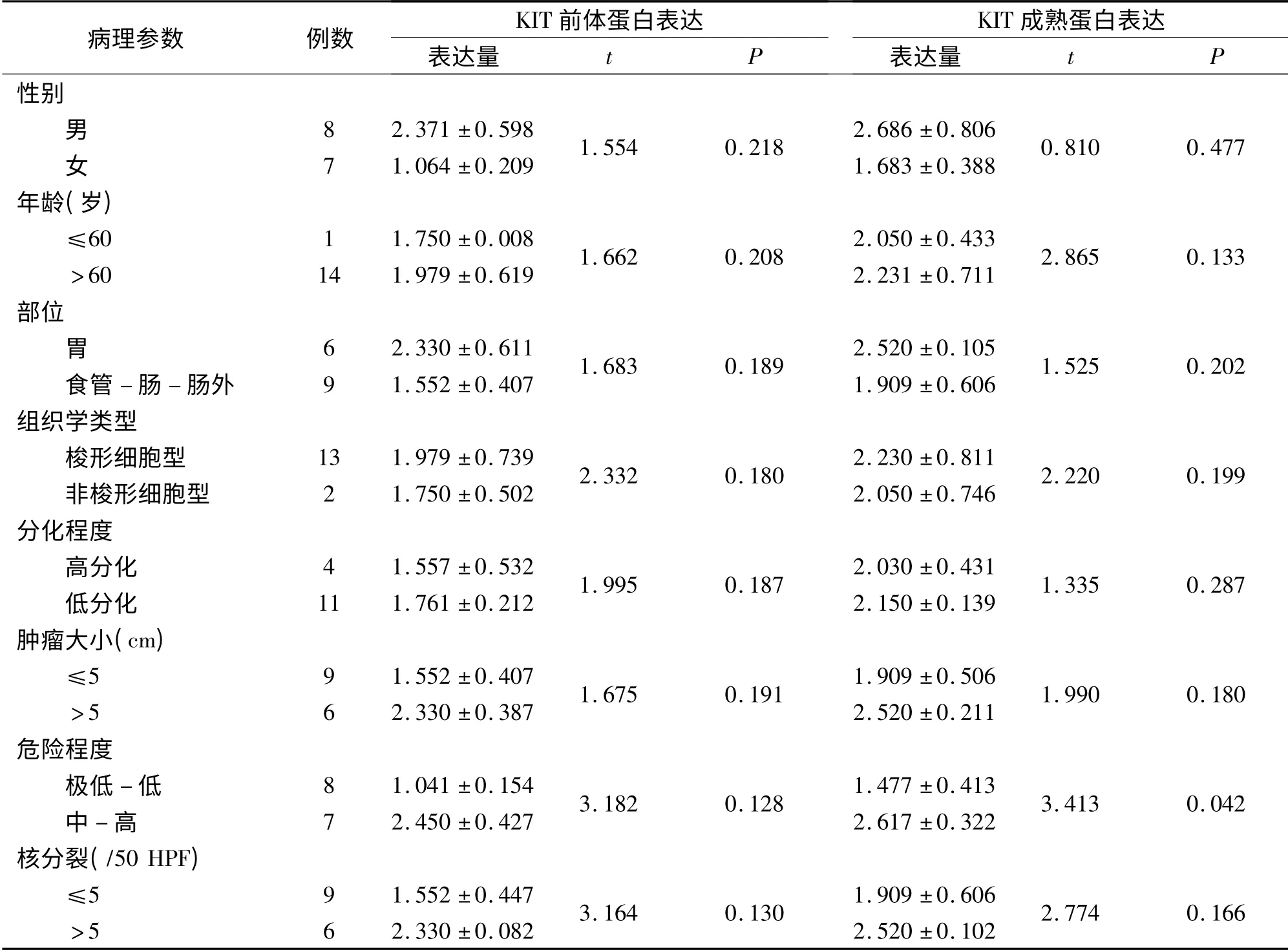
表3 KIT 前体蛋白、KIT 成熟蛋白表达强度与GIST 临床病理参数的关系Tab 3 Comparison on relation between expression intensity separated in KIT precursor protein and mature protein and clinical pathological parameters in GIST
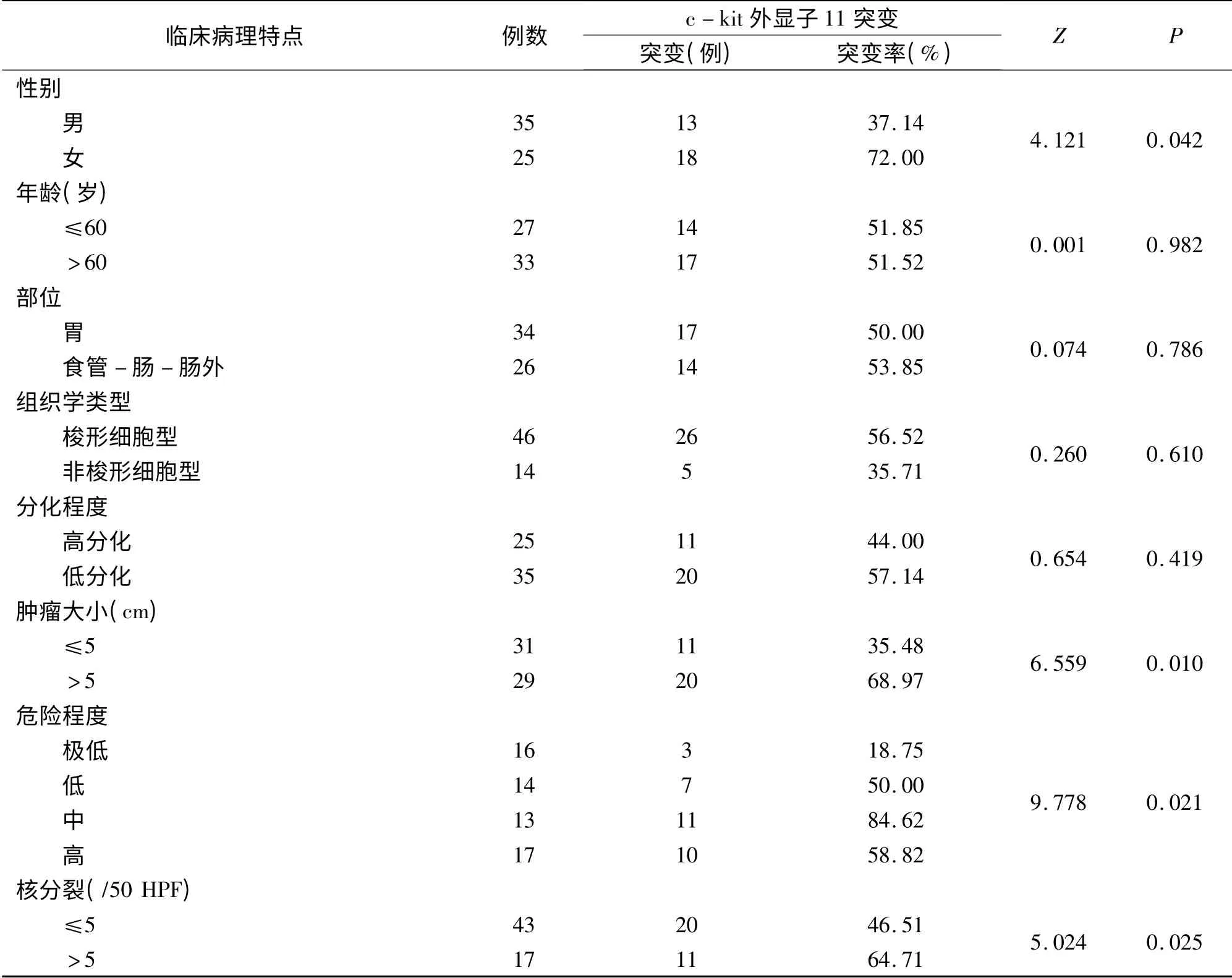
表4 c-kit 基因外显子11 突变与GIST 临床病理特点的关系Tab 4 The relationship between c-kit exon 11 mutation and clinical pathological features in GIST
表5 Western-blot 检测KIT 蛋白表达和c-kit 外显子11 突变的关系Tab 5 The relationship between the expression of KIT detected by Western-blot and c-kit exon 11 mutation (±s)

表5 Western-blot 检测KIT 蛋白表达和c-kit 外显子11 突变的关系Tab 5 The relationship between the expression of KIT detected by Western-blot and c-kit exon 11 mutation (±s)
外显子11 例数 KIT 前体蛋白表达量t P KIT 成熟蛋白表达量t P突变8 1.590 ±0.831未突变 7 0.970 ±0.042 1.000 0.391 2.037 ±0.490 0.810 ±0.057 3.374 0.044
c-kit 基因突变是GIST 发生的主要机制,c -kit 基因位于4q12 ~4q13,编码产物即为KIT 蛋白,是一种跨膜酪氨酸激酶受体,其配体为造血干细胞生长因子(SCF),KIT 蛋白与配体结合后激活酪氨酸激酶,通过信号转导活化细胞内转录因子从而调节细胞生长、分化和增生。研究表明c -kit 基因突变可导致酪氨酸激酶非配体激活,使细胞异常生长[11]。在GIST 中,c -kit 基因突变占所有突变类型的58% ~92%[12],突变位点以外显子11 最为常见。因此,外显子11 突变与GIST 生物学行为及预后之间的关系是近年来的研究热点,大部分研究结果支持外显子11 突变是患者预后不良的提示。也有研究认为外显子11 突变更多地见于恶性程度较低的肿瘤,可能提示患者预后良好[12]。本研究运用PCR-SSCP 方法检测了GIST 中c -kit 基因外显子11 的突变情况,结果显示,60 例GIST 中有31 例发生了c-kit 基因外显子11 突变,突变率为52%,外显子11 突变率分别在肿瘤最大径>5 cm、核分裂数>5/50 HPF 组明显高于肿瘤最大径≤5 cm、核分裂数≤5/50 HPF 组;在高侵袭危险性GIST 组中突变率明显高于低危险性组,结果与文献报道相同[13-14],提示c-kit 基因外显子11 突变在GIST 的发生、发展过程中起着重要作用,可作为GIST 危险程度分级的参考指标。
大量研究表明外显子11 突变的意义还关系到靶向治疗药物甲磺酸伊马替尼治疗GIST 的效果。研究证明外显子11 突变的患者药物治疗缓解率明显高于其它外显子突变及未检出突变的患者[15],并且源于胃的GIST 中外显子11 缺失突变比点突变者有更高的缓解率[16]。由于c -kit 基因直接编码的蛋白即为KIT 蛋白,同时甲磺酸伊马替尼作为一种酪氨酸蛋白激酶抑制剂,作用于不同突变类型患者所产生的不同疗效,使得人们开始寻求c -kit 基因突变与KIT 蛋白表达之间的关系。有研究显示在c-kit 基因突变的肿瘤中KIT 蛋白大多高表达[17],但目前尚未见有明确的研究结果。本组实验分析了外显子11 突变与c-kit 基因表达之间的关系,结果表明:在免疫组化、半定量RT -PCR 的检测中突变组与未突变组间c-kit 基因表达均无明显差异;但是Western-blot 结果显示,突变组KIT 成熟蛋白表达量高于未突变组,提示KIT 蛋白在GIST 发生、发展过程中所起的作用并非与蛋白表达总量有关,而是与KIT 蛋白的活化状态(磷酸化)有关;同样,c -kit 基因突变对GIST 生物学行为的影响可能与KIT蛋白表达量无明显关系,而是与KIT 蛋白的翻译后成熟和转运密切相关。
由于c-kit 突变致病机制是GIST 的主要发生机制,因此探讨c-kit 基因表达、外显子11 突变与GIST 临床病理特点之间的关系有着重要意义[25]。本研究结果可以为临床判断GIST 的预后和预测靶向治疗药物-伊马替尼的疗效提供有意义的线索和依据。由于本研究例数较少,上述结果有待于扩大样本量进一步研究和验证。
[1] 钱俊波,杨其昌,刘宏斌,等.胃肠道间质瘤的临床诊断[J].中华消化内镜杂志,2008,25(4):198 -200.
[2] 曹晖,汪明.重视野生型胃肠间质瘤的诊断与治疗[J].中华胃肠外科杂志,2014(4):312 -316.
[3] Liegl-Atzwanger B,Fletcher JA,Fletcher CDM. Gastrointestinal stromal tumors[J]. Virchows Arch,2010,456:111 -127.
[4] 史恩溢,侯英勇,谭云山,等.局限性胃肠道问质瘤危险程度分级标准的应用与评价[J]. 中华病理学杂志,2007,36(10):649 -653.
[5] 李超亿,梁小波,马俊杰,等. C-kit 与血小板源性生长因子受体基因突变特征与胃肠间质瘤患者预后的关系[J]. 中华胃肠外科杂志,2012,15(3):271 -275.
[6] 曹晖,汪明.基因突变检测在胃肠间质瘤诊断和治疗中的应用及其价值[J].中华胃肠外科杂志,2013,16(3):208 -211.
[7] 郑松,陈丽荣,罗月球,等.胃肠道间质瘤中c -kit 和血小板源性生长因子受体α 基因的突变及其表达[J].中华普通外科志,2007,22(8):574 -578.
[8] 冯菲,门琼,刘伟强,等.Nestin 及C -kit 在胃肠道间质瘤中的表达及意义[J]. 中华消化杂志,2007,27(5):314 -317.
[9] Tabone-Eglinger S,Subra F,El Sayadi H,et al. KIT mutations induce intracellular retention and activation of an immature form of the KIT protein in gastrointestinal stromal tumors[J]. Clin Cancer Res,2008,14(8):2285 -2294.
[10] Corless CL,Heinrich MC. Molecular pathobiology of gastrointestinal stromal sarcomas[J]. Annu Rev Pathol,2008,3:557 -586.
[11] Liegl-Atzwanger B,Fletcher JA,Fletcher CDM. Gastrointestinal stromal tumors[J]. Virchows Arch,2010,456:111 -127.
[12] Corless CL,Fletcher JA,Heinrich MC,et al. Biology of gastrointestinal stromal tumors[J]. Clin Oncol,2004,22(18):3813 -3825.
[13] 马大烈,刘晓红,白辰光,等.c-kit 基因突变对胃肠道间质瘤预后的影响[J]. 中华外科杂志,2004,42(3):140 -144.
[14] 梁玉梅,李向红,吕有勇,等.胃肠道间质瘤156 例临床病理学特征与预后的分析[J].中华病理学杂志,2007,36(4):233 -238.
[15] Debiec- Rychter M,Dumez H,Judson I,et al. Use of c-kit/ PDGFRA mutational analysis to predict the clinical response to imatinib in patients with advanced gastrointestinal stromal tumours entered on phase I and II studies of the EORTC Soft Tissue and Bone Sarcoma Group[J]. Eur J Cancer,2004,40(5):689 -695.
[16] Miettinen M,Sobin LH,Lasota J. Gastrointestinal stromal tumors of the stomach:A clinicopathologic,immunohestochemical,and molecular genetic study of 1765 cases with longterm follow - up [J]. Am J Surg Pathol,2005,29(1):52 -68.
[17] 王彦丽,赵向荣,白辰光,等.胃肠道间质瘤中PDGFRα和C-kit 基因突变和蛋白表达的关系[J]. 世界华人消化杂志,2007,15(21):2300 -2305.

