氧浓度对人胎盘间充质干细胞生物学特性的影响
杜莉莉,吕润潇,杨晓漪,辛 娜,马廷贤
(1. 中国医科大学 基础医学院 病理生理学教研室,辽宁 沈阳110013;2.第二军医大学附属长海医院 研究生队,上海200433;3. 第二军医大学 研究生队,上海200433;4. 中国医科大学95 期临床医学7年制,辽宁 沈阳110013)
氧是生物生存的必要条件,大部分组织细胞需要氧来产生足够的ATP 以供细胞代谢。目前,体外细胞的培养通常是在体积分数为21%的常氧中进行的,但事实上,正常机体平均氧浓度仅为5%[1],而且人体各组织器官的氧浓度也存在较大差异,血液中氧浓度为10% ~13%[2],软骨细胞生长环境的氧浓度为1% ~7%[3-4],脑组织氧浓度为3% ~14%,肺泡血管氧浓度为14%。有研究者尝试了细胞体外低氧培养,低氧培养更接近体内的生理环境。虽然有文献将接近体内的低氧水平称为缺氧,但实际上缺氧只是相对于常氧培养而言的。低氧培养更符合细胞的生理特性,也更有利于观察细胞在体内的改变。
间充质干细胞(mesenchymal stem cells,MSCs)是成体多功能干细胞,可从骨髓、血液等成人组织中分离得到,具有强大的增殖能力和多向分化潜能,诱导后可分化为脂肪细胞,成骨细胞,软骨细胞等。MSCs 可迁移至损伤组织促进组织修复,在再生医学研究领域获广泛关注。胎盘间充质干细胞(placental mesenchymal stem cells,pMSCs)是近年来新发现的MSCs,其来源广泛、取材简便、对供体无害、无伦理限制,对许多疾病有一定的治疗作用,是很好的MSCs 来源[5-6]。有研究表明低氧可促进人脂肪间充质干细胞的增殖及迁移,而pMSCs 在低氧培养时的生物学特性目前并不十分清楚。
本实验尝试从人胎盘中提取间充质干细胞并进行鉴定,并将细胞在体积分数为21%O2、5%O2、3%O2、1%O2和0.5%O2的条件下培养,观察不同氧浓度对pMSCs 的形态、增殖、迁移及VEGF 分泌表达量的影响,为研究氧浓度对pMSCs 生物学特性的作用提供实验依据。
1 材料和方法
1.1 材 料
缺氧培养箱(美国Thermo Fisher 公司);二氧化碳培养箱(美国Thermo Fisher 公司);医用净化工作台(苏州净化设备厂);低温高速离心机(德国Sigma公司);胎牛血清(美国Gibco 公司);DMEM 培养基(美国Gibco 公司);非必需氨基酸(美国Gibco 公司);L-谷氨酰胺(美国Gibco 公司);青链霉素(美国Gibco 公司);β -巯基乙醇(美国Gibco 公司);0.25%Trypsin-EDTA(美国Gibco 公司);鼠抗人直标单克隆抗体(美国BD 公司);ELISA 试剂盒(美国sigma 公司)。
胎盘间充质干细胞:经产妇同意和伦理委员会认证后,无菌条件下取剖宫产的足月健康新生儿胎盘组织(来源于沈阳市和平区妇幼医院)。
1.2 pMSCs 的提取、传代及鉴定
采用组织块培养法提取原代pMSCs。无菌条件下剪开胎盘蜕膜,选择胎盘胎儿面,用小剪刀去掉结缔组织并剪为1 mm3左右的组织块,用含10%青链霉素的PBS 反复冲洗,将组织块均匀接种于10 cm培养皿,加含10%FBS 的DMEM 8 mL,37 ℃、5%CO2及饱和湿度孵箱内培养,5 d 换液1 次,第10 天组织块周围有细胞爬出,并逐渐增多。待爬出细胞长至培养皿底70%~80%时去除组织块,0.25%胰蛋白酶消化细胞并传代,以后每隔3 ~5 d 传一代。取第3 代pMSCs,倒置显微镜下观察细胞形态特征,并进行细胞表面标志检测。
收集第3 代pMSCs,细胞计数后取各管为1 ×106细胞,小鼠血清5 mL 封闭15 min 后,分别加入鼠抗人PE 标记单克隆抗体HLA-DR,FITC 标记抗体CD31,CD34,CD44,CD45,CD29 各20 μL,分别设PE、FITC 空白对照组,4 ℃避光孵育30 min,PBS 洗涤1 次,1000 r/min 离心10 min,弃上清,加入200 μL PBS 吹打混匀细胞,流式细胞仪检测细胞表型。
1.3 倒置显微镜观察不同氧浓度下pMSCs 的形态
实验分组:实验分为低氧培养和常氧培养两部分。常氧组为21%O2,低氧部分再分为5%O2组;3%O2组;1%O2组;0.5%O2组。取第3 代pMSCs 消化后,用含10%FBS 的DMEM 培养液调整细胞浓度接种于35 mm 培养皿,每个培养皿加入2 mL 细胞悬液,接种细胞数为0.3 ×106个。按照分组情况,分别将培养皿放入不同氧浓度的培养箱中。培养72 h 后,取出细胞,倒置显微镜下观察细胞形态。
1.4 MTT 检测不同氧浓度对pMSCs 增殖的影响
取第3 代pMSCs 消化后,用含10% FBS 的DMEM 培养液配制成4 ×104个/mL 的细胞悬液。将细胞接种于96 孔板中,每孔加入200 μL 细胞悬液,每组设5 个复孔。按照分组情况,将细胞放置于不同氧浓度的培养箱中,72 h 后,每孔加入5 mg/mL的MTT 20 μL,37 ℃孵育4 h,弃去孔内培养液,每孔加入150 μL 二甲基亚砜,振荡10 min,充分溶解后于酶标仪490 nm 处测定各孔调零后的光吸收度值(OD 值)。
1.5 划痕实验检测不同氧浓度对pMSCs 迁移能力的影响
用marker 笔在24 孔培养板背侧划线,0. 5 ~1.0 cm 一道,划线横穿孔,用0.25%胰酶消化第3代pMSCs,调整细胞浓度后接种于24 孔板,5 ×104个/孔,过夜,第2 天用200 μL 枪头垂直划痕,PBS洗3 次后换10%血清DMEM 培养液,置于37 ℃,5%CO2、饱和湿度的培养箱0 h、12 h 及24 h 后照相。
1.6 ELISA 检测不同氧浓度对pMSCs 分泌VEGF的影响
用0.25%胰酶消化第3 代pMSCs,调整细胞浓度2×105个/mL,取100 μL 细胞悬液接种于96 孔板,将细胞放置于不同氧浓度的培养箱中,72 h 后收集细胞上清,按照说明书,ELISA 检测VEGF 的含量。
1.7 统计学方法
利用SPSS 19.0 软件进行单因素方差分析,所有实验数据均重复3 次以上,数据用±s 表示,P <0.05 为差异有统计学意义。
2 结 果
2.1 pMSCs 的提取、传代及鉴定
胎盘组织块接种后,约10 d 组织块周围有少量细胞爬出,短梭形。随后细胞密度增加,细胞逐渐伸展(图1A)。传代后细胞形态趋于一致,第3 代pMSCs 为梭形,胞体大而扁平,类似于成纤维细胞。细胞排列规则(图1B)。利用流式细胞仪对第3 代pMSCs 进行细胞表面标志检测,结果表明:pMSCs 阳性表达CD29 及CD44(图2),而CD31、CD34、CD45及HLA-DR 呈阴性。
2.2 不同氧浓度对pMSCs 形态的影响
常氧时pMSCs 多为梭形,偶见多角形(图3A)。不同浓度低氧培养中的pMSCs 形态相似,细胞纵向伸展,呈长梭形,细胞形态更均一,排列更整齐,漩涡状排列更明显(图3B ~E)。

图1 组织块培养第10 天及第3 代pMSCs (×100)Fig 1 Tissue cultured for 10 days and the third passage pMSCs (×100)
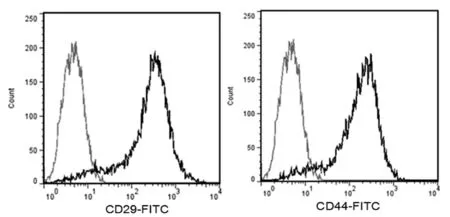
图2 流式细胞检测pMSCs 的CD29 及CD44 表达Fig 2 CD29 and CD44 expression of pMSCs by flow cytometry

图3 pMSCs 在常氧及低氧培养中的形态Fig 3 Morphology of pMSCs in normoxic or hypoxic culture
2.3 不同氧浓度对pMSCs 增殖的影响
与常氧培养的pMSCs 相比,5%O2,3%O2及1%O23 组中pMSCs 的增殖能力均明显增强,差异有显著性意义,P <0.05;0.5%O2中的pMSCs 增殖能力明显减弱,差异有显著性意义,P <0.05。低氧培养中,1%O2pMSCs 的增殖能力明显强于3%O2组及5%O2组;3%O2pMSCs 的增殖能力强于5%O2组,差异均有显著性意义,P <0.05。见图4。
2.4 不同氧浓度对pMSCs 迁移能力的影响
划痕实验24 h 后,常氧培养的pMSCs 有部分细胞发生迁移。与常氧pMSCs 相比,5%O2,3%O2及1%O2培养的pMSCs向划痕区迁移的细胞明显增多,且氧浓度越低,迁移细胞越多。而0. 5%O2中pMSCs 向划痕区迁移的细胞与常氧组相比,无明显差异。见图5。

图4 pMSCs 在不同氧浓度下的增殖能力Fig 4 The proliferation of pMSCs in different oxygen concentrations

图5 pMSCs 在不同氧浓度下的迁移能力Fig 5 The migration ability of pMSCs in different oxygen concentrations
2.5 不同氧浓度对pMSCs 分泌VEGF 的影响
与常氧培养的pMSCs 相比,5%O2,3%O2及1%O2中pMSCs 分泌VEGF 的能力明显增强,差异有显著性意义,P <0.05。3%O2组pMSCs 分泌VEGF 多于5%O2组;1%O2组pMSCs 分泌VEGF 多于3%O2组,差异均有显著性意义,P <0.05。与常氧培养的pMSCs 相比,0.5%O2组pMSCs 分泌的VEGF 明显减少,差异有显著性意义,P <0.05。见图6。
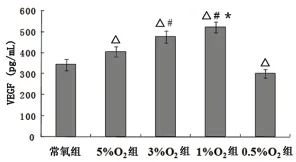
图6 pMSCs 在不同氧浓度下VEGF 的分泌表达量Fig 6 The secretion of VEGF by pMSCs in different oxygen concentrations
3 讨 论
MSCs 是近年来发现的干细胞,增殖能力强,并可分化为多种细胞,对许多疾病有治疗作用,在再生医学中有很好的应用前景。胎盘是产后“废弃物”,胎盘中也存在MSCs,pMSCs 因增殖能力强且取材对人体无损伤,符合伦理要求,成为当前MSCs 研究的热点,是组织工程理想的细胞来源。氧是调节细胞生理功能的重要因素[7]。细胞的体外培养通常是在常氧(21%O2)条件下完成,但是正常机体平均氧浓度为5%,因此,体外常氧培养并不符合细胞在体内所处的低氧微环境。研究表明,MSCs 输入体内后可对许多疾病产生治疗作用,但其作用机制并未完全阐明。了解MSCs 在体内低氧环境中的生物学特性对于阐明其作用机制有重要意义。以往关于MSCs 低氧培养的研究,主要集中在脂肪间充质干细胞和骨髓间充质干细胞,关于低氧培养pMSCs 的相关研究较少。本实验从胎盘中提取间充质干细胞,在不同的氧浓度中培养,检测pMSCs 在低氧时的形态,增殖,迁移,VEGF 分泌表达量的改变。
本实验成功地提取并鉴定人胎盘间充质干细胞。实验结果表明,常氧时pMSCs 多为梭形,偶见多角形。低氧培养时pMSCs 形态更均一,纵向伸展呈长梭形,细胞排列更整齐,漩涡状排列更明显。不同浓度低氧培养的pMSCs 形态无明显差别。
有研究发现低氧抑制MSCs 增殖,但更多研究表明低氧促进MSCs 增殖。Dos Santos 及Hung等[8-9]发现低氧(1% ~2%O2)短期内即促进BMSCs 迅速增殖。因此推测适度低氧促进BMSCs 增殖,但促增殖的低氧浓度及培养时间还有待进一步研究。本研究结果表明,与常氧组相比,5%O2,3%O2及1%O23 组的pMSCs 增殖能力明显增强,且氧浓度越低,pMSCs 增殖能力越强。而0. 5% O2组pMSCs 的增殖速度明显慢于常氧组。因此推断,一定范围内的低氧促进pMSCs 增殖,在该范围内,氧浓度越低,pMSCs 增殖能力越强。超出该范围的低氧则抑制pMSCs 增殖。
MSCs 只有归巢到损伤组织才会产生治疗作用,细胞迁移是归巢的前提。研究表明低氧促进pMSCs迁移。王立维等[10]的Transwell 迁移实验结果表明在1%O2时BMSCs 的迁移能力较20%O2时明显增强。Saller 等[11]发现在三维培养体系中2%O2培养的BMSCs 迁移速率较21%O2明显增快。本研究结果表明,在相同时间内,5% O2,3% O2及1% O2组pMSCs 迁移到划痕区的细胞数明显多于常氧组,且氧浓度越低,迁移的细胞数越多。而0.5%O2组的pMSCs 迁移细胞数与常氧组相比,无明显区别。因此推测一定范围内的低氧促进pMSCs 迁移。
现认为,干细胞迁移到损伤组织产生的治疗作用更多的是由其分泌的细胞因子完成的。有研究表明,低氧可促进人脂肪间充质干细胞血管内皮生长因子、肝细胞生长因子的分泌,1%O2时促进作用最为显著。本实验ELISA 结果显示,5%O2,3%O2及1%O2组pMSCs 的VEGF 分泌表达量明显多于常氧组,且氧浓度越低,VEGF 分泌越多。而与常氧组相比,0.5%O2组pMSCs 分泌的VEGF 明显减少,说明在一定范围内的低氧促进pMSCs 分泌VEGF。
本实验只是对缺氧培养pMSCs 生物学特性的初步探索,还有许多问题需要进一步明确。如低氧时pMSCs 的凋亡及其他细胞因子的分泌情况等。研究这些问题,有助于进一步了解pMSCs 在体内的作用机制。本研究为pMSCs 在临床的应用提供了一定的实验依据。
[1] Rylova JV,Andreeva ER,Gogvadze VG,et al. Etoposide and hypoxia do not activate apoptosis of multipotent mesenchymal stromal cells in vitro[J]. Bull Exp Biol Med,2012,154(1):141 -144.
[2] Sullivan M,Galea P,Latif S. What is the appropriate oxygen tension for in vitro culture[J]. Mol Hum Reprod,2006,12(11):653.
[3] Brighton CT,Heppenstall RB. Oxygen tension in zones of the epiphyseal plate,the metaphysis,and diaphysis. An in vitro and in vivo study in rats and rabbits[J].J Bone Joint Surg Am,1971,53(4):719 -728.
[4] Kino-Oka M,Kagita S,Nadzir MM,et al. Direct measurement of oxygen concentration inside cultured cartilage for relating to spatial growth of rabbit chondrocytes[J].J Biosci Bioeng,2010,110 (3):363 -366.
[5] Barlow S,Brooke G,Chatteriee K,et al. Comparison of human placenta- and bone marrow - derived multipotent mesenchymal stem cells[J]. Stem Cells Dev,2008,17(6):1095 -1108.
[6] Brooke G,Tong H,Levesque JP,et al. Molecular trafficking mechanisms of multipotent mesenchymal stem cells derived from human bone marrow and placenta[J]. Stem Cells Dev,2008,17(5):929 -940.
[7] Chacko SM,Ahmed S,Selvendiran K,et al. Hypoxic preconditioning induces the expression of prosurvival and proangiogenic markers in mesenchymal stem cells[J]. Am J Physiol Cell Physiol,2010,299(6):C1562 -C1570.
[8] Dos Santos F,Andrade PZ,Boura JS,et al. Ex vivo expansion of human mesenchymal stem cells:A more eff ective cell proliferation kinetics and metabolism under hypoxia[J]. J Cell Physiol,2010,223(1):27 -35.
[9] Hung SP,Ho JH,Shih YR,et al. Hypoxia promotes proliferation and osteogenic diff erentiation potentials of human mesenchymal stem cells[J]. J Orthop Res,2012,30(2):260 -266.
[10] 王立维,赵渝,黄旭,等. 氧体积分数变化与大鼠骨髓间充质干细胞的增殖及迁移[J]. 中国组织工程研究,2012,16(19):3442 -3446.
[11] Saller MM,Prall WC,Docheva D,et al. Increased stemness and migration of human mesenchymal stem cells in hypoxia is associated with altered integrin expression[J].Biochem Biophys Res Commun,2012,423(2):379 -385.

