GPC3 和CD44v6 在肝细胞癌组织中的表达及其意义
王志东,张骐麒,张子军,孙 萍,蒲春文
(1. 大连市第六人民医院 病理科,辽宁 大连116001;2. 大连市第六人民医院 分子生物学标本库,辽宁 大连116001;3. 大连市儿童医院 检验科,辽宁 大连116012)
肝细胞癌(hepatocellular carcinoma,HCC)是亚洲第二常见恶性肿瘤。而中国作为乙肝大国,在肝炎、肝硬化基础上,随病情加剧而发展成为HCC 的病人众多,占中国肿瘤病死率的第二位[1]。因此寻找新的、灵敏度高、特异性强的肿瘤指标一直是研究的热点。新近研究表明,磷脂酰肌醇蛋白聚糖3(Glypican-3,GPC3)和白细胞分化抗原44 变异体6(CD44v6)参与Wnt 通路的信号转导,且与肿瘤的发生、发展密切相关[2-3]。本研究利用免疫组化等方法对GPC3、CD44v6 在HCC 中的表达进行观察与分析,以探讨这两项指标在HCC 的鉴别诊断方面的临床应用价值。
1 材料和方法
1.1 研究对象
收集大连市第六人民医院病理科2012 -2014年行手术治疗的HCC 标本38 例,均为原发性肝癌患者,其中男性29 例,女性9 例,最大年龄76 岁,最小年龄23 岁,中位年龄54.5 岁。取癌及癌旁2 cm组织,其中癌旁2 cm 组织为肝硬化组织,经病理证实均未发现癌细胞。
1.2 方 法
所有标本均经10%中性福尔马林液固定,常规脱水,石蜡包埋,连续切片厚3 ~5 μm,常规HE 染色及免疫组化染色。免疫组化染色采用EliVision二步法,操作参照试剂说明书进行。一抗GPC3 鼠抗人单克隆抗体(克隆号:MAXIM001MX)、一抗CD44v6 鼠抗人单克隆抗体(克隆号:2F10)及二抗EliVisionTMplus 试剂盒均购自福州迈新生物技术开发公司。同时设PBS 代替一抗的阴性对照。
1.3 结果判定
免疫组化染色采用半定量方法进行判定,即:将染色强度与阳性细胞所占百分比计分乘积定为每一例染色的综合评分,0 ~2 分为(-),3 ~5 分为(+),6 ~9 分为(+ +),10 ~12 分为(+ + +)。(1)细胞染色强度分为:标准无色为0 分,淡黄色为1 分,棕黄色为2 分,棕褐色为3 分;(2)阳性细胞所占百分比分为:无阳性细胞为0 分,阳性细胞≤10%为1 分,阳性细胞11% ~50% 为2 分,阳性细胞51% ~75%为3 分,阳性细胞>75%为4 分。
1.4 统计学方法
实验结果分析均采用SPSS for Windows 17.0 软件分析系统。计数数据采用卡方检验或Fisher 精确检验,相关分析采用Spearman 等级相关。P <0.05为有显著性差异。
2 结 果
2.1 GPC3 的表达
GPC3 主要定位于肿瘤细胞膜与细胞浆中,偶有细胞核表达;在癌旁肝硬化组织中仅有少量细胞膜着色(图1)。在HCC 高分化组、中分化组、低分化组癌组织内的表达阳性率分别为75.0%,87.5%,90.0%(表1)。在癌旁肝硬化组织中无表达。经统计学分析,HCC 高分化组、中分化组、低分化组同癌旁肝硬化组比较,差异均有显著性意义(P <0.05)。在癌组织的表达强度(+、+ +、+ + +)阳性率分别为18.4%、42.1%和23.7%。见表1。
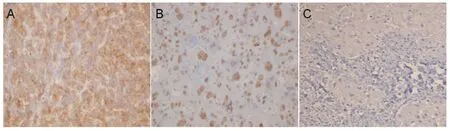
图1 GPC3 在肝癌及癌旁组织中的表达 (×400)Fig 1 The GPC3 expression in HCC and the liver tissue adjacent to carcinoma (×400)
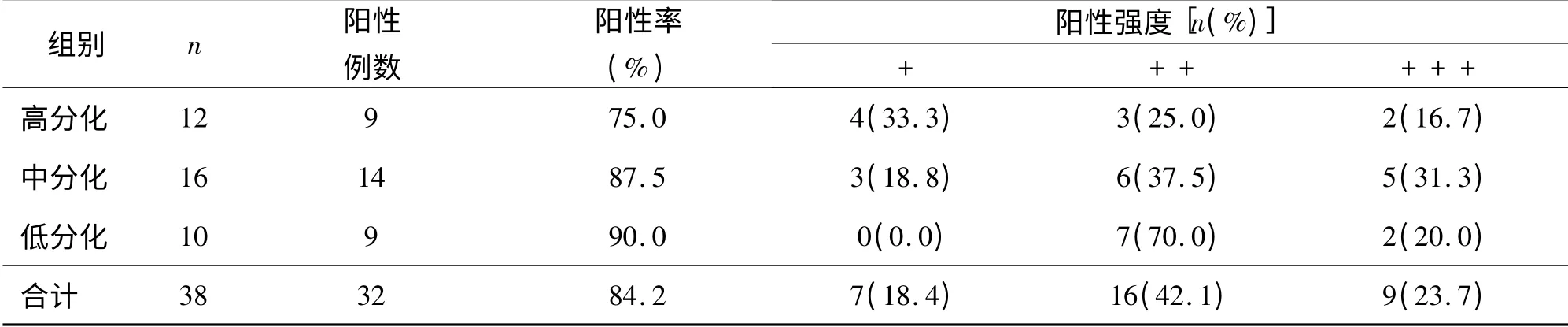
表1 GPC3 在肝细胞癌组中的表达Tab 1 The GPC3 expression in HCC
2.2 CD44v6 的表达
CD44v6 主要定位于癌细胞胞浆和部分组织间质内,呈弥漫或散在分布;向组织内侵袭的癌细胞表达尤为明显,阳性表达呈弥漫或散在分布的棕黄色颗粒,颜色从浅黄色至棕褐色,在癌旁组织中着色极少(图2)。在HCC 高分化组、中分化组、低分化组癌组织中表达的阳性率分别为75. 0%、87. 5%、90.0%(表2)。在癌旁肝硬化组织中无表达。经统计学分析,肝细胞癌高分化组、中分化组、低分化组与癌旁肝硬化组比较差异均有显著性意义(P <0.05)。在癌组织的表达强度(+、+ +、+ + +)阳性率分别为15.8%、44.7%和23.7%。见表2。
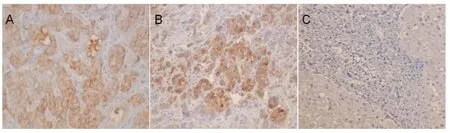
图2 CD44v6 在肝癌及癌旁组织中的表达 (×400)Fig 2 The CD44v6 expression in HCC and the liver tissue adjacent to carcinoma (×400)

表2 CD44v6 在肝细胞癌组中的表达Tab 2 The CD44v6 expression in HCC
2.3 GPC3 与CD44v6 在肝细胞癌组织中表达的相关性
GPC3 与CD44v6 在肝细胞癌中的表达呈显著正相关(r=0.502,P <0.001)。
3 讨 论
Glypican - 3(GPC3)作为磷脂酰肌醇聚糖(glypicans,GPC)家族成员之一,参与调节多数肿瘤细胞的存活、增殖和迁移等生理过程[4-5]。有研究表明,GPC3 在多数肝细胞癌中均有表达,但在相对应的正常组织或良性病变组织中不表达[6]。本研究显示,GPC3 在HCC 中的阳性表达率为84.2%,而癌旁及远肝癌组织无表达,因此,通过免疫组化技术检测GPC3 表达可作为临床病理诊断HCC 的指标之一。
CD44 是具有多重结构与功能的细胞表面糖蛋白分子,通过与蛋白酶的对接、信号转导等途径对细胞产生影响[7]。该基因经过转录剪接,可形成功能不同的多种亚型;其中,对含有v6 外显子的变异体(CD44v6)的研究最为深入,并与肿瘤的转移密切相关[8]。本研究显示,CD44v6 在HCC 中阳性表达率为84.2%,而癌旁及远肝癌组织无表达。Jung 等[9]发现,CD44v6 与胃癌、结肠癌、乳腺癌、宫颈癌、膀胱癌等肿瘤的浸润与转移呈正相关。而Zhang 等[10]发现,随着HCC 恶化程度的发展,肿瘤免疫表型会发生改变,出现E -cad、Cx43 低表达和CD44v6 高表达等现象。因此,CD44v6 的表达对预测HCC 的预后具有一定意义。
在本研究中,单独检测GPC3 或CD44v6 均可作为HCC 的鉴别诊断指标。统计学结果发现,GPC3与CD44v6 在HCC 中的表达呈正相关(r =0.502,P <0.001)。GPC3 和CD44v6 均通过Wnt 信号通路对癌细胞的增殖、侵袭及细胞间的粘合能力发挥作用。Li 等[11]证实,GPC3 不仅是HCC 的标志物,还可通过激活Wnt信号通路促进恶性肿瘤的生长。Song 等[12]通过研究GPC3 敲低鼠胚胎组织也得到相似结论,即GPC3 在调节Wnt 信号通路中发挥重要作用。Todaro 等[13]发现,CD44v6 在结直肠癌干细胞(CR- CSCs)中有表达,并通过激活Wnt/β -catenin 信号通路促进肿瘤细胞的繁殖和转移;同时,提高CD44v6 在CR-CSCs 中的表达会进一步促进癌细胞的迁移与转移。提示,GPC3 联合CD44v6可作为预测HCC 发生指标,二者密切相关,但其相关机制尚不清楚。
[1] Teufel A,Marquardt JU,Galle PR. Next generation sequencing of HCC from European and Asian HCC cohorts.Back to p53 and Wnt/beta - catenin[J]. J Hepatol,2013,58(3):622 -624.
[2] Gao W,Ho M. The role of glypican-3 in reg ulating Wnt in hepatocellular carcinomas[J]. Cancer Rep,2011,1(1):14 -19.
[3] Ni J,Cozzi PJ,Hao JL,et al. CD44 variant 6 is associated with prostate cancer metastasis and chemo - /radioresistance[J]. Prostate,2014,74(6):602 -617.
[4] Peters MG,Farias E,Colombo L,et al. Inhibition of invasion and metastasis by glypican -3 in a syngeneic breast cancer model[J]. Breast Cancer Res Treat,2003,80(2):221 -232.
[5] Aydin O,Yildiz L,Baris S,et al. Expression of Glypican 3 in low and high grade urothelial carcinomas[J]. Diagn Pathol,2015,10:34.
[6] Yao M,Wang L,Dong Z,et al. Glypican-3 as an emerging molecular target for hepatocellular carcinoma gene therapy[J]. Tumor Biol,2014,35(6):5857 -5868.
[7] Goldberg D. Critical reviews in clinical laboratory sciences[J]. Crit Rev Clin Lab Sci,2010,47(1):1 -4.
[8] Fu Y,Geng Y,Yang N,et al. CD44v6 expression is associated with a poor prognosis in Chinese hepatocellular carcinoma patients:A meta - analysis[J]. Clin Res Hepatol Gastroenterol,2015,S2210 -7401(15)00073 - X. doi:10.1016/j.clinre.2015.03.001.
[9] Jung T,Gross W,Zoller M. CD44v6 coordinates tumor matrix-triggered motility and apoptosis resistance[J]. J Biol Chem,2011,286(18):15862 -15874.
[10] Zhang BY,Dai XW,Chen QY,et al. Expression of epithelial-cadherin,CD44v6 and connexin43 in hepatocellular carcinoma[J]. Zhonghua Bing Li Xue Za Zhi,2006,35(10):616 -619.
[11] Li L,Jin R,Zhang X,et al. Oncogenic activation of glypican-3 by c-Myc in human hepatocellular carcinoma[J]. Hepatology,2012,56(4):1380 -1390.
[12] Song HH,Shi W,Xiang YY,et al.The loss of glypican-3 induces alterations in Wnt signaling[J]. J Biol Chem,2005,280(3):2116 -2125.
[13] Todaro M,Gaggianesi M,Catalano V,et al. CD44v6 is a marker of constitutive and reprogrammed cancer stem cells driving colon cancer metastasis[J]. Cell Stem Cell,2014,14(4):342 -356.

