半脾模型在裸鼠结直肠癌肝转移中的实验研究
白景舒,王 健,赵雪峰
(大连大学附属新华医院 普通外科,辽宁 大连116021)
结直肠癌是胃肠道常见的恶性肿瘤,其发病率有逐年增高的趋势[1]。结直肠癌的临床分期是判断预后的重要的因素。近期研究表明,晚期结直肠癌的5年生存率为不足50%,甚至有些病人失去了根治性手术的机会[2]。结直肠癌肝转移的发病率为25%左右,手术切除病灶后5年生存率为25% ~58%,复发率为25%~50%[3]。因此,对于结直肠癌肝转移分子生物机制的研究与新型靶向治疗药物的研发对结直肠癌的治疗具有重要的意义。
目前有诸多抗肿瘤药物用于临床的治疗,并取得了一定的疗效,但仍存在毒副作用大、耐药性强等问题,尚需开发新的针对肿瘤信号传导途径中多环节作用靶点的高效低毒抗肿瘤药物。获得纯度高且量大的抗肿瘤药物的关键是建立有效而稳定的药物筛选模型。本研究组之前构建过符合临床肿瘤转移发生、发展特点的动物模型,也曾研究过大肠癌肝转移机制和抗转移治疗,但治疗途径的选择只能经口或腹腔内灌注[4]。本研究首先建立裸鼠大肠癌肝转移半脾模型,其后经静脉注入常用化疗药物,观察抗肿瘤效能。期待近期会成为评价新型药物抗肿瘤活性的有利药物筛选模型。
1 材料和方法
1.1 实验动物与材料
人结肠癌细胞株HT29 和环磷酰胺(CTX)由韩国CNU 肿瘤研究所Young - Kyu Park 教授捐赠。BALb/c 品系裸鼠30 只,6 周龄雌性,体重18 ~20 g,由韩国CNU 实验动物研究中心提供。
1.2 方 法
1.2.1 细胞培养及悬液制备:人HT29 结直肠癌细胞株在摄氏37 ℃、5% CO2,含10%血清RPMI 1640培养液中传代培养,每2 ~3 d 换1 次培养液。细胞培养至80% ~90%融合时,用0.25%胰酶消化液消化后,1200 r/min 离心3 min,弃上清液,加无血清RPMI 1640 培养液洗细胞2 次,显微镜下计数,用无血清RPMI 1640 培养液调整细胞浓度分别为5 ×106/mL、1 ×107/mL 及5 ×107/mL。制备好的细胞悬液放冰浴保存,于30 min 内分别进行接种。
1.2.2 动物模型设计:制模前1 周为实验动物安定期,防止进行对裸鼠的一切刺激性操作。实验动物共30 只,随机分为15 只低浓度环磷酰胺治疗组(L-CTX 治疗组;CTX 1.0 mg·kg-1)和15 只高浓度环磷酰胺治疗组(H-CTX 治疗组;CTX 4.0 mg·kg-1)。L-CTX 治疗组再分为5 只HT29 大肠癌细胞浓度梯度为5 ×105/100 μL 制模组、5 只HT29 结直肠癌细胞浓度梯度为1 ×106/100 μL 制模组及5只HT29 结直肠癌细胞浓度梯度为5 ×106/100 μL制模组;H-CTX 治疗组也同L -CTX 治疗组分类。CTX 治疗组在制模后3 d 起经远端半脾每隔3 d 进行治疗。L-CTX 治疗组经远端半脾注入浓度1.0 mg·kg-1,而H-CTX 治疗组经远端半脾注入浓度4.0 mg·kg-1。制模30 d 后所有30 只裸鼠进行处死,解剖观察实验结果。
1.2.3 放大镜辅助下结肠癌肝转移半脾模型的建立:根据麻醉预实验结果,选择异氟醚进行全身麻醉。放大镜辅助下(Binocular lens,Heine,Germany)取上腹正中切口长约5 mm,逐层入腹后小心牵拉大网膜并显露脾脏(图1A)。脾脏中央利用一次性钛夹夹闭并切断,分成两个带血管蒂的半脾(图1B)。近端半脾牵出切口外,用31 号无损伤针头迷路进针约2 mm,分组并分别缓慢注入HT29 结直肠癌细胞悬液5 ×105/100 μL、1 ×106/100 μL 及5 ×106/100 μL 至脾被膜下,总量为100 μL,注射部位脾被膜可见发白肿胀,拔针时用止血小纱布轻轻按压30 s(图1C)。10 min 后夹闭、切断近端半脾脏血管(图1D),切除并移除近端半脾(图1E)。切口左侧皮下游离至使皮下形成储存囊,将远端半脾摆放在其囊内,送回部分网膜等附件后,逐层关腹(图1F)。建立模型全程应防止远端半脾血管的损伤,同时也要防止胰腺、胃及重要血管的损伤。
1.2.4 结肠癌肝转移评分标准:根据制模预实验结果,选择制模及治疗后30 d 处死裸鼠,并制定的肝转移评分标准如下:0 为无肝转移;1 为最低限度浸及肝脏,浸润范围≤0.50 cm2;2 为轻度浸及肝脏,浸润范围0.51 ~1.00 cm2;3 为中度浸及肝脏,浸润范围1.01 ~2.00 cm2;4 为重度浸及肝脏,浸润范围>2.00 cm2。
1.2.5 观察指标:每天常规观察记录裸鼠状态,包括饮食、活动量、皮肤状态、排泄物。裸鼠出现频死前症状或观察期满30 d 时予以处死。处死后立即解剖观察腹腔及胸腔内情况,具体记录肝转移评分、有无淋巴结肿大及转移、有无血性腹水、有无腹腔种植转移、肺转移等。
1.3 统计学方法
采用SPSS 13.0 统计软件进行统计学处理。实验数据以Mean ±SD 表示,研究组和对照组的比较采用t 检验和χ2检验进行统计分析,P <0.05 认为差异有统计学意义。
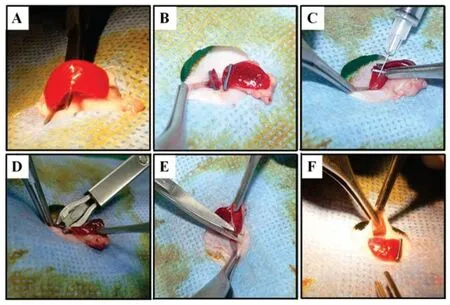
图1 半脾模型Fig 1 Hemispleen model
2 结 果
2.1 不同浓度梯度的结直肠癌细胞制模后肝转移评分
30 只裸鼠结直肠癌肝转移半脾模型成瘤率皆为100%,无一例手术死亡,制模有效。L -CTX 治疗组按大肠癌细胞浓度梯度(5 ×105/100 μL、1 ×106/100 μL 及5 ×106/100 μL),肝转移评分分别为1.80 ±0.45,2.60±0.55 及3.60 ±0.55,其差异有显著性意义(P <0.05),见表1。H-CTX 治疗组也同L-CTX治疗组按结直肠癌细胞浓度梯度分类,肝转移评分分别为0.80±0.55,1.20 ±0.55 及2.40±0.55,其差异也有显著性意义(P <0.05),见表1。
2.2 CTX 治疗效能及模型稳定性比较
30 只裸鼠大肠癌肝转移半脾模型减瘤率皆为100%。大肠癌肝转移半脾模型观察,发现L -CTX治疗组淋巴结肿大或转移(11/15;73.3%)、血性腹水(8/15;53.3%)、腹膜种植转移(3/15;20.0%)及肺转移(1/15;6.7%)。但H-CTX 治疗组无腹膜种植转移及肺转移,而表现出淋巴结肿大或转移(2/15;13.3%)、血性腹水(1/15;6.7%)。L-CTX 治疗组淋巴结转移和血性腹水明显少于H-CTX 治疗组,其差异有显著性意义(P <0.05)。见图2,表2。

表1 不同浓度梯度的结直肠癌细胞制模后肝转移评分比较Tab 1 The liver metastasis scores between two concentrations of CTX in different concentrations of HT29 human colon cancer cells of hemispleen models

图2 半脾模型致肝转移Fig 2 The hepatic metastasis of hemspleen model

表2 不同浓度梯度CTX 治疗效能的比较Tab 2 The therapeutic effects of different concentrations of CTX in hemispleen model (n)
2.3 药物敏感性筛选模型的选定
L-CTX 与H -CTX 治疗组的相互比较中,发现结直肠癌细胞浓度梯度为1 ×106/100 μL 制模相其平均肝转移评分的差值减少最显著,见表1。结直肠癌细胞浓度梯度为1 ×106/100 μL 制模相其组织及脏器转移能力明显下降,见表2。人HT29 结直肠癌细胞浓度梯度为1 ×106/100 μL 制模组,其模型具有高度的稳定性和对抗肿瘤药物的敏感性。
3 讨 论
随着肿瘤转移发生、发展机制的深入研究,信号传导途径中的关键蛋白作为药物靶点进行抗肿瘤药物的研究,有望成为肿瘤治疗的新途径[5]。然而,在前临床实验过程中,选择有效而稳定的药物筛选模型是能否研发高效而低毒的抗肿瘤药物的先决条件。
经临床实践证实,癌肿的远处转移是有选择性的而非随机的,具有很强的器官特异性,如结直肠癌容易发生肝、肺转移[6]。建立合理的结肠癌肝转移模型是研究结肠癌肝转移机制的基础。本实验室曾成功建立过胃肠道肿瘤的原位或异位移植肝转移模型。真正应用于前临床实验只能经口或腹腔内抗肿瘤药物的灌注[4,7],故本研究建立裸鼠大肠癌肝转移半脾模型,后经保留的远端脾静脉直接注入常用化疗药物,观察抗肿瘤效能。此模型更有利于结直肠癌肝转移分子生物机制及新型靶向治疗药物的研发,是较为理想的抗肿瘤药物筛选模型。本模型与目前报道的常用大肠癌肝转移模型相比,有如下优点:(1)有效利用了裸鼠脾脏特殊的解剖特点;(2)经静脉给药,更加贴近于临床,值得强力推荐于前临床试验;(3)可模拟临床广泛应用于肿瘤患者的皮下埋置的化疗泵,不用开腹就能利用注射器来定期注入抗肿瘤药物;(4)可模拟应用于肿瘤化疗患者的周围中心静脉的PICC 管,必要时连接抗肿瘤药物;(5)可作为肝转移的有效治疗,也可应用于预防性肝转移治疗的实验设计。此药物筛选模型值得前临床试验的推广应用,但其弱势在于动物实验手术操作相对复杂,需要反复预实验的来熟练其手术操作。
在本组的前临床实验中,发现结直肠癌细胞建立的肝转移半脾模型成瘤率和减瘤率皆为100%。尤其是在实验中发现大肠癌细胞浓度梯度为1 ×106/100 μL 制模组,显示出模型稳定性和抗肿瘤药物的敏感性。
综上所述,本文所构建的裸鼠大肠癌肝转移半脾模型为结直肠癌肝转移的生物学机制和抗转移治疗提供了较为理想的实验模型。肝转移半脾模型为抗肿瘤药物体外筛选模型方法,其模型的建立能应用于抗肿瘤药物的筛选。
特此,感谢韩国Young Kyu Park 教授的捐赠。
[1] Siegel R,Naishadham D,Jemal A. Cancer Statistics,2013[J]. CA Cancer J Clin,2013,63(1):11 -30.
[2] Hess KR,Varadhachary GR,Taylor SH,et al. Metastatic patterns in adenocarcinoma[J]. Cancer,2006,106(7):1624 -1633.
[3] Manfredi S,Lepage C,Hatem C,et al. Epidemiology and management of liver metastases from colorectal cancer[J].Ann Surg,2006,244(2):254 -259.
[4] 刘福全,徐志强,赵雪峰. 裸鼠结肠癌肝转移模型中多韦替尼抗肿瘤作用的研究[J]. 大连医科大学学报,2014,36(6):545 -549.
[5] Yang Y,Guo Q,Xia M,et al. Generation and characterization of a target - selectively activated antibody against epidermal growth factor receptor with enhanced anti-tumor potency[J]. MAbs,2015,7(2):440 -450.
[6] Aisu N,Yoshida Y,Ishii F,et al. A Successfully Resected Case of Recurrent Lung and Liver Metastases of Rectal Cancer Treated with XELIRI + Bevacizumab Therapy[J].Case Rep Oncol,2013,6(1):143 -147.
[7] 刘福全,王建,赵雪峰. 裸鼠人异位移植胃癌肝转移和腹膜转移模型的实验研究[J]. 大连医科大学学报,2014,36(5):435 -439.

