一起蛋雏鸡皮肤型鸡痘病毒与大肠埃希菌混合感染的病理学观察
谢长清,王 凯,黄绍宋,程国富,谷长勤(华中农业大学动物医学院,湖北武汉430070)
一起蛋雏鸡皮肤型鸡痘病毒与大肠埃希菌混合感染的病理学观察
谢长清,王凯,黄绍宋,程国富,谷长勤*
(华中农业大学动物医学院,湖北武汉430070)
摘 要:采用细菌分离技术、病理组织学观察、PCR鉴定及致病性试验对临床一例疑似雏蛋鸡皮肤型鸡痘混合感染进行了确诊。结果显示,病鸡眼分泌物及脚趾结痂处均分离到大肠埃希菌,内脏器官未分离到细菌。组织学观察发现,在皮肤痘痂和眼睑组织内发现上皮细胞呈水泡变性,空泡化,胞质内出现圆形嗜酸性包涵体,腺胃胃壁增厚,复管腺腺腔内可见局灶性的淋巴细胞样细胞聚集,肺脏淤血,散在的肝细胞和肾小管上皮细胞变性、坏死,其他内脏器官未出现明显病变。体表病灶内PCR扩增出1 358bp的禽痘病毒的特异性片段。将痘痂病料接种9日龄的SPF鸡胚可致鸡胚死亡,呈暗红色。确诊该起病例为皮肤型鸡痘伴大肠埃希菌局部感染。
关键词:鸡痘;大肠埃希菌;病理学观察;诊断
鸡痘病毒属于痘病毒科,为禽痘病毒属的成员。鸡痘主要侵害鸡,是危害养鸡业发展的一种重要传染病,分为两种型皮肤型和黏膜型[1-2]。发病后成年鸡一般不死亡,雏鸡病死率较高,5%~60%不等,近几年鸡痘发病呈现增长趋势,若混合感染、继发感染或营养不良等可造成更高的病死率[3-5]。本文报道了2013年8月份在河南汝南县一养鸡场发生的典型鸡痘病例。试验观察了自然感染鸡痘病毒的鸡的临床症状和病理变化,并通过细菌分离、病理组织学检查及PCR扩增病毒的特异性片段及致病性试验对疑似鸡痘继发细菌感染的病例进行了确诊。
1 材料与方法
1.1材料
1.1.1病料来源 5只40日龄的海蓝褐病鸡来源于河南汝南县某养殖户,饲养蛋鸡500只,发病率10%左右,已死亡11只。病鸡精神沉郁,羽毛蓬松,闭眼,不时的细声尖叫。
1.1.2主要试剂 HE染色试剂一套、革兰染液购自珠海贝索生物技术有限公司。培养基、DNA提取试剂盒、PCR试剂盒及DL2000DNA Marker均购自上海英俊生物有限公司。
1.1.3SPF鸡胚 9日龄SPF鸡胚购于北京梅里亚维通实验动物技术有限公司。
1.2方法
1.2.1病理学检查 观察临床症状及剖检变化,采集病鸡皮肤结痂、心、肝、脾、肺、肾、法氏囊及肠管置于100mL/L中性福尔马林固定液固定,常规石蜡切片,HE染色,光学显微镜观察。无菌取心血和肝组织进行细菌分离。同时无菌采集痘痂组织-80℃保存。
1.2.2细菌学检查 将上述的血液及肝组织无菌操作制备组织匀浆后分别涂布在选择培养基(高盐营养琼脂平板和麦康凯营养琼脂)进行细菌培养。观察菌落形态,涂片,革兰染色、镜检及细菌16S RNA通用引物扩增进行细菌鉴定。
1.2.3病毒的扩增 DNA提取:-80℃保存组织的DNA的提取按照试剂盒说明书进行。引物合成:根据GenBank公布发表的禽痘病毒p4b核心蛋白基因序列(AF198100.1)。设计上游引物:5′-TAGAGGATCGTACATCCA-3′;下游引物5′-ATCTACTCATGACTGGCAA-3μL,由上海生物工程有限公司合成,预期扩增目的片段的大小为1 358bp。
PCR扩增:50μL反应体系,模板2μL,其他按照说明书推荐剂量。扩增条件:94℃5min;94℃1 min,60℃1 min,72℃1 min,35个循环;72℃2 min。PCR扩增产物用10g/L琼脂糖凝胶电泳进行鉴定。
1.2.4致病性试验 9日龄的SPF鸡胚无菌操作接种0.2mL组织悬液于尿囊膜上,接种后放置于37℃恒温孵化箱中培养4d~7d,每日检胚观察。
2 结果
2.1病理学检查结果
病鸡精神沉郁,消瘦,羽毛蓬松,闭眼,眼睑增厚,内分泌物增多(图1A),眼部及腿部出现大小不一,棕褐色的突起的结痂(图1B),对病鸡进行剖检,其内脏器官无明显眼观病变。
组织病理学观察发现,眼睑和腿部皮肤淤血,上皮细胞变性,坏死,胞质空泡化,内有近圆形边界清晰嗜酸性的包涵体(图1C、1D),皮下及部分坏死的上皮细胞间夹杂着淋巴细胞和异嗜性粒细胞,在脚趾皮肤表层的坏死组织内还见大量的成团堆积的蓝染粉末状的细菌团块(图1E)。部分病鸡(1/5)腺胃壁增厚,黏膜下层及复管腺内可见淋巴样的细胞成团聚集(图1F),肺轻微淤血,肝、肾组织内有少量的实质细胞发生变性、坏死,其他器官未见明显病变。
2.2细菌分离及鉴定结果
在高盐营养琼脂上未见细菌生长,麦康凯培养基上可见有微红色,中心呈深桃红色的菌落,圆形,扁平,边缘整齐,表面光滑,湿润。镜检为革兰阴性杆菌,挑取单个菌落纯培养后进行DNA提取及扩增,扩增出分子量约1 500ku左右的片段,经测序后在NCBI进行Blast比对,结果显示和大肠埃希菌(登录号:NC 017634.1)同源性为98%。
2.3病毒扩增结果
提取痘痂病料组织的DNA,用痘病毒的特异性引物PCR扩增结果为阳性(图2),经上海生物工程有限公司测序后和GenBank上报道的序列(登录号:AF198100.1)同源性为99%。

图1 病鸡的病理学变化Fig.1 Pathological lesions in sick chickens
2.4致病性试验
采用上述病毒扩增呈阳性的病变组织悬液接种9日龄的SPF鸡胚后5d鸡胚死亡,死亡鸡胚和正常鸡胚相比体积略小,羽毛较短,全身淤血,呈暗红色(图3)。
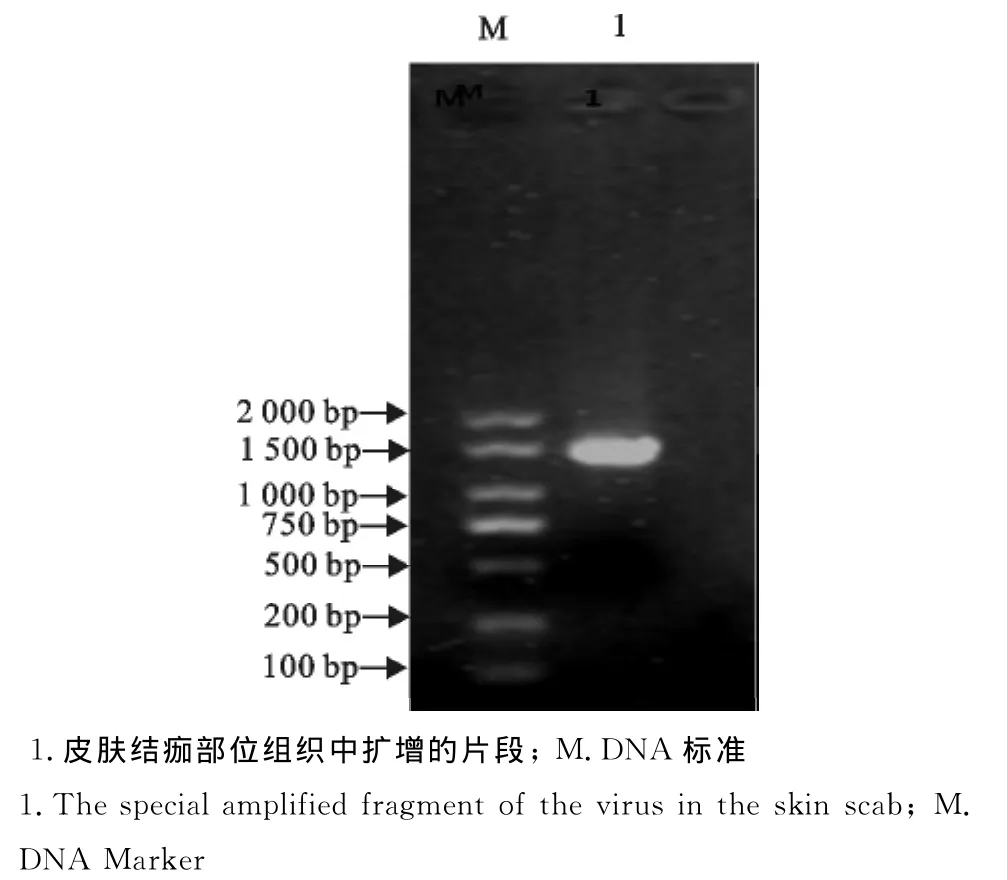
图2 禽痘病毒的特异性片段的扩增结果Fig.2 The specific fragment amplification results of fowl pox virus
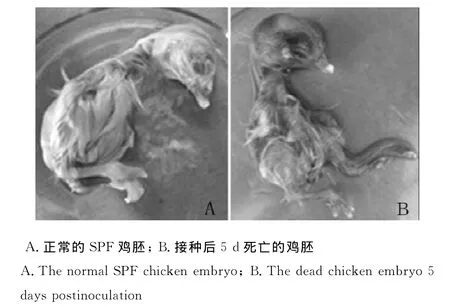
图3 皮肤痘痂组织接种SPF鸡胚试验Fig.3 Skin scab tissue inoculation SPF chicken embryo experiments
3 讨论
禽痘临诊主要有皮肤型、白喉型两种病型。皮肤型鸡痘鸡冠、肉髯上面形成一种灰白色的、水疱样的小斑点,稍突出于皮肤表面。此后斑点干燥结痂,痂皮连接扩大,形成一种疣肉状的痂块。黏膜型鸡痘,鸡冠萎缩。剖检可见口腔上颚出现溃疡灶,喉气管内有黏液,最典型的病变是腺胃明显肿大,腺胃乳头出血,凸凹不平,溃疡[6]。皮肤受损后很容易导致细菌的继发感染,所以在临床上报道较多的大肠埃希菌及葡萄球菌的混合感染[3-4]。该病例在病鸡体表的破损及结痂的皮肤上也分离到大肠埃希菌,但在内脏器官内未分离到,说明细菌局部感染是由皮肤天然屏障破坏后引起的。
该病例病鸡在眼睑及腿部无毛和少毛处皮肤见有大小不等的痘疹,喉部及各内脏器官未见明显的病理变化,排除皮肤型、白喉型混合感染的可能性[2],结合临床症状可初步诊断该病为皮肤型鸡痘。病理组织学观察,在感染部位皮肤上皮细胞的胞质内可见有大量具有证病意义的嗜酸性包涵体[7-8]。鉴于目前很多疫苗都是以痘病毒作为载体,无论是细菌[6]、病毒[8,10]还是寄生虫[11],因此在引物的设计上我们选择禽痘病毒的特异性片段P4b[12],依照前人的取材部位[6,13],本病例从病鸡体表病灶组织内PCR扩增出禽痘病毒的特异性P4b片段。因此确诊该病例为禽痘病毒感染所致的皮肤型鸡痘。
在本病例中观察到肺脏轻微淤血可能与病鸡自然死亡有关,部分肝细胞和少量的肾小管上皮细胞死亡可能与病鸡失明后长时间未进食有关。对病鸡的血液和内脏器官进行了细菌分离,但是未分到可疑的致病菌。部分病鸡还表现腺胃肿胀,在镜下发现腺胃黏膜下及复管腺内局灶性大淋巴细胞样的细胞聚集,这和鸡的马立克病引起内脏的肿瘤细胞比较相似[1],但是在其他器官内未发现类似的细胞群。因为鸡群一旦感染了免疫抑制性疾病,如鸡马立克病或网状内皮增殖病[14],时常会继发痘病毒的感染或加重疾病的严重程度[15]。
参考文献:
[1] Saif Y M.禽病学[M].10版.北京:中国农业出版社,2012:335-355.
[2] Ha H J,Alley M,Howe L,et al.Evaluation of the pathogenicity of avipoxvirus strains isolated from wild birds in New Zealand and the efficacy of a fowl pox vaccine in passerines [J].Vet Microbiol,2013,165:268-274.
[3] 陈守彬,徐怡虎.白喉型鸡痘和大肠杆菌性眼炎混合感染诊治[J].畜牧与兽医,2012,44(3):110-111.
[4] 于金玲,刘孝刚.鸡痘病毒与葡萄球菌混合感染的诊治[J].畜牧与兽医,2012,44(8):110-111.
[5] Abdallah F M,Hassanin O.Detection and molecular characterization of avipoxviruses isolated from different avian species in Egypt[J].Virus Genes,2013,46:63-70.
[6] Perez-Tris J,Williams R A,Abel-Fernandez E,et al.A multiplex PCR for detection of poxvirus and papilloma virus in cutaneous warts from live birds and museum skins[J].Avian Dis,2011,55:545-553.
[7] Leite J A,da Fonseca F G,de Souza Trindade G,et al.A-type inclusion bodies:a factor infuencing cowpox virus lesion pathogenesis[J].Arch Virol,2011,156:617-628.
[8] Weli S C,Tryland M.Avipoxviruses:infection biology and their use as vaccine vectors[J].Virol J,2011,8:49.doi:10.1186/1743-422X-8-49.
[9] 刘存霞,李 昌,王茂鹏,等.新型鸡痘病毒穿梭载体的构建及其体外表达[J].中国兽医科学,2012,42(5):454-460.
[10] Chen H,Yang M,Cui B,et al.Construction and immunogenicity of a recombinant fowlpox vaccine coexpressing S1glycoprotein of infectious bronchitis virus and chicken IL-18[J]. Vaccine,2010,28:8112-8119.
[11] Yang G,Li J,Zhang X,et al.Eimeria tenella:Construction of a recombinant fowlpox virus expressing rhomboid gene and its protective efficacy against homologous infection[J].Exp Parasitol,2008,119,30-36.
[12] Offerman K,Carulei O,van der Walt A P,et al.The complete genome sequences of poxviruses isolated from a penguinanda pigeon in South Africa and comparison to other sequenced avipoxviruses[J].BMCG enomics,2014,15:463. doi:10.1186/1471-2164-15-463.
[13] Lachish S,Lawson B,Cunningham A A,et al.Epidemiology of the emergent disease Paridae pox in an intensively studied wild bird population[J].PLoS One,2012;7(11):e38316. doi:10.1371/journal.pone.0038316.Epub 2012Nov 21.
[14] Wei K,Sun Z,Zhu S,et al.Probable congenital transmission of reticuloendotheliosis virus caused by vaccination with contaminated vaccines[J].Public Library Sci One,2012,7 (8),e43422.doi:10.1371/journal.pone.0043422.
[15] Lawson B,Lachish S,Colvile K M,et al.Emergence of a novel avianpox disease in British tit species[J].PLoS One,2012,7:e40176.
Pathological Observation on Mixed Infection with Skin Type Avipoxvirus and E.coli in Layer Chicks
XIE Chang-qing,WANG Kai,HUANG Shao-song,CHENG Guo-fu,GU Chang-qin
(College of Veterinary Medicine,Huazhong Agricultural University,Wuhan,Hubei,430070,China)
Abstract:The causes of the suspected clinical skin-type pox virus mixed infection in layer chicks were confirmed by bacterial isolation technology,histopathological observation,PCR identification and pathogenicity test.The results showed that the E.coli was isolated from the toe skin scabs and eye secretions,and no bacteria isolated from the internal organs.Histological observation found that circular eosinophilic inclusions,vesicular degeneration and cavitation appeared in the cytoplasm of the epithelial cells of the skin scabs and eyelid tissue.Glandular stomach wall was thick with lymphocyte cell-like focal cluster in the compound tubular gland,lung congestion,a few hepatocytes and renal tubular epithelial cell degeneration,necrosis were scattered,and no obvious pathological lesions appeared in other organs.In skin lesions,PCR amplification segments of the specificity of 1 358bp of fowl pox virus were confirmed.The vaccination of 9 day-old SPF chicken embryes with scab materials lead the embryo death.All these confirmed that the cases were mixed infections with skin-type chicken pox virus and E.coli.
Key words:fowl pox;E.coli;pathological observation;diagnosis
作者简介:谢长清(1975-),男,湖北荆门人,硕士,主要从事基础兽医研究。*通讯作者
基金项目:公益性行业(农业)专项(201303044);中央高校基本科研业务费专项(2011PY081)
收稿日期:2014-11-18
中图分类号:S852.659.1
文献标识码:B
文章编号:1007-5038(2015)06-0174-04

