致犊牛出血性腹泻病原的分离与鉴定
朱梅胜,张新兵,张 毅,徐守振,曹志伟,李 超,刘琳琳,郭妍妍,尹燕博*(.青岛农业大学动物科技学院,山东青岛6609;.青岛蓝十字动物医院,山东青岛6609;.中国动物卫生与流行病学中心,山东青岛660;.青岛澳兰百特生物工程有限公司,山东青岛660)
致犊牛出血性腹泻病原的分离与鉴定
朱梅胜1,张新兵2,张毅3,徐守振1,曹志伟1,李超1,刘琳琳1,郭妍妍4,尹燕博1*
(1.青岛农业大学动物科技学院,山东青岛266109;2.青岛蓝十字动物医院,山东青岛266109;
3.中国动物卫生与流行病学中心,山东青岛266032;4.青岛澳兰百特生物工程有限公司,山东青岛266101)
摘 要:为查明山东某肉牛养殖场犊牛出血性腹泻的病因,采集患病牛粪便,进行细菌分离培养、革兰染色镜检、生化鉴定和16SrRNA测序分析,接种MDBK细胞分离病毒,运用RT-PCR方法检测分离的病毒,并进行测序分析。结果表明,分离的细菌为大肠埃希菌,血清型鉴定为O8型,且该菌耐药性严重。分离到的病毒为基因2型牛病毒性腹泻病毒。初步判定该病是由致病性大肠埃希菌O8和基因2型牛病毒性腹泻病毒混合感染引起。
关键词:犊牛;出血性腹泻;大肠埃希菌;牛病毒性腹泻病毒;分离鉴定
犊牛腹泻是肉牛养殖中的高发病,造成巨大的损失。引起肉牛腹泻及血便的原因很多,病因复杂,通常由病原微生物引起,如由致病性大肠埃希菌、沙门菌、梭菌等引起的细菌性腹泻;由牛病毒性腹泻病毒、轮状病毒、冠状病毒等引起的病毒性腹泻;由球虫等引起的寄生虫性腹泻。因此对牛群进行全面检查,进行病原分离鉴定十分必要。
牛病毒性腹泻是由牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)引起的一种极为复杂、呈多临床类型表现的疾病[1]。自1946年Olafson P[2]首次报道以来,本病在世界各地均有发生,尤其在养牛业发达地区,这种疾病的发生更为严重,给养牛业造成巨大的经济损失[3]。目前,我国20多个省、市、自治区分离到牛病毒性腹泻病毒或查出了该病毒的抗体[4-5]。BVDV感染引起的免疫抑制增强了其他病原体的致病性。其后果是损害机体的免疫机能,增强其他病原体如副流感病毒3型、传染性鼻气管炎病毒、冠状病毒、轮状病毒、巴氏杆菌、沙门菌、大肠埃希菌、球虫等的致病性。1885年,Escherion发现大肠埃希菌,在很长的一段时间内一直作为正常肠道菌群的组成部分,认为是非致病菌。直到20世纪中叶,人们才认识到一些特殊血清型的大肠埃希菌对人和动物有致病性,尤其是对幼畜常引起严重的腹泻和败血症[6]。
2012年春,山东某牛场出现犊牛腹泻病例,病牛体温升高,少食,消瘦,粪便呈水样,且带有大量血液及脱落肠黏膜。为了查明引起该病例的致病原,我们采集了病牛粪便,进行了细菌和病毒的分离鉴定。
1 材料与方法
1.1材料
1.1.1病料来源与采集 山东省某肉牛养殖场1 头6月龄肉牛,由直肠无菌采取患牛粪便,送往实验室检查鉴定,部分病料用于细菌、病毒分离,部分病料置-70℃冰箱保存备用。
1.1.2菌株与细胞 大肠埃希菌DH5α、牛胚肾细胞(MDBK)均由青岛澳兰百特生物工程研究院保存。
1.1.3主要试剂 DNA标准DL 2 000,Taq DNA聚合酶,dNTP,M-MLV反转录酶,pMD19-T Vector,DNA液体纯化试剂盒为宝生物工程(大连)技术服务公司产品。EasyPure Viral DNA/RNA Kit购自全式金生物技术有限公司。营养肉汤、血琼脂营养基础、麦康凯琼脂为广州环凯微生物科技有限公司产品。DMEM、马血清、胰蛋白酶、双抗等为GIBCO公司产品。标准O型分型血清购自中国兽医药品监察所。生化鉴定管和药敏纸片购自杭州微生物试剂公司。
1.1.4引物 根据GenBank中所公布的基因序列,设计BVDV 5′-UTR非翻译区序列引物P1、P2。参照柳强等[7]合成了牛冠状病毒(Bovine coronavir-
us,BCV)的N蛋白和牛轮状病毒(Bovine rotavirus,BRV)的VP6基因上的一段保守区域各合成一对特异性引物P3、P4和P5、P6。合成细菌16S rRNA通用引物27F、1492R。引物由北京六合华大基因科技股份有限公司合成,稀释成25mmol/L,置-20℃保存(表1)。
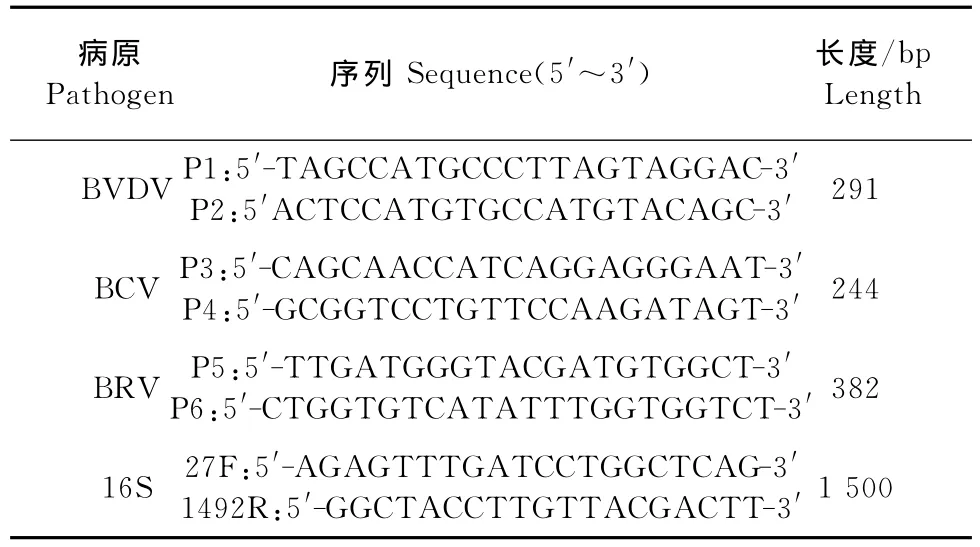
表1 BVDV、BCV和BRV引物Table 1 The primers of BVDV,BCV and BRV
1.2方法
1.2.1细菌的分离与鉴定
1.2.1.1细菌分离培养 将粪便接种于血琼脂平板上,37℃培养24h。观察其溶血情况并挑取单个菌落接种于麦康凯(MAC)培养基上,37℃培养24 h。观察其菌落特征,选取在麦康凯培养基上呈粉红色的单个菌落于肉汤培养液中,培养24h后接种于大肠埃希菌显色培养基上,37℃培养24h,进行革兰染色镜检。
1.2.1.2生化鉴定 将上述分离纯化的病原菌接种于大肠埃希菌显色培养基上,培养24h后,按常规方法[8]对分离株进行三糖铁斜面试验(TSI)、糖发酵试验、吲哚试验、MR试验、VP试验、枸橼酸盐试验、脲酶试验。37℃培养24h后,观察结果。
1.2.1.3PCR检测 按照全式金EasyPure Viral DNA/RNA Kit说明书提取分离菌DNA,进行PCR检测。反应体系如下:超纯水17μL,10×PCR buffer(Mg2+free)3μL,MgCI24μL,dNTPs 2.5μL,Taq酶0.5μL,16S上下游引物各0.5μL,模板2μL,总体积为30μL。反应程序为:94℃5 min,(94℃30s,55℃30s,72℃50s)30个循环,72℃延伸10min。取5μL产物进行10g/L琼脂糖核酸凝胶电泳,纯化回收PCR产物送华大基因工程技术有限公司测序。
1.2.1.4O抗原制备及血清型鉴定 已纯化培养的菌株划线接种于营养琼脂斜面上,37℃培养24h。用5g/L石炭酸生理盐水2mL洗脱菌苔,制成浓稠菌悬液,121℃高压2h,破坏其K、H抗原,得到O抗原。通过玻板凝集试验,用标准O型分型血清,对分离的菌株进行血清型鉴定。同时以检测抗原与石碳酸生理盐水混合物作对照,观察有无自凝现象。1min内出现明显的凝集判为阳性。
1.2.1.5药物敏感性试验 采用K-b法对细菌进行抗菌药物敏感性试验,记录抑菌圈直径,并根据由杭州微生物试剂有限公司提供判定标准进行药物敏感性的判断。
1.2.2病毒的分离与鉴定
1.2.2.1粪便处理 取牛血便样品,加入4倍体积的生理盐水,振荡摇匀,以12 000r/min 4℃离心5min,吸出上清液加入适量的双抗,4℃处理1h,12 000r/min 4℃再离心1min,取上清液用于病毒分离。
1.2.2.2病毒分离培养 MDBK传代细胞长成单层后,用PBS洗3次,将2mL处理好的粪便上清液接种MDBK细胞,37℃吸附1h后加细胞维持液,同时接种2mL PBS作为阴性对照。置37℃、体积分数为5% CO2条件下培养,细胞出现明显病变后收毒,72h无细胞病变,盲传下一代。
1.2.2.3RT-PCR检测 RNA的提取,按照全式金EasyPure Viral DNA/RNA Kit说明书提取粪便上清和细胞培养物总RNA,提取的RNA溶解于50 μL DEPC处理水中,即用或-70℃分装保存。BVDV、BCV和BRV cDNA的制备。20μL反转录体系:超纯水11μL、5×RT buffer 4μL、dNTP 2μL,RNA酶抑制剂0.5μL、M-MLV反转录酶1μL,BVDV、BCV和BRV上下游引物各0.75 μL,42℃水浴1h。BVDV、BCV和BRV PCR扩增反应体系为:超纯水17μL,10×PCR buffer(Mg2+free)3μL,MgCI24μL,dNTP 2.5μL,Taq酶0.5 μL,BVDV、BCV和BRV上下游引物各0.5μL,BVDV、BCV和BRV cDNA模板各2μL。PCR反应程序为:94℃5min,(94℃30s、55℃30s、72℃50s)30个循环,72℃延伸10min。取5μL产物进行10g/L琼脂糖核酸凝胶电泳,扩增片段胶回收,连接于pMD19-T载体中,转化E.coli DH5α感受态细胞,筛选重组质粒,送华大基因工程技术服务有限公司测序。
2 结果
2.1临床观察
病牛初期粪便带有血液和脱落的肠黏膜后期排出水样血便,体温升高达41℃,饮食减退,精神萎靡,消瘦,皮肤弹性降低,尿少且呈深黄色,唾液黏稠呈丝状,流涎增多,鼻黏膜糜烂或溃疡,患牛肛门和
阴门沾有血便。初步诊断为感染牛病毒性腹泻病毒,并可能有细菌混感。
2.2细菌分离鉴定
2.2.1分离菌在各种培养基的生长情况及镜检特征 经培养分离菌在血琼脂平板上长出圆形、边缘整齐、表面光滑的单个菌落;接种于MAC的菌落呈粉红色、圆形、边缘整齐、表面光滑、无黏性;在大肠埃希菌显色培养基上,生长出蓝绿色的小菌落,呈圆形,表面光滑。分离菌革兰染色镜检,显微镜下可见革兰阴性,中等大小直杆菌,两端钝圆,成对或散在排列,无芽胞,有微荚膜。根据以上特征,初步确定分离菌为肠杆菌科埃希菌属的大肠埃希菌。
2.2.2生化试验结果 对分离菌进行生化试验,结果符合大肠埃希菌的特征。分离细菌能发酵棉子糖,鼠李糖,麦芽糖,葡萄糖,甘露醇,发酵乳糖迟缓,不分解蔗糖;不分解尿素,不利用柠檬酸盐,可还原硝酸盐;赖氨酸脱羧酶及尿素酶试验皆呈阴性;吲哚、MR试验阳性;VP试验阴性。
2.2.3菌液PCR检测 PCR扩增出预期1 500bp左右的目的条带(图1),将所得到的序列与Gen-Bank中已知的E.coli 16SrRNA序列进行比对,同源性达到99%,鉴定该分离菌为大肠埃希菌。
2.2.4大肠埃希菌血清型鉴定 采用大肠埃希菌“O”抗原分型血清将分离到的大肠埃希菌进行血清型鉴定,结果显示,分离株血清型为O8,是引起幼牛腹泻的常见血清型。
2.2.5大肠埃希菌药敏试验 运用纸片法对分离纯化的大肠埃希菌进行药物敏感性试验,结果如表2所示。由表2可以看出该分离菌对头孢类药物及氧氟沙星高度敏感,对庆大霉素中敏,对卡那霉素、磺胺甲恶唑、氟哌酸、氧氟沙星低敏,对林可霉素、氯霉素、利福平、红霉素、氟苯尼考、青霉素、四环素、万古霉素耐药。
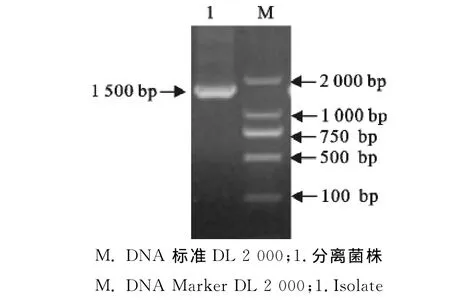
图1 分离菌的16SrRNA PCR结果Fig.1 PCR results of 16SrRNA of isolated bacteria
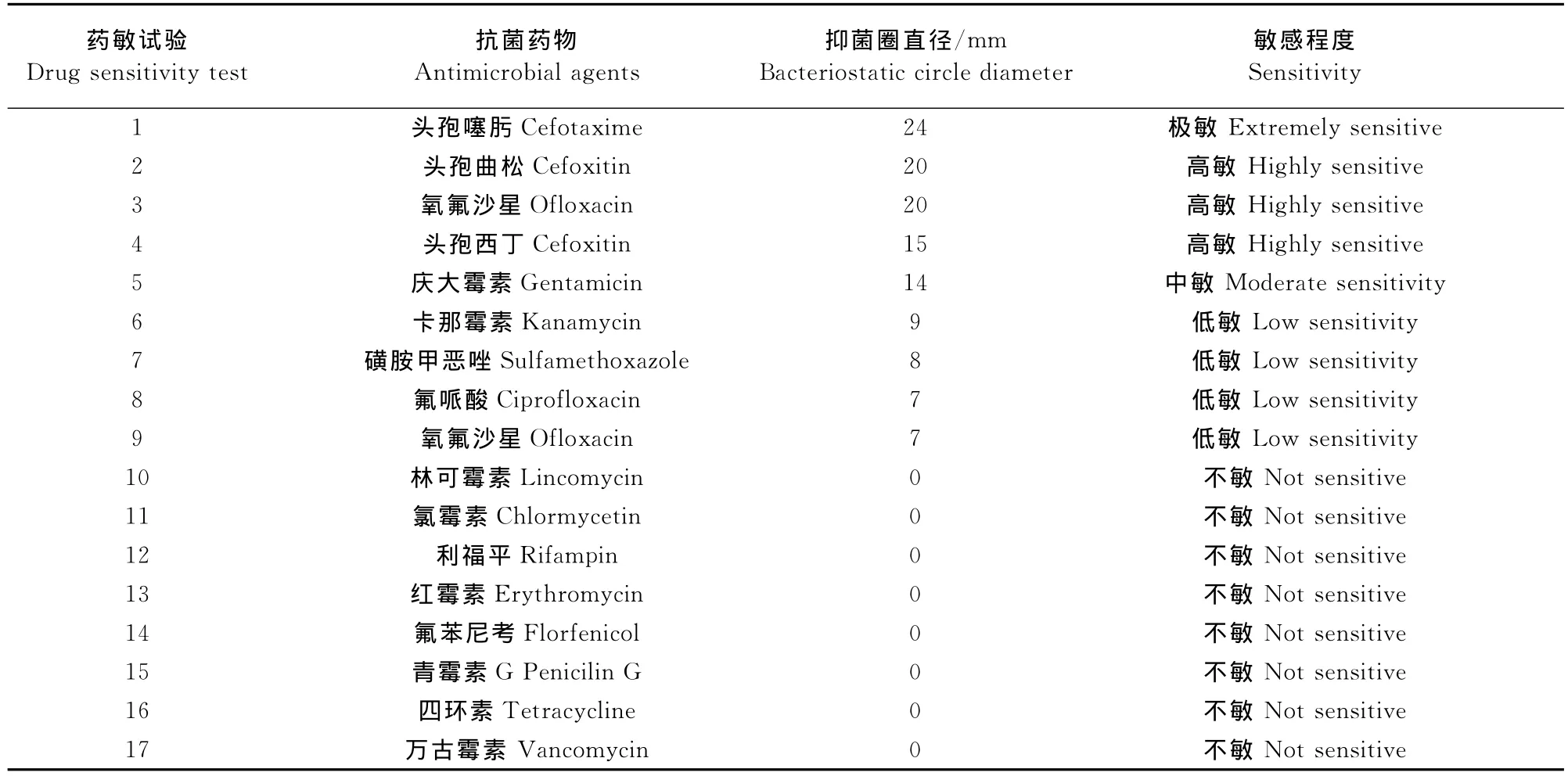
表2 大肠埃希菌药敏试验结果Table 2 The drug sensitivity test result of E.coil
2.3病毒分离与PCR鉴定
2.3.1病毒细胞分离培养 粪便上清液接种MDBK单层细胞,在37℃、体积分数为5%的CO2培养箱中培养48h。对照组正常,接毒组出现明显细胞
病变,收获细胞培养物,在-20℃冰箱冻融二次后,再次接种MDBK单层细胞进行传代培养,连续传3代,单层细胞均出现细胞病变。
2.3.2病毒RT-PCR检测 对细胞培养物和粪便上清进行BVDV、BRV、BCV三种病毒RT-PCR扩增,结果扩增出291bp大小条带,符合BVDV目的条带大小,而BRV、BCV检测均为阴性(图2),将PCR产物序列与GenBank中已知的BVDV序列进行比对,与基因2型牛病毒性腹泻病毒同源性达到100%,鉴定该病毒分离株为基因2型牛病毒性腹泻病毒(BVDV-2)。
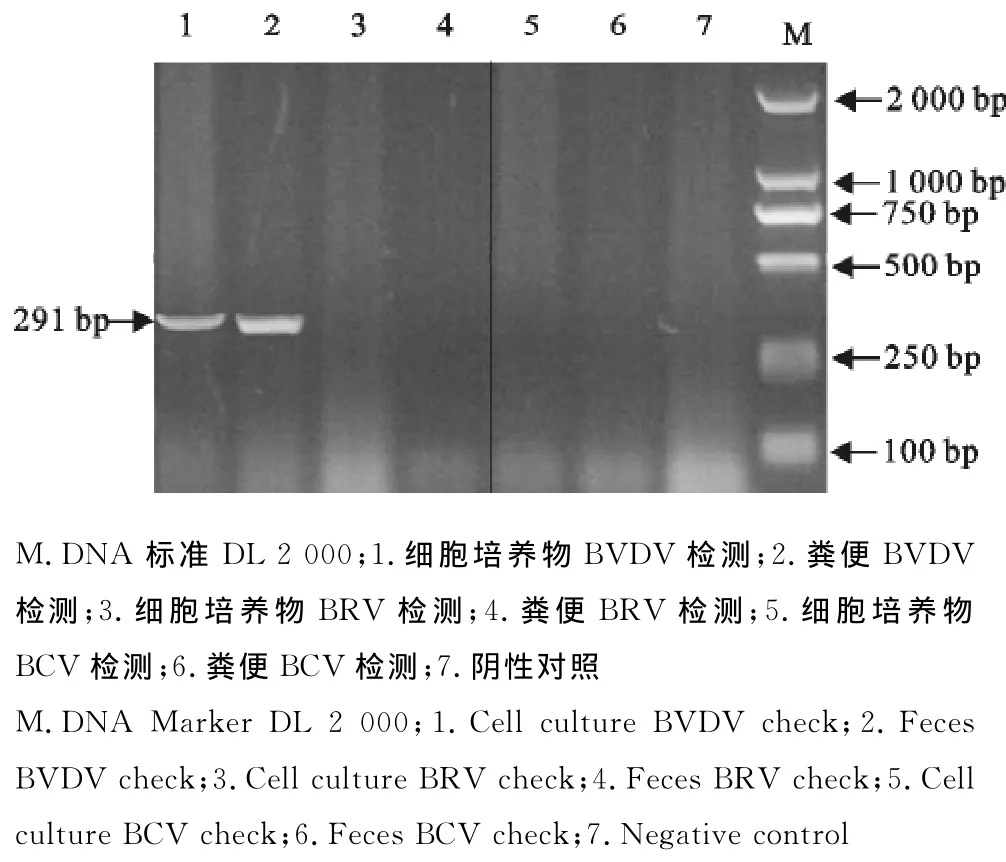
图2 细胞培养物和粪便上清RT-PCR结果Fig.2 RT-PCR results of cell cultures and feces
3 讨论
通过临床检察和实验室细菌与病毒分离鉴定,初步判定该起犊牛出血性腹泻病例是由O8型大肠埃希菌和基因2型牛病毒性腹泻病毒混合感染造成。在国内有已有报道,牛病毒性腹泻病毒可引起犊牛出血性腹泻,O8型大肠埃希菌也可引起牛腹泻,但是这两种病原同时检测到尚无报道[9-10]。分析病因,可能为犊牛先感染牛病毒性腹泻病毒导致机体免疫机能降低,并继发大肠埃希菌感染引起的。要将发病犊牛及时隔离,并进行相应的治疗。
牛病毒性腹泻作为一种重要的动物疫病,目前在我国已普遍存。由于在我国该病具有特征性临床症状的发病并不高,各大小养牛场对该病的防治并不重视,该病又可通过血液、分泌物与排泄物等多种途径传播,感染BVDV的孕牛产下的犊牛对该病毒有免疫耐受性,可持续感染BVDV,终身带毒,持续排毒,成为重要传染源,因此长期以来该病一直严重影响畜牧业的发展[11-12]。同时BVDV还是牛源生物制品,如血清、冻精、冷冻胚胎及疫苗等的常在污染源,给畜牧业和相关生物制品领域造成一定的经济损失。牛病毒性腹泻致病机理复杂,给本病的防治带来很大困难[13]。国外防控牛病毒性腹泻病毒主要采取检疫、淘汰牛群中持续性感染牛和疫苗预防接种的方法,并取得一定的成效。牛病毒性腹泻病毒与猪瘟病毒存在血清交叉反应性,我国也曾对猪瘟弱毒疫苗预防BVD-MD进行过研究,20世纪80年代初,西南民族学院拉稀病课题组曾使用猪瘟疫苗对四川红原地区暴发的牛病毒性腹泻的牦牛进行过预防,实践证实有效。据悉目前一些地区仍有使用猪瘟疫苗预防本病[14]。
致病性大肠埃希菌是医学和兽医学临床感染中最常见的病原菌之一[15],血清型众多,不同血清型之间存在着免疫差异,缺乏相互交叉免疫,同时大肠埃希菌易产生耐药性,全国各地均有分离到较强耐药性的菌株,为本病的治疗带来了很大难度。本起病例分离菌经血清型鉴定为O8,是引起牛腹泻的常见致病菌[10]。分离株仅对头孢噻肟、头孢曲松、头孢西丁、氧氟沙星4种常见抗菌药物敏感,而对大多数抗菌药物耐受,这可能是药物滥用的结果,为本病的治疗带来了很大难度。盲目用药,会延误病情,造成新的耐药菌株,进而造成更大的损失。通过药物敏感试验指导临床用药,不仅可以有效治疗大肠埃希菌病,而且可以防止耐药菌株的产生;针对大肠埃希菌易产生耐药性且各菌株缺乏互相交叉免疫保护的特点,可以用多价大肠埃希菌苗预防本病[16],至于本次分离到的大肠埃希菌能否成为当地的疫苗株还有待进一步的深入研究。
针对犊牛出血性腹泻致病原的特点,要做好该病防控工作,应重点从下几个方面着手:一要严格清扫消毒牛场圈舍和运动场,改善卫生条件,监测牛场周围环境卫生、空气、水资源的质量;二要做好养殖场的生物安全防护,做好灭鼠工作,及时隔离患病牛,切断病原体的传播路径。
参考文献:
[1] 殷 震,刘景华.动物病毒学[M].北京:科学出版杜,1997:323-340.
[2] Olafson P.An apparently new transmissible disease of cattle [J].Cornell Vet,1946,36:205-213.
[3] Reichel M P,Hill F I,Voges H.Does control of bovine viral diarrhea infection make economic sense[J].Vet J,2008,56 (2):60-66.
[4] 虞蕴如,许柄坤.南京市出生犊牛病毒性腹泻/黏膜病的血清学调查[J].中国兽医科技,2003,33(1):66-68.
[5] 泉 云,张苏华,沈 悦,等.奶牛和猪血清中牛病毒性泻-黏膜病抗体的检测[J].畜牧与兽医,2004,36(2):30-32.
[6] Kaikainen V,Ikaheimo R,Katila M L,et al.Identificiation of Escherichia coil strains from patients with urosepsis demonstrated by a commercail agglutination test[J].Clin Microbiol,1991,29:221.
[7] 柳 强,侯喜林,车 车,等.牛冠状病毒和轮状病毒的双重RT-PCR检测方法的建立及应用[J].中国预防兽医学报,2007,31(9):701-704.
[8] 姚火春.兽医微生物学实验指导[M].北京:中国农出版社,2002:36-63.
[9] 薛 涛,杨耀兰,谭兆伟,等.牛病毒性腹泻-黏膜病的诊治[J].中国兽医杂志,2007,39(2):62.
[10] 刘金华,齐长明,苏银池.由大肠杆菌和疑似冠状病毒引起的犊牛腹泻[J].中国兽医杂志,1998,24(10):17.
[11] 牛国辉,季新成,段晓东,等.牛病毒性腹泻病毒的分离与鉴定[J].新疆农业科学,2010,47(5):986-991.
[12] Ellis J A.A perspective on bovine viral diarrhea virus vaccines [J].Large Animal Practice,2000,21(1):14-17.
[13] Valle P S,Skjerve E,Martin S W,et al.Ten years of bovine virus diarrhea virus(BVDV)control in Norway:a cost-benefit analysis[J].Preventive Veterinary Medicine,2005,72:189-207.
[14] 韩 鹏,刘亚刚,华 莎,等.我国牛病毒性腹泻-粘膜病的流行及防制状况[J].畜禽业,2003(11):9-10.
[15] 罗雪云.食品卫生物检验标准手册[M].北京:人民卫生出版社,2002:162-163.
[16] 方光远,张 姝,樊 婕,等.犊牛腹泻大肠杆菌疫苗的研制与应用[J].中国奶牛,2008(8):36-38.
Isolation and Identification of Pathogens in Hemorrhagic Diarrhea Cases of Calves
ZHU Mei-sheng1,ZHANG Xin-bing2,ZHANG Yi3,XU Shou-zhen1,CAO Zhi-wei1,LI Chao1,LIU Lin-lin1,GUO Yan-yan4,YIN Yan-bo1
(1.College of Animal Science and Veterinary Medicine,Qingdao Agricultural University,Qingdao,Shandong,
266109,Shandong,China;2.Qingdao Blue Cross Animal Hospitol,Qingdao,Shandong,266109,China;
3.China Animal Health and Epidemiology Centre,Qingdao,Shandong,266032,China;4.Qingdao OLand-Better Bioengineering Co.,LTD,Qingdao,Shandong,266101,China)
Abstract:In order to identify the pathogens of hemorrhagic diarrhea of calves in a farm of Shandong province,stool samples of sick calves were collected.Bacteria were isolated and indentified by bacterial culture,Gram staining,biochemical identification and 16SrRNA sequence analysis.Virus was isolated by inoculating the samples in MDBK cell and the nucleotides of the virus were amplified by RT-PCR and sequenced. The results showed that the isolated bacteria are E.coli O8,which had multiple drug resistance.The isolated virus is genotype 2bovine viral diarrhea virus.The disease was initially determined by pathogenic E. coli O8and genotype 2bovine viral diarrhea virus mixed infection.
Key words:calf;hemorrhagic diarrhea;E.coli;Bovine viral diarrhea virus;isolation and identification
通讯作者
作者简介:朱梅胜(1988-),男,山东昌乐人,硕士,主要从事动物传染病防控研究。*
收稿日期:2014-11-12
中图分类号:S852.612
文献标识码:B
文章编号:1007-5038(2015)05-0132-05

