原花青素B2对LPS诱导的心肌细胞凋亡的保护作用
张晓晖,曾繁典,孙智达,杨卓欣,熊益群,徐超英,刘心亮,林 坚,穆桂萍,徐绍钢,刘文赫
(1.深圳市中医院中医药研究所,广东深圳 518033;2.华中科技大学同济医学院药理系,湖北武汉 430030;3.华中农业大学食品科学技术学院,湖北武汉 430070)
原花青素B2对LPS诱导的心肌细胞凋亡的保护作用
张晓晖1,曾繁典2,孙智达3,杨卓欣1,熊益群1,徐超英1,刘心亮1,林 坚1,穆桂萍1,徐绍钢1,刘文赫1
(1.深圳市中医院中医药研究所,广东深圳 518033;2.华中科技大学同济医学院药理系,湖北武汉 430030;3.华中农业大学食品科学技术学院,湖北武汉 430070)
中国图书分类号:R-332;R284.1;R322.11;R329.25;R542.2
摘要:目的 研究原花青素B2(procyanidin B2,PCB2)对脂多糖(lipopolysacchride,LPS)诱导的心肌细胞凋亡的保护作用及其机制。方法 采用原代培养新生大鼠心肌细胞,LPS诱导心肌细胞损伤模型,PCB2低、中、高剂量组分别用含有6.25、12.5、25.0 μmol·L-1PCB2的DMEM培养基持续培养24 h。采用四唑盐(MTT)比色法测定心肌细胞存活率,光泽精化学发光法测定心肌细胞NOX的活性,Western blot法分析心肌NADPH氧化酶p47phox亚基的表达,TUNEL法检测细胞凋亡,流式细胞术测定心肌细胞ROS的含量。结果 LPS诱导的细胞损伤组与正常对照组(Control)比较,心肌细胞活力明显降低(P<0.01),而心肌细胞NOX活性、p47phox亚基的表达、凋亡细胞数量以及ROS含量均明显增加(P<0.01)。PCB2处理后,低、中、高剂量组细胞活力均明显升高,心肌细胞NOX活性、p47phox亚基的表达、凋亡细胞数量以及ROS含量均明显下降,且具有剂量依赖性(P<0.01)。结论 PCB2通过抑制NADPH氧化酶激活、p47phox的表达以及活性氧的产生发挥对LPS诱导的心肌细胞凋亡的保护作用。
关键词:原花青素B2;脂多糖;心肌细胞;凋亡;NADPH氧化酶;活性氧自由基
网络出版时间:2015-10-16 9:52 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20151016.0952.016.html
在脓毒症中,心脏受影响最为常见,脓毒症合并心功能衰竭,死亡率高达70%~90%[1],临床救治相当困难。但脓毒症心功能不全的细胞内机制目前尚不完全清楚。近来的研究发现,脓毒症心功能不全可能与细胞凋亡[2]和活性氧(reactive oxygen spe-cies,ROS)大量产生[3]有关。抗氧化剂的早期干预对于脓毒症心肌细胞凋亡可能具有积极的意义。
天然植物药作为天然抗氧化剂受到越来越多的重视,许多研究提示天然植物药相比于化学药物无明显副作用的特点使其更具开发潜力。原花青素(procyanidins,PC)广泛存在于植物中,是一种由单体(主要是儿茶素、表儿茶素等)、低聚原花青素(单体的二、三、四聚合物体)和高聚原花青素(五聚体以上)组成的化合物。其中二聚体在各类原花青素中分布最广,抗氧化活性最强,是最重要的一类。二聚体因两个单体的构象或缩合键位不同,有多种异构体,现已鉴定的8种异构体命名为B1~B8,其中B1~B4由C4-C8键合,B5~B8由C4-C6键合。在8种异构体中原花青素B2是活性最强的一个二聚体[4],它的结构式如Fig 1。

Fig 1 Structure of procyanidin B2
二聚体原花青素B2是葡萄籽原花青素提取物的组分之一,它的生物学活性较其他水溶性多酚更强[1]。已经证实原花青素,尤其是原花青素B2具有清除自由基、抗氧化[5-6]、抗肿瘤[7-8]、抗炎症[9-10]、抗凋亡[11]以及抗动脉粥样硬化[12]等作用。
我们前期的研究结果发现,从荔枝壳提取的原花青素预处理能够明显减轻脓毒症大鼠心肌细胞凋亡,可能与其抗氧化性损伤作用有关[13]。另外,原花青素还能通过抑制NADPH氧化酶的活性达到抗血小板聚集的作用[14]。那么,原花青素中活性最强的原花青素B2是否通过NADPH氧化酶途径达到抗脓毒症心肌细胞凋亡的作用,目前还不清楚。本研究以脂多糖诱导的心肌细胞损伤为模型,从NADPH氧化酶/活性氧途径探讨原花青素B2对心
肌细胞凋亡的作用,将有助于更深入研究原花青素B2的药理学作用机制。
1 材料与方法
1.1实验材料 出生24 h内Sprague-Dawley(SD)新生乳鼠由广东省医学实验动物中心提供;原花青素B2(procyanidin B2,PCB2)、脂多糖(lipopolysac-chride,LPS)、Lucigenin、NAD(P)H、α-actin antibody均购自Sigma;TUNEL试剂盒购自Roche;p47phoxAn-tibody购自Cell Signaling Technology;lysotracker-blue、Dead Cell Apoptosis Kit with Annexin V Alexa Fluor488&PI-for Flow Cytometry、CellROXDeep Red Flow Cytometry Assay Kit均购自Invitrogen;Tiron购自Fluka。
1.2原代心肌细胞培养 采用文献的方法[15],无菌操作取出生24 h内健康SD乳鼠左心室,剪碎成1 mm×1 mm×1 mm大小,加入适量0.15%胰蛋白酶,37℃水浴下轻柔搅动、反复消化,制备心肌细胞悬液,差速贴壁。用含15%新生牛血清的DMEM培养液,调整细胞浓度为每瓶3×106个,接种于底面积为75 cm2的培养瓶,置CO2培养箱进行原代培养。
1.3分组与造模 模型复制选择LPS 5、25、50 mg ·L-1进行实验,选用细胞存活率约为60%的浓度为实验复制模型浓度。选择2、4、8、12、24 h作为分析损伤的时间点,选用细胞存活率在60%左右的时间点为实验复制模型时间。LPS对心肌细胞的损伤随着浓度的增大而增强,当浓度在25 mg·L-1时,细胞存活率在61.25%,同时LPS对心肌细胞的损伤随着时间的延长而增强,用25 mg·L-1LPS对心肌细胞持续作用达24 h,细胞存活率在60.22%。因此,本实验研究选用25 mg·L-1LPS作用心肌细胞24 h复制细胞损伤模型。
取原代培养心肌细胞,置于CO2培养箱常规培养24 h,换无新生牛血清的DMEM培养液同步化24 h后进行实验。实验分为以下6组:①正常对照(Control)组:细胞置于DMEM培养基中持续培养24 h;②LPS诱导的细胞损伤组:细胞置于含有25 mg·L-1LPS的DMEM培养基中持续培养24 h;③PCB2低剂量组:细胞置于含有25 mg·L-1LPS和6.25 μmol·L-1PCB2的DMEM培养基中持续培养24 h;④PCB2中剂量组:细胞置于含有25 mg·L-1LPS和12.5 μmol·L-1PCB2的DMEM培养基中持续培养24 h;⑤PCB2高剂量组:细胞置于含有25 mg·L-1LPS和25 μmol·L-1PCB2的DMEM培养基中持续培养24 h。
1.4检测指标
1.4.1细胞活力检测 采用MTT比色法检测心肌细胞存活率。各组细胞以5×107·L-1的细胞密度接种于96孔培养板中,37℃培养。待细胞稳定生长2 d后,加入不同浓度LPS处理相应的时间,然后每孔加入浓度为5 g·L-1的MTT液20 μL,37℃孵育4 h,弃培养上清液,再每孔加入二甲基亚砜150 μL,充分溶解结晶后,酶标仪在490 nm处测定各孔的吸光度值,即OD值,以间接反映各组活细胞数量。
1.4.2光泽精化学发光法测定心肌细胞NOX的活性 细胞处理结束后,用4℃预冷的PBS洗涤细胞2次,加入Jude Krebs buffer[Jude Krebs(JK)Buffer:119 mmol·L-1NaCl,20 mmol·L-1Hepes,4.6 mmol·L-1KCl,1 mmol·L-1MgSO4,0.15 mmol· L-1Na2HPO4·2H2O,136.09 mmol·L-1KH2PO4,84.01 mmol·L-1NaHCO3,147 mmol·L-1CaCl2,180.2 mmol·L-1glucose,使用前加入protease in-hibitor cocktail(Roche)],刮下细胞。冰上超声后4°C离心,800×g,4 min。取少量样本进行蛋白定量(Bradford法)。避光96孔板内加入40 μg的细胞蛋白,5 μL DMSO,10 μmol·L-1lucigenin,50 mmol·L-1Tiron,加入新鲜配制的NADPH 100 μmol·L-1启动反应,以化学发光检测仪进行检测,酶活性检测结果以每μg蛋白的光单位表示(light unit)。
1.4.3Western blot法分析心肌NADPH氧化酶p47phox亚基的表达并定量 收集细胞蛋白后,采用15%浓度的聚丙烯酰胺凝胶测目的蛋白,经SDS-PAGE电泳后将蛋白转至PVDF膜上,5%脱脂牛奶封闭后,将一抗(1∶500)4℃孵育过夜后,用TBST每次7 min洗2次后,用相应的稀释好的二抗(HRP标记二抗,1∶3 000,Forevergen)室温下孵育1~2 h,用TBST每次7 min洗3次后,进行化学发光显影(ECL,Forevergen)。用Image J分析目标条带的光密度值。以GAPDH(1∶5 000)作为内参照,比较不同处理后上述蛋白表达的差异。
1.4.4TUNEL法测定细胞凋亡 按TUNEL试剂盒的说明逐步添加试剂,检测心肌细胞凋亡。每片随机选取5个视野,计算阳性细胞百分率即细胞凋亡率(每一片100个细胞核中凋亡核所占的百分比)。
1.4.5流式细胞术测定心肌细胞ROS的含量 细胞处理结束后,用4℃预冷的PBS洗涤细胞2次,加入0.25%胰蛋白酶消化细胞后收集,将配制好的10
μmol·L-1DCFH-DA溶液500 μL重悬细胞,37℃孵育30 min,离心,800×g,5 min,弃上清,预冷的PBS洗涤细胞2次,制成1×108cells·L-1的悬液,立即进行流式细胞仪检测,以488 nm为激发波长,530 nm为发射波长。
2 结果
2.1PCB2对LPS诱导的细胞活力的影响 用MTT的方法评价PCB2是否对LPS诱导的心肌细胞损伤具有保护作用。如Fig 2所示,LPS诱导的细胞损伤组(LPS)与正常对照组(Control)比较,心肌细胞活力明显降低(P<0.01),PCB2低、中、高剂量组与LPS组相比细胞活力均明显升高,且具有剂量依赖性(P<0.01)。
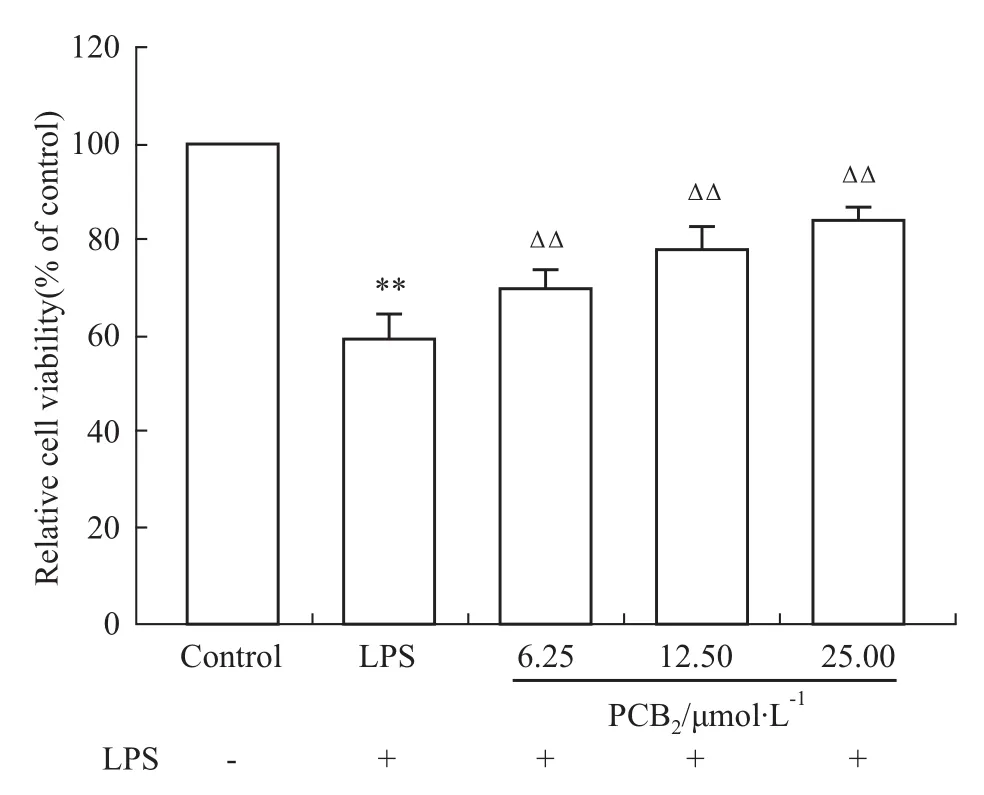
Fig 2 Influence of PCB2on LPS-induced cell vitality(±s)
2.2PCB2对LPS诱导的心肌细胞NOX活性的影响 NADPH氧化酶是心血管系统ROS的重要来源,因此我们观察了心肌细胞NOX活性是否与PCB2的抗凋亡作用有关。如Fig 3所示,LPS诱导的细胞损伤组与正常对照组比较,心肌细胞NOX活性明显增加(P<0.01),PCB2低、中、高剂量组与LPS组相比,细胞NOX活性均明显降低,且具有剂量依赖性(P<0.01)。
2.3PCB2对LPS诱导的心肌NADPH氧化酶p47phox亚基表达的影响 用Western blot的方法分析NADPH氧化酶p47phox亚基的表达。如Fig 4所示,LPS诱导的细胞损伤组与正常对照组比较,p47phox亚基的表达明显增加(P<0.01),PCB2低、中、高剂量组与LPS组相比p47phox亚基的表达均明显降低,且具有剂量依赖性(P<0.01)。
2.4PCB2对LPS诱导的细胞凋亡的影响 TUNEL法检测心肌细胞凋亡,Fig 5结果显示,LPS诱导的细胞损伤组与正常对照组比较,凋亡细胞明显增加(P<0.01);PCB2低、中、高剂量组与LPS组相比凋亡细胞均明显减少,且具有剂量依赖性(P<0.01)。

Fig 3 Influence of PCB2on LPS-induced NOX activity(±s)

Fig 4 Influence of PCB2on LPS-induced p47phoxexpression(±s)
2.5PCB2对LPS诱导的心肌细胞ROS含量的影响 为了确定ROS是否涉及PCB2的抗凋亡作用,用流式细胞术检测ROS的含量。如Fig 6所示,LPS诱导的细胞损伤组与正常对照组比较,ROS含量明显增加(P<0.01);PCB2低、中、高剂量组与LPS组
相比ROS含量均明显减少,且具有剂量依赖性(P<0.01)。

Fig 5 Influence of PCB2on LPS-induced apoptosis(±s)
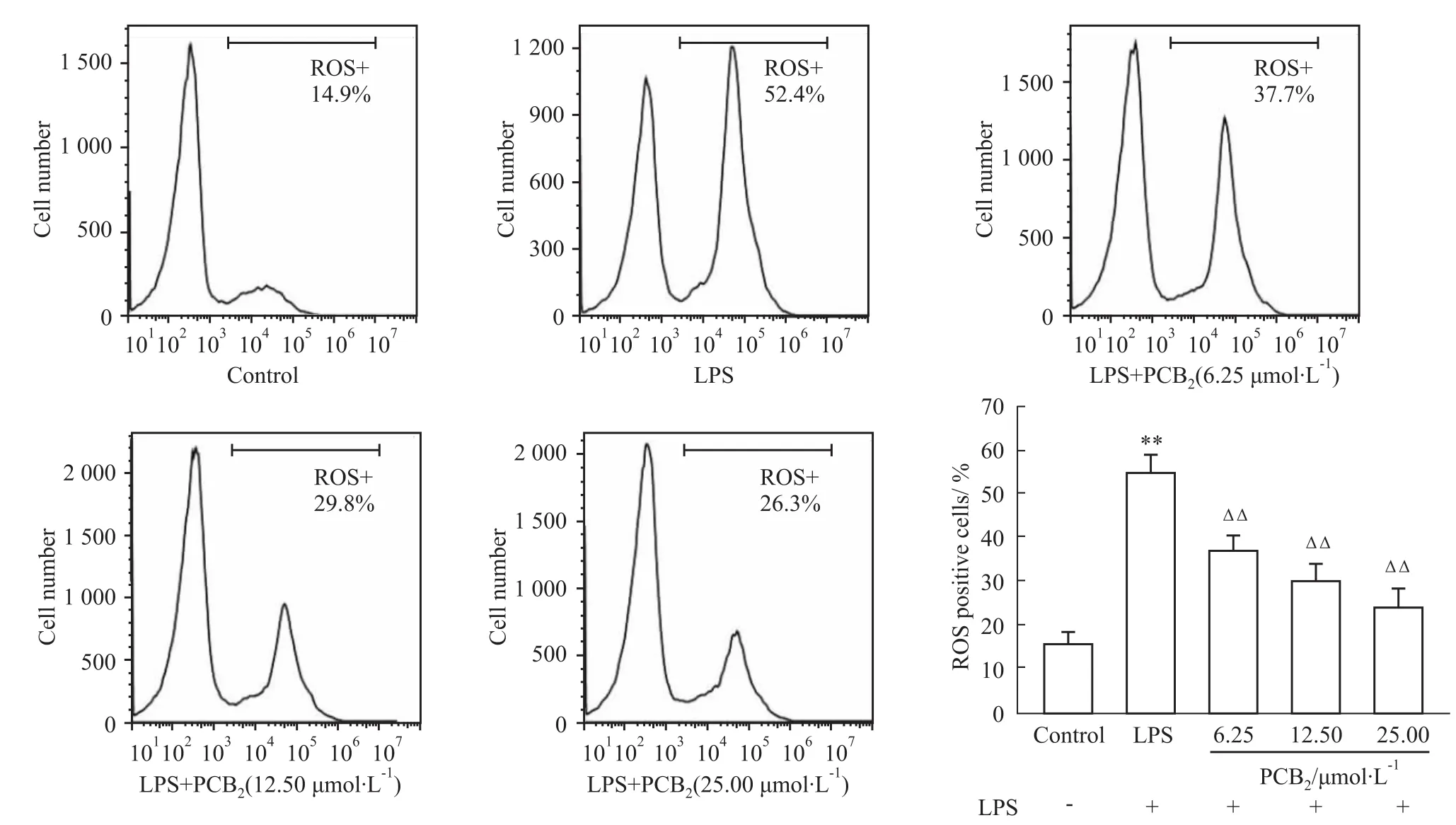
Fig 6 Influence of PCB2on LPS-induced cardiacmyocyte ROS content(±s)
3 讨论
本研究结果发现,原花青素B2能够保护脂多糖诱导的心肌细胞凋亡。这种保护作用与其抑制NADPH氧化酶的激活,NADPH氧化酶p47phox亚基的表达以及ROS的生成有关。
细胞凋亡与细胞内大量产生的ROS有关。ROS作为细胞内的一种信号分子,在细胞死亡过程中发挥着重要的作用[16]。它能改变细胞信号,损伤蛋白质和DNA,从而导致细胞凋亡[17]。氧化应激可间接通过对DNA、脂质和蛋白的损害,或更直接地激活ASK-1、JNK和ERK1/2等促凋亡信号分子而导致心肌细胞凋亡[18]。脂多糖能诱导心肌细胞ROS产生增加,ROS是具有高化学反应活性的分子,在血管张力、细胞生长、迁移、增殖、肥大,细胞凋亡和基质沉积等许多生理和病理过程的调节中发挥关键作用[19]。心肌细胞内ROS的来源包括线粒体电子传递链、黄嘌呤氧化酶、“非偶联”的一氧化氮合酶、细胞色素P450和NADPH氧化酶。在这些来
源当中,只有NADPH氧化酶是以高度受调节的方式产生ROS,是细胞内ROS的主要来源[20]。NAD-PH氧化酶是由5个同型异构体组成的酶家族:Nox1、Nox2、Nox3、Nox4、Nox5。酶复合体由2个位于细胞膜的亚基(gp91phox和gp22phox,两者构成细胞色素b558)和至少4种胞质蛋白(p40phox、p47phox、p67phox和Rac-1/2,构成胞质复合体)组成。在心血管系统,Nox2、Nox4在内皮细胞、心肌细胞和成纤维细胞中表达[21-23]。急性心肌梗死大鼠细胞损伤就与Nox2表达增加有关[24]。胞质蛋白p47phox对激活Nox2起着关键性的作用[25]。在本研究中,我们发现LPS处理以后,心肌细胞NOX活性明显增强,p47phox表达以及ROS产生明显增多;PCB2能明显减弱NOX活性,减少p47phox的表达以及ROS的产生,并伴随着心肌细胞凋亡的减少,提示PCB2是通过抑制NADPH氧化酶衍生的ROS,达到保护LPS诱导的心肌细胞凋亡的作用。目前有两种以NADPH氧化酶为靶点的治疗药物:一种是抑制p47phox与Nox2的结合[26],另一种是抑制转录因子Ets-1[27]和LOX-1[28]的表达,进而抑制NADPH氧化酶的表达。PCB2是否通过上述机制发挥抑制NADPH氧化酶的作用,值得进一步研究。
总之,本研究结果发现PCB2通过抑制NADPH氧化酶激活、p47phox的表达以及活性氧的产生,发挥对脂多糖诱导的心肌细胞凋亡的保护作用。我们的工作为PCB2对心肌细胞的保护作用提供了新的见解,这有可能是未来作为临床应用治疗脓毒症相关的心肌细胞凋亡的一个潜在的药理学基础。
[致谢:本文实验在深圳市中医院国家中医药科研三级实验室(No:TCM-2009-289)完成,在此表示衷心感谢。]
参考文献:
[1] Merx M W,Weber C.Sepsis and the heart[J].Circulation,2007,116(7):793-802.
[2] Wesche-Soldato D E,Swan R Z,Chung C S,et al.The apoptotic pathway as a therapeutic target in sepsis[J].Curr Drug Targets,2007,8(4):493-500.
[3] Matsuno K,Iwata K,Matsumoto M,et al.NOX1/NADPH oxi-dase is involved in endotoxin-induced cardiomyocyte apoptosis [J].Free Radic Biol Med,2012,53(9):1718-28.
[4] 陈召桂,卢艳花,魏东芝.HPLC测定葡萄籽提取物中原花青素B2的含量[J].中成药,2007,29(11):1645-7.
[4] Chen Z G,Lu Y H,Wei D Z.Determination of procyanidin B2in grape seed extract by RP-HPLC[J].Chin Tradit Patent Med,2007,29(11):1645-7.
[5] Shao Z H,Becker L B,Vanden Hoek T L,et al.Grape seed pro-anthocyanidin extract attenuates oxidant injury in cardiomyocytes[J].Pharmacol Res,2003,47(6):463-9.
[6] Sakano K,Mizutani M,Murata M,et al.Procyanidin B2has anti-and pro-oxidant effects on metal-mediated DNA damage[J].Free Rad Biol Med,2005,39(8):1041-9.
[7] Avelar M M,Gouvêa C M.Procyanidin B2cytotoxicity to MCF-7 human breast adenocarcinoma cells[J].Indian J Pharm Sci,2012,74(4):351-5.
[8] Mackenzie G G,Adamo A M,Decker N P,Oteiza P I.Dimeric procyanidin B2inhibits constitutively active NF-kappaB in Hodgkin′s lymphoma cells independently of the presence of Ikap-paB mutations[J].Biochem Pharmacol,2008,75(7):1461-71.
[9] Chen D M,Cai X,Kwik-Uribe C L,et al.Inhibitory effects of procyanidin B(2)dimer on lipid-laden macrophage formation [J].J Cardiovasc Pharmacol,2006,48(2):54-70.
[10]Houde V,Grenier D,Chandad F.Protective effects of grape seed proanthocyanidins against oxidative stress induced by lipopolysac-charides of periodontopathogens[J].J Periodontol,2006,77 (8):1371-9.
[11]Li B Y,Li X L,Cai Q,et al.Induction of lactadherin mediates the apoptosis of endothelial cells in response to advanced glycation end products and protective effects of grape seed procyanidin B2and resveratrol[J].Apoptosis,2011,16(7):732-45.
[12]Cai Q,Li B Y,Gao H Q,et al.Grape seed procyanidin B2inhibits human aortic smooth muscle cell proliferation and migration in-duced by advanced glycation end products[J].Biosci Biotechnol Biochem,2011,75(9):1692-7.
[13]张晓晖,孙智达,李书艺,等.荔枝壳原花青素对脓毒症大鼠心肌细胞凋亡的作用及其机制研究[J].中国药理学通报,2015,31(7):931-5.
[13]Zhang X H,Sun Z D,Li S Y,et al.Protective effects of LPPC on cardiomyocyte apoptosis in septic rats[J].Chin Pharmacol Bull,2015,31(7):931-5.
[14]张晓晖.葡萄籽原花青素体外抗血小板聚集的机制研究[J].中国病理生理杂志,2012,28(4):714-7.
[14]Zhang X H.In vitro anti-platelet aggregative effect of procyanidins isolated from grape seeds[J].Chin J Pathophysiol,2012,28 (4):714-7.
[15]刘 蜜,王晓秖,陶天琪,等.西洋参茎叶总皂苷通过抑制内质网应激减轻毒胡萝卜素诱导的心肌细胞凋亡[J].中国病理生理杂志,2014,30(10):1735-41.
[15]Liu M,Wang X R,Tao T Q,et al.PQS attenuates cardiomyocyte apoptosis induced by thapsigargin through inhibiting endoplasmic reticulum stress[J].Chin J Pathophysiol,2014,30(10):1735-41.
[16]Bao M H,Dai W,Li Y J,et al.Rutaecarpine prevents hypoxia-reoxygenation induced myocardial cell apoptosis via inhibition of NADPH oxidases[J].Can J Physiol Pharmacol,2011,89(3):177-86.
[17]Choi J Y,Kim B M,Kim Y J,et al.Hypoxia/reoxygenation-in-duced cytotoxicity in cultured human lymphocytes[J].Biochem Biophys Res Commun,2007,352(2):366-71.
[18]Matsuzawa A,Ichijo H.Stress-responsive protein kinases in redox-
regulated apoptosis signaling[J].Antioxid Redox Signal,2005,7 (3-4):472-81.
[19]Akki A,Zhang M,Murdoch C,et al.NADPH oxidase signaling and cardiac myocyte function[J].J Mol Cell Cardiol,2009,47 (1):15-22.
[20]Bedard K,Krause K H.The NOX family of ROS-generating NAD-PH oxidases:physiology and pathophysiology[J].Physiol Rev,2007,87(1):245-313.
[21]Ago T,Kitazono T,Ooboshi H,et al.Nox4 as the major catalytic component of an endothelial NAD(P)H oxidase[J].Circulation,2004,109(2):227-33.
[22]Cucoranu I,Clempus R,Dikalova A,et al.NAD(P)H oxidase 4 mediates transforming growth factor-β1-induced differentiation of cardiac fibroblasts into myofibroblasts[J].Circ Res,2005,97 (9):900-7.
[23]Byrne J A,Grieve D J,Bendall J K,et al.Contrasting roles of NADPH oxidase isoforms in pressure-overload versus angiotensin II-induced cardiac hypertrophy[J].Circ Res,2003,93(9):802 -5.
[24]Fukui T,Yoshiyama M,Hanatani A,et al.Expression of p22phoxand gp91phox,essential components of NADPH oxidase,increases after myocardial infarction[J].Biochem Biophys Res Commun,2001,281(5):1200-6.
[25]Cai H,Griendling K K,Harrison D G.The vascular NADPH oxi-dases as therapeutic targets in cardiovascular diseases[J].Trends Pharmacol Sci,2003,24(9):471-8.
[26]Jacobson G M,Dourron H M,Liu J,et al.Novel NAD(P)H oxi-dase inhibitor suppresses angioplasty-induced superoxide and neointimal hyperplasia of rat carotid artery[J].Circ Res,2003,92(6):637-43.
[27]Ni W,Zhan Y,He H,et al.Ets-1 is a critical transcriptional reg-ulator of reactive oxygen species and p47phoxgene expression in re-sponse to angiotensin II[J].Circ Res,2007,101(10):985-94.
[28]Khaidakov M,Szwedo J,Mitra S,et al.Anti-angiogenic and anti-mitotic effects of aspirin in hypoxia-reoxygenation modulation of LOX-1-NADPH oxidase axis as potential mechanism[J].J Card-iovasc Pharmacol,2010,56(6):635-41.
Procyanidin B2protects LPS-induced myocardial cell apoptosis
ZHANG Xiao-hui1,ZENG Fan-dian2,SUN Zhi-da3,YANG Zhuo-xin1,XIONG Yi-qun1,XU Chao-ying1,LIU Xin-liang1,LIN Jian1,MU Gui-ping1,XU Shao-gang1,LIU Wen-he1
(1.Chinese Medicine Institute of Shenzhen TCM Hospital,Shenzhen Guangdong 518033,China;2.Tongji Medical College of Huazhong University of Science and Technology,Wuhan 430030,China;3.College of Food Science and Technology of Huazhong Agricultural University,Wuhan 430070,China)
Abstract:Aim To study the mechanisms of the pro-tective effect of procyanidin B2(PCB2)on the myocar-dial cell apoptosis induced by lipopolysaccharide (LPS).Methods Using the primary culture rat myo-cardial cells,myocardial cell injury model was induced by LPS.PCB2low,medium and high dose groups,were cultured with 6.25,12.5,25.0 μmol·L-1PCB2respectively in DMEM medium for 24 h continu-ously.Myocardial cell survival rate was determined by MTT colorimetric method.Cardiacmyocyte NOX activi-ty was determined by lucigen chemiluminescence meth-od.Western blot analysis was used to detect myocardi-al NADPH oxidase p47phoxexpression.TUNEL method was used to detect apoptosis and flow cytometry was used to determine the content of myocardial cells ROS.Results Compared with control group,the cell dam- age induced by LPS group myocardial cell survival rate significantly decreased(P<0.01),and myocardial cell NOX activity,p47phoxexpression,apoptotic cell number and ROS content were significantly increased (P<0.01).PCB2low,medium and high dose groups cell survival rates were significantly elevated,myocar-dial cell NOX activity and p47phoxexpression,apoptotic cell number and the ROS content decreased significant-ly in a dose-dependent manner(P<0.01).Conclu-sion PCB2protects myocardial cell apoptosis induced by LPS via inhibiting the expression of NADPH oxidase activation,p47phoxexpression and reactive oxygen spe-cies generation.
Key words:procyanidin B2;lipopolysacchride;car-diomyocyte;apoptosis;NADPH oxidase;reactive oxy-gen species
通讯作者
作者简介:张晓晖(1975-),女,博士,副主任药师,研究方向:心血管药理学、中药药理学,,Tel:0755-88359666,E-mail:767682665@qq.com
基金项目:国家自然科学基金资助项目(No 81101450);深圳市科技研发资金知识创新计划资助项目(No JCYJ20130329 155553734)
收稿日期:2015-07-31,修回日期:2015-08-23
文献标志码:A
文章编号:1001-1978(2015)11-1510-06
doi:10.3969/j.issn.1001-1978.2015.11.008

