IL-17单克隆抗体对肺纤维化大鼠的保护作用及部分机制研究
刘理静,钱 红,尹辉明,张 平,王在岩,肖 华
(1.湖南医药学院临床医学院,湖南怀化 418000;2.湖南医药学院附属第一医院呼吸内科,湖南怀化 418000;3.南华大学附属第一医院呼吸内科,湖南衡阳 421001)
IL-17单克隆抗体对肺纤维化大鼠的保护作用及部分机制研究
刘理静1,2,钱 红1,尹辉明2,张 平3,王在岩3,肖 华3
(1.湖南医药学院临床医学院,湖南怀化 418000;2.湖南医药学院附属第一医院呼吸内科,湖南怀化 418000;3.南华大学附属第一医院呼吸内科,湖南衡阳 421001)
中国图书分类号:R-332;R322.35;R392.11;R392.12;R563.13;R977.6
摘要:目的 探讨白介素(IL)-17单克隆抗体(mAb)对博莱霉素所致大鼠肺纤维化的保护作用及相关机制。方法 将♂SD大鼠75只随机分为正常对照组、假手术组、模型组、非特异性IgG组、IL-17 mAb组,各组15只,后3组大鼠予以博莱霉素A5气管内注入构建肺纤维化模型,而假手术组给予等量生理盐水气管内注入。后2组于d 7、14、21分别给予非特异性IgG、IL-17 mAb尾静脉注射,其余3组给予等量生理盐水尾静脉注射。所有大鼠d 28处死,留取肺组织,行HE和Masson染色,通过酶联免疫吸附法(ELISA)测定肺组织IL-17、IL-6、肿瘤坏死因子-α(TNF-α)含量,Western blot分析肺组织胞核核因子-κB(NF-κB)p65以及细胞Ⅰ型胶原(ColⅠ)、Ⅲ型胶原(ColⅢ)蛋白表达情况,荧光实时定量PCR检测肺组织ColⅠ、ColⅢmRNA表达水平,分离血清,采用ELISA检测血清Ⅰ型前胶原羧基端前肽(PICP)、Ⅲ型前胶原氨基端前肽(PIIINP)浓度。结果 IL-17mAb组肺泡炎症和肺纤维化程度明显轻于模型组及非特异性IgG组(P <0.01)。模型组和非特异性IgG组肺组织IL-17、IL-6、TNF-α含量、胞核NF-κB p65蛋白表达、ColⅠ、ColⅢmRNA和蛋白表达以及血清PICP、PIIINP浓度较正常对照组及假手术组明显升高(P<0.01)。经IL-17 mAb处理后,上述指标相比模型组和非特异性IgG组明显降低(P<0.01)。但非特异性IgG组与模型组以及假手术组与正常对照组上述指标比较无差异(P>0.05)。结论 IL-17 mAb通过下调NF-κB表达,抑制肺组织炎症反应及减少胶原蛋白合成,对肺纤维化大鼠产生保护作用。
关键词:白介素-17单克隆抗体;肺纤维化;炎症反应;白介素-6;肿瘤坏死因子-α;核因子-κB;Ⅰ型胶原;Ⅲ型胶原
网络出版时间:2015-10-16 9:52 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20151016.0952.042.html
肺纤维化是各种不同病因引起的间质性肺疾病的最终结局,以肺间质内单核/巨噬细胞等炎症细胞浸润、成纤维细胞异常增殖和胶原蛋白过量沉积为特征,迄今尚无有效的临床治疗方法,预后极差,死亡率高,严重危害人类健康,因而迫切需要开发有效治疗或逆转肺纤维化的药物[1]。尽管肺纤维化的发病机制尚未完全阐明,但多种炎症因子在其发生和发展中发挥着关键作用[2]。白介素-17(interleu-kin-17,IL-17)是由Th17细胞产生的一种重要促炎症细胞因子,参与介导了多种炎症反应和自身免疫性疾病的发生发展[3-4]。研究表明,IL-17可促进心肌、肝脏及肾脏等组织纤维化[5-7],向气管内注射大剂量IL-17可诱发肺纤维化[8]。我们前期研究也发现,IL-17在肺纤维化大鼠中表达增高[9]。这些结果提示IL-17与组织纤维化密切相关,阻断IL-17表达可望成为分子治疗新的靶点。IL-17单克隆抗体(monoclonal antibody,mAb)已被尝试用于银屑病、克劳恩病及强直性脊柱炎等自身免疫性疾病的治疗,并显示出较好的效果[10-11]。新近研究报道,IL-17中和抗体能减少成纤维细胞过度增殖,并明显改善肺纤维化小鼠的肺功能[12-13],但其作用机制仍不清楚。为此,本研究采用气管内注射博莱霉素构建大鼠肺纤维化模型,观察IL-17mAb对大鼠肺纤维化病理改变、核因子-κB(nuclear factor-κB,NF-κB)、炎症因子和胶原蛋白表达的影响,探索IL-17mAb对肺纤维化大鼠的保护作用及其相关机制,为其应用于肺纤维化的治疗提供理论基础和实验依据。
1 材料与方法
1.1实验动物与药品 75只清洁级♂SD大鼠,8 ~10周龄,体质量为(283±13)g,由南华大学实验动物学部提供,实验动物使用许可证号:SYKK(湘)2010-0006,随机分笼于SPF级环境中,常规颗粒饲料饲养。博莱霉素A5为天津太和制药有限公司产品(批号070501)。RNA提取试剂TRIzol、PVDF膜购自美国Invitrogen公司。逆转录试剂盒为美国Promega公司出品。兔抗大鼠IL-17单克隆抗体、非
特异性IgG、兔抗大鼠NF-κB p65、Ⅰ型胶原(colla-gen typeⅠ,ColⅠ)、Ⅲ型胶原(collagen typeⅢ,ColⅢ)、β-actin抗体购于Santa Cruz公司。ELISA检测试剂盒为美国R&D公司产品。
1.2模型制备与分组给药 随机将75只♂SD大鼠分为正常对照组、假手术组、模型组、非特异性IgG组、IL-17 mAb组,各组15只。后4组予以100 g·L-1水合氯醛(3 mL·kg-1)腹腔注射麻醉大鼠后,切开颈正中部,使气管充分暴露,其中模型组、非特异性IgG组、IL-17 mAb组用溶解了博莱霉素A5 (5 mg·kg-1)的生理盐水0.2 mL一次性向气管内注射,而假手术组给予等体积生理盐水气管内注入,直立大鼠并旋转,以使药液在肺内均匀分布。造模后d 7、14、21,非特异性IgG组尾静脉注射非特异性IgG(200 μg·kg-1),IL-17 mAb组尾静脉注射IL-17 mAb(200 μg·kg-1),正常对照组、假手术组、模型组则尾静脉注射等量生理盐水。d 28,麻醉大鼠后无菌开胸,以心脏采血法采集血液3 mL,离心并提取血清,保存于-20℃冰箱内,用于测定Ⅰ型前胶原羧基端前肽(procollagen type 1 carboxyterminal propeptide,PICP)、Ⅲ型前胶原氨基端前肽(procol-lagen typeⅢaminoterminal propeptide,PIIINP)浓度。然后行颈动脉放血将全部大鼠处死,截取右肺组织,冻存于-70℃液氮中,以供双抗体夹心酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)、Western blot和荧光实时定量PCR检测。再使用0.1 mol·L-1中性缓和福尔马林经主支气管注入左肺内,使胸膜展开后,再固定于0.1 mol·L-1中性福尔马林中至少24 h,石蜡包埋,切片,用于肺组织病理学检查。
1.3肺组织病理学改变 将左肺石蜡切片后,行常规苏木精-伊红(hematoxylin-eosin,HE)染色及Mas-son染色,参照Szapiel等[14]方法,采用HE染色在光镜下评定肺组织肺泡炎症程度:0分:无肺组织炎;1分:轻度肺组织炎,仅局部或近胸膜部有炎性细胞浸润,面积在20%以内;2分:中度肺组织炎,面积在20%~50%之间;3分:重度肺组织炎,面积达50%以上。采用Masson染色于光镜下评定肺组织纤维化程度:0分:无肺纤维化;1分:轻度肺纤维化,病变面积未超过全肺20%;2分:中度肺纤维化,病变面积达到全肺20%~50%;3分:重度肺纤维化,病变面积在50%以上,肺泡结构破坏。
1.4Western blot 按照试剂盒(美国ProMab公司)的说明书提取右肺组织细胞核蛋白和细胞蛋白,并测定蛋白浓度。常规制备SDS-PAGE凝胶,上样、电泳并转膜,室温下用5%脱脂牛奶封闭4 h,再分别滴加1∶500稀释的兔抗大鼠NF-κB p65、ColⅠ、ColⅢ、β-actin一抗,于4℃条件下反应过夜,洗膜后加入1∶2 500稀释的辣根过氧化物酶标记的山羊抗兔IgG,室温下孵育1h,ECL显色、暗室曝光,利用Labwork凝胶图像分析系统扫描胶片后得出目的蛋白(NF-κB p65、ColⅠ、ColⅢ)灰度值,目的蛋白表达水平=NF-κB p65、ColⅠ、ColⅢ灰度值/β-actin灰度值。
1.5荧光实时定量PCR 使用TRIzol试剂提取肺组织样本中总RNA,并用无RNase水溶解后,每个样本利用紫外分光光度计测定总RNA的A260/280比值,结果均在1.8~2.0之间,达到实验要求。取2 μg总RNA,然后用逆转录试剂盒合成cDNA。引物序列由上海生工生物技术有限公司参照文献[15]合成,ColⅠ引物序列:上游5′-CTTGGCTCCTGCTC-TACCTC-3′,下游5′-CAACGGCCAGAACTTAAGC-CCA-3′,扩增产物长度为114 bp;ColⅢ引物序列:上游5′-GGTGCAGCTCAGTTGCTTGAAT-3′,下游5′-GTTCTTGGTGCAGTGTTATGTAATG-3’,扩增产物长度145 bp;β-actin引物序列:上游5′-CTGATCATGT-CAAACTTAGCTCAA-3′,下游5′-TACTGTGGTGT-GTCG TTCCAGTGG-3′,扩增产物长度为136 bp。取10 μL的cDNA进行PCR循环,条件:94℃预变性3 min,94℃变性40 s,62℃复性40s,60℃延伸60 s,共40个循环。经溶解曲线分析PCR反应产物为单独的双链DNA。以β-actin为内参照,采用ΔΔCt值法定量ColⅠ、ColⅢmRNA的表达。
1.6ELISA 取适量右肺组织,进行充分匀浆后,离心并提取上清液,由专人按照ELISA试剂盒提供的方法分别测定上清液IL-17、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)含量以及血清PICP、PIIINP浓度。
1.7统计学处理 采用SPSS 13.0统计软件分析全部资料,实验数据以±s表示,采用单因素方差分析比较多组均数以及q检验进行两两之间比较。
2 结果
2.1IL-17mAb对博莱霉素所致大鼠肺纤维化的影响 实验过程中,各组大鼠无死亡。正常对照组、假手术组大鼠肺组织无炎症细胞浸润及纤维化发生,肺泡结构清晰;模型组、非特异性IgG组HE染色可见较多的巨噬细胞等炎症细胞浸润,大量成纤维细胞增生,肺泡间隔明显增厚,部分肺泡腔被纤维组织占据,肺泡壁被破坏,Masson染色可见大量蓝色胶原沉积于肺间质内,广泛纤维化形成;IL-
17mAb组的上述病理变化明显减轻(Fig 1、2)。并且IL-17mAb组肺泡炎与肺纤维化评分较模型组及非特异性IgG组明显降低(P<0.01),而非特异性IgG组与模型组相比无差异(P>0.05),见Tab 1。

Fig 1 Effect of IL-17mAb on inflammation of lung tissues (HE×200)
Tab 1 Comparison of alveolitis and pulmonary fibrosis scores among groups(±s,n=15)

Tab 1 Comparison of alveolitis and pulmonary fibrosis scores among groups(±s,n=15)
**P<0.01 vs model group or non-specific IgG group
Group Alveolitis (Scores)Pulmonary fibrosis (Scores)Model 1.51±0.35 2.21±0.42 Non-specific IgG 1.42±0.32 2.11±0.39 IL-17 mAb 0.75±0.14 1.38±0.27**
2.2IL-17mAb对肺纤维化大鼠肺组织IL-17、IL-6、TNF-α含量及血清PICP、PIIINP浓度的影响为了探讨IL-17mAb是否通过抑制炎症反应和胶原合成而保护肺纤维化大鼠,应用ELISA测定各组大鼠肺组织IL-17、IL-6、TNF-α含量及血清PICP、PII- INP浓度。结果显示,与正常对照组、假手术组相比,模型组和非特异性IgG组肺组织IL-17、IL-6、TNF-α含量及血清PICP、PIIINP浓度明显增加(P<0.01),但IL-17 mAb组上述指标较模型组、非特异性IgG组明显减少(P<0.01)。然而,假手术组与正常对照组以及非特异性IgG组与模型组比较,差异无显著性(P>0.05),见Tab 2。

Fig 2 Effect of IL-17mAb on fibrosis of lung tissues(Masson ×200)
2.3IL-17 mAb对肺纤维化大鼠肺组织胞核NF-κB p65表达的影响 通过Western blot检测各组肺组织中胞核NF-κB p65蛋白的表达,以进一步明确IL-17 mAb抑制肺纤维化大鼠炎症反应的机制。如Fig 3所示,模型组、非特异性IgG组胞核NF-κB p65蛋白表达水平较正常对照组、假手术组升高(P <0.01),尾静脉注射IL-17mAb治疗后,胞核NF-κB p65蛋白表达水平较模型组、非特异性IgG组下降(P<0.01),但非特异性IgG组与模型组及假手术组与正常对照组之间差异无显著性(P>0.05)。
Tab 2 Comparison of pulmonary tissues IL-17,IL-6,TNF-α contents and serum PICP,PIIINP concentrations among groups(±s,n=15)

Tab 2 Comparison of pulmonary tissues IL-17,IL-6,TNF-α contents and serum PICP,PIIINP concentrations among groups(±s,n=15)
**P<0.01 vs normal control group or sham operated group;##P<0.01 vs model group or non-specific IgG group
Group IL-17/μg·L-1 IL-6/μg·L-1 TNF-α/μg·L-1 PICP/μg·L-1 PIIINP/ng·L-1Normal control 43.45±4.68 54.27±4.76 31.42±3.43 7.11±1.48 85.73±10.11 Sham operation 45.13±4.45 56.08±4.65 32.81±3.65 7.23±1.61 87.12±10.67 Model 92.67±9.72 128.06±10.21 65.39±5.82 34.07±5.62 182.05±15.06**Non-specific IgG 88.54±9.65 122.74±10.33 62.71±5.68 31.85±6.15 173.83±14.85**IL-17mAb 51.08±6.33## 62.15±6.29## 35.76±3.68## 16.95±4.23## 118.87±13.35##
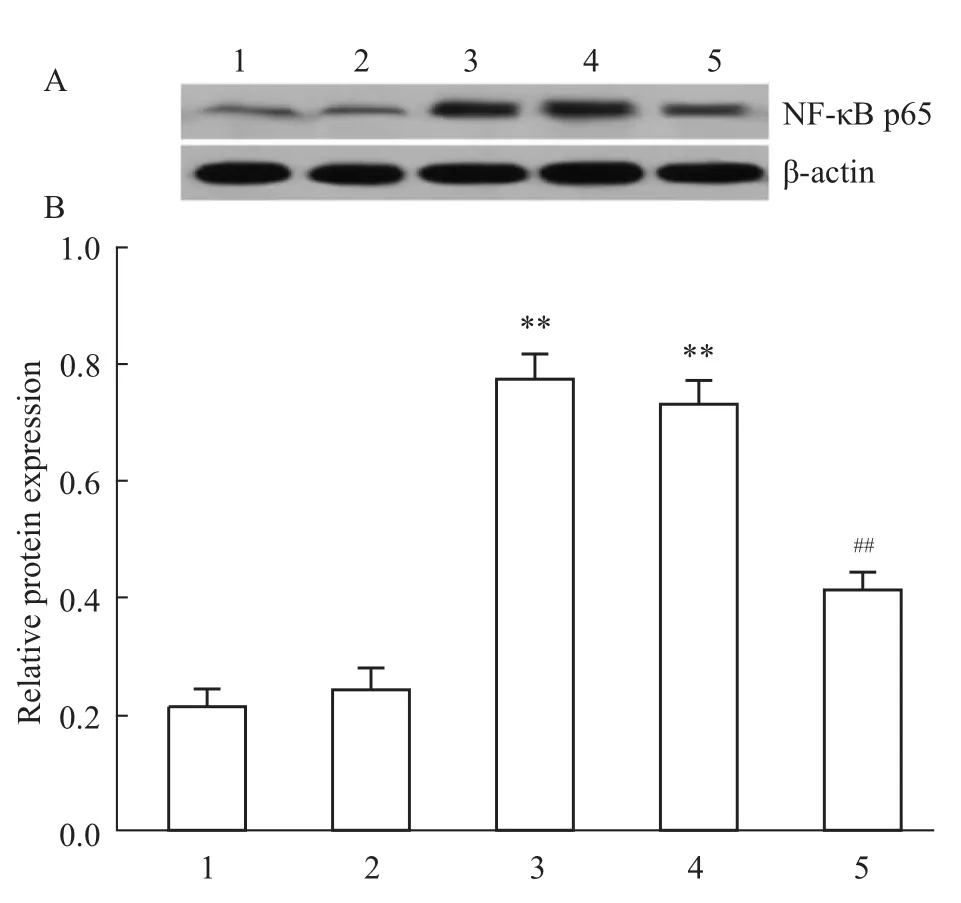
Fig 3 Expression of NF-κB p65 in the pulmonary tissues nucleus among groups
2.4IL-17 mAb对肺纤维化大鼠肺组织ColⅠ、ColⅢ表达的影响 利用荧光实时定量PCR和Western blot检测各组肺组织中ColⅠ、ColⅢmRNA和蛋白表达,进一步证实IL-17mAb通过抑制胶原蛋白合成而抗肺纤维化。结果表明,与正常对照组、假手术组比较,模型组和非特异性IgG组肺组织ColⅠ、ColⅢmRNA和蛋白表达水平明显升高(P<0.01),经IL-17 mAb治疗后,肺组织ColⅠ、ColⅢmRNA和蛋白表达水平较模型组和非特异性IgG组明显下降(P<0.01),但非特异性IgG组与模型组以及假手术组与正常对照组相比无区别(P>0.05),见Fig 4。
3 讨论
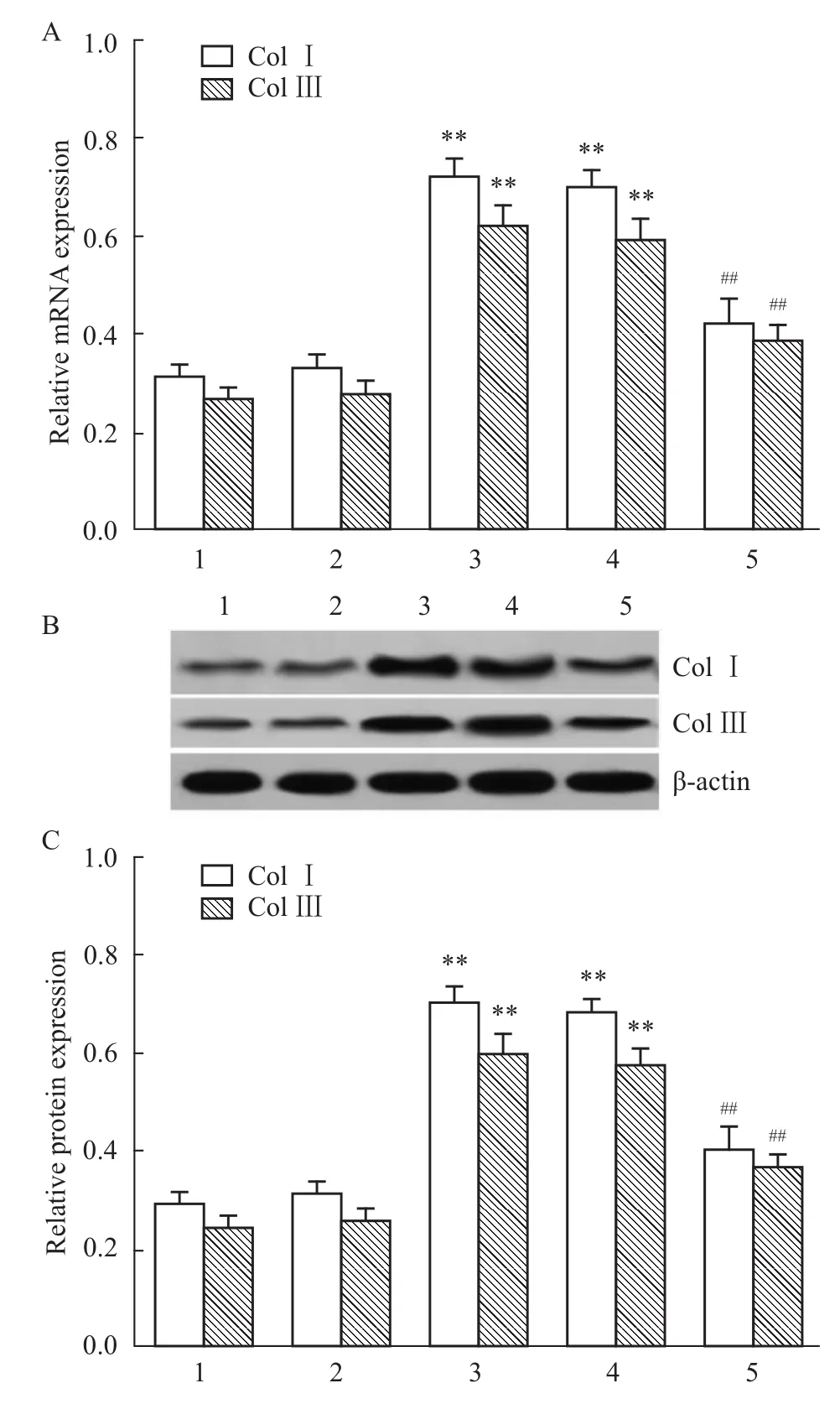
Fig 4 Expression of ColⅠand ColⅢin the pulmonary tissues among groups
肺纤维化是肺泡不断损伤、成纤维细胞增殖及细胞外基质(extracellular matrix,ECM)大量沉积致使肺组织持续破坏,过度修复,最终大量胶原沉积于肺间质的一类疾病,是肺损伤、免疫反应、炎症反应和纤维生成4个要素的综合结果。目前,临床治疗以激素和免疫抑制剂为主,但效果较差,且不良反应大,限制了其应用[1,16]。过度炎症反应已被证实在肺纤维化形成中起重要作用[17],IL-17作为一种强效的促炎症因子在多种纤维化疾病中表达增高[18],阻断IL-17介导的炎症反应已成为治疗纤维化疾病的新途径。实验发现,中和IL-17活性能预防小鼠肺损伤后肺纤维化的发生[19]。本实验结果显示,行气管切开术后的假手术组与正常对照组肺组织内均无肺泡炎症与纤维化改变,两组无统计学差异,完全可以排除手术损伤本身以及气管内灌注生理盐水的影响。模型组及非特异性IgG组肺组织炎症与纤维化明显,符合肺纤维化模型标准。此外,IL-17 mAb组肺泡炎与肺纤维化评分比模型组和非特异性IgG组明显降低,与文献报道一致[13,19],说明IL-17 mAb通过特异性抑制IL-17的活性,从而减少巨噬细胞等炎症细胞的趋化聚集,减轻博莱霉素所致急性肺损伤后的炎症反应,抑制肺组织的过度修复,减少胶原纤维沉积,进而改善肺纤维化,提示IL-17 mAb对
博莱霉素所致大鼠肺纤维化具有良好的治疗效果。然而,非特异性IgG组与模型组相比无区别,进一步证实了非特异性IgG无此阻断作用。
肺损伤后炎症细胞的浸润、活化导致促炎细胞因子的异常表达与肺纤维化的病理生理过程密切相关[9]。Wilson等[8]发现,博莱霉素诱导的肺纤维化是由IL-17所介导的多种炎症细胞因子共同作用的结果,肺损伤后Th17细胞分泌大量的IL-17可刺激并诱导成纤维细胞、巨噬细胞和上皮细胞产生IL-6、TNF-α、IL-1等多种促炎介质,协同且放大加强TNF-α致炎效应,从而介导炎症反应,最终导致肺纤维化。这表明IL-17、IL-6、TNF-α都是引起肺纤维化的关键促炎介质,抑制这些介质的产生可明显改善肺纤维化[20-21]。本研究结果显示,经过IL-17 mAb治疗后,大鼠肺组织IL-17、IL-6、TNF-α含量较模型组和非特异性IgG组明显减少,说明抑制促炎介质的分泌是IL-17 mAb抗肺纤维化的主要机制之一。NF-κB是炎症反应中重要的转录调节因子,通常以p50-p65异二聚体的形式与其抑制性蛋白IκB结合形成复合体,呈失活状态存在于静息细胞质里。当细胞外信号刺激细胞后,激活IκB激酶,将IκB磷酸化,随即与NF-κB解离,游离的NF-κB迅速移位入胞核,与核内TNF-α、IL-6、IL-8基因中特异性κB序列结合,强烈诱导TNF-α、IL-6等释放[22-23]。研究发现,IL-17能够通过NF-κВ信号通路促进成纤维细胞、上皮细胞分泌IL-6、IL-8以及上调TNF-α表达[24-25]。故本实验通过Western blot检测肺组织胞核NF-κB p65表达,进一步证实IL-17 mAb是否通过调控NF-κB减少这些促炎介质的表达,结果显示,与模型组和非特异性IgG组比较,IL-17 mAb处理组胞核NF-κB p65表达水平降低,提示IL-17 mAb通过下调NF-κB表达,减少促炎介质的释放,抑制肺组织炎症反应而抗肺纤维化。
ColⅠ、ColⅢ主要由成纤维细胞及转化后的肌成纤维细胞合成和分泌,是ECM的主要成分,它们过量聚积是肺纤维化的特征性病理改变[26-27]。当刺激因素作用于肺成纤维细胞后,能促进其合成ColⅠ、ColⅢ,增加ECM积聚,诱发肺纤维化,而IL-17抗体能减少肺成纤维细胞过度增殖及分泌羟脯氨酸[12]。本研究显示,大鼠经IL-17 mAb处理后,肺组织ColⅠ、ColⅢ表达水平较模型组和非特异性IgG组明显减少,提示抑制肺成纤维细胞增殖而降低ColⅠ、ColⅢ合成可能是IL-17 mAb抗肺纤维化的重要机制之一。PICP、PIIINP分别是合成ColⅠ、ColⅢ的前体多肽,它们随着ColⅠ、ColⅢ合成的增多而增加,故能良好反映ColⅠ、ColⅢ的含量,可用于间接评价纤维化程度[15]。本研究检测了大鼠血清PICP、PIIINP浓度,进一步证实IL-17 mAb的这种作用,结果发现各组PICP、PIIINP的浓度变化同ColⅠ、ColⅢ的变化趋势相同,证明IL-17 mAb通过降低肺组织胶原蛋白合成抑制大鼠肺纤维化。
综上所述,IL-17 mAb对大鼠肺纤维化具有保护作用,其机制可能与下调NF-κB表达,抑制肺组织炎症反应以及减少胶原蛋白合成有关,但其作用机制仍有待更深一步探讨。
(致谢:本实验在侗医药研究湖南省重点实验室和南华大学附属第一医院临床医学研究所完成,感谢张平教授及各位老师的指导和帮助。)
参考文献:
[1] Cottin V,Crestani B,Valeyre D,et al.Diagnosis and manage-ment of idiopathic pulmonary fibrosis:French practical guidelines [J].Eur Respir Rev,2014,23(132):193-214.
[2] Wollin L,Wex E,Pautsch A,et al.Mode of action of nintedanib in the treatment of idiopathic pulmonary fibrosis[J].Eur Respir J,2015,45(5):1434-45.
[3] Shabgah A G,Fattahi E,Shahneh F Z.Interleukin-17 in human inflammatory diseases[J].Postepy Dermatol Alergol,2014,31 (4):256-61.
[4] Jin W,Dong C.IL-17 cytokines in immunity and inflammation [J].Emerg Microbes Infect,2013,2(9):e60.
[5] Xie Y,Li M,Wang X,et al.In vivo delivery of adenoviral vector containing interleukin-17 receptor a reduces cardiac remodeling and improves myocardial function in viral myocarditis leading to di-lated cardiomyopathy[J].PLoS One,2013,8(8):e72158.
[6] Amara S,Lopez K,Banan B,et al.Synergistic effect of pro-in-flammatory TNF-α and IL-17 in periostin mediated collagen depo-sition:potential role in liver fibrosis[J].Mol Immunol,2015,64(1):26-35.
[7] Peng X,Xiao Z,Zhang J,et al.IL-17A produced by both γδ T and Th17 cells promotes renal fibrosis via RANTES-mediated leu-kocyte infiltration after renal obstruction[J].J Pathol,2015,235 (1):79-89.
[8] Wilson M S,Madala S K,Ramalingam T R,et al.Bleomycin and IL-1beta-mediated pulmonary fibrosis is IL-17A dependent[J].J Exp Med,2010,207(3):535-52.
[9] 刘理静,钱 红,张 平,等.大黄素对肺纤维化大鼠的保护作用及部分机制研究[J].中国药理学通报,2015,31(2):266-72.
[9] Liu L J,Qian H,Zhang P,et al.Protective effect of emodin on rats with pulmonary fibrosis and its partial mechanisms[J].Chin Pharmacol Bull,2015,31(2):266-72.
[10]Xiong H Z,Gu J Y,He Z G,et al.Efficacy and safety of secuki-numab in the treatment of moderate to severe plaque psoriasis:a meta-analysis of randomized controlled trials[J].Int J Clin Exp Med,2015,8(3):3156-72.
[11]Baeten D,Baraliakos X,Braun J,et al.Anti-interleukin-17A monoclonal antibody secukinumab in treatment of ankylosing spon-
dylitis:a randomised,double-blind,placebo-controlled trial[J].Lancet,2013,382(9906):1705-13.
[12]张 明,黄成亮,王文军,等.IL-17A抗体对成纤维细胞增殖及分泌羟脯氨酸的影响[J].免疫学杂志,2014,30(11):962-5.
[12]Zhang M,Huang C L,Wang W J,et al.The effect of IL-17A anti-body on proliferation and hydroxyproline secretion of fibroblasts [J].Immunol J,2014,30(11):962-5.
[13]刘 虹,李 辙,吕晓希,等.中和IL-17A活性改善肺纤维化小鼠肺功能[J].航天医学与医学工程,2013,26(1):38-42.
[13]Liu H,Li Z,Lyu X X,et al.Neutralization of IL-17A to improve lung functions of pulmonary fibrosis in mice[J].Space Med Med Eng,2013,26(1):38-42.
[14]Szapiel S V,Elson N A,Fulmer J D,et al.Bleomycin-induce dinterstitial pulmonary disease in the nude,athymic mouse[J].Am Rev Respir Dis,1979,120(4):893-9.
[15]刘理静,于小华,张 平.白藜芦醇通过TGF-β1/ADAMTS-1信号通路抑制肺纤维化[J].中国药理学通报,2013,29(3):425-31
[15]Liu L J,Yu X H,Zhang P.Resveratrol inhibits pulmonary fibrosis through TGF-β1/ADAMTS-1 signaling pathway[J].Chin Phar-macol Bull,2013,29(3):425-31.
[16]郭 刚,王久存,史 颖,等.参麦开肺散对NIH/3T3成纤维细胞增殖及胶原合成的影响[J].解放军医药杂志,2015,27 (2):24-8.
[16]Guo G,Wang J C,Shi Y,et al.Effect of Shenmaikaifei powder on the proliferation and collagen synthesis of NIH/3T3 fibroblasts [J].Med Pharm J Chin PLA,2015,27(2):24-8.
[17]Lee A S,Mira-Avendano I,Ryu J H,et al.The burden of idio-pathic pulmonary fibrosis:an unmet public health need[J].Re-spir Med,2014,108(7):955-67.
[18]Tan Z,Qian X,Jiang R,et al.IL-17A plays a critical role in the pathogenesis of liver fibrosis through hepatic stellate cell activation [J].J Immunol,2013,191(4):1835-44.
[19]米 粟,李 辙,刘 虹,等.阻断IL-17A活化p50 NF-κB抑制小鼠肺损伤引起的肺纤维化[J].药学学报,2012,47(6):739-44.
[19]Mi S,Li Z,Liu H,et al.Blocking IL-17A protects against lung injury-induced pulmonary fibrosis through promoting the activation of p50 NF-κB[J].Acta Pharm Sin,2012,47(6):739-44.
[20]You H,Wei L,Sun W L,et al.The green tea extract epigallocat-echin-3-gallate inhibits irradiation-induced pulmonary fibrosis in a-dult rats[J].Int J Mol Med,2014,34(1):92-102.
[21]黄成亮,李艳艳,范贤明,等.IL-17A促进博来霉素诱导的肺纤维化大鼠肺组织的炎症形成[J].细胞与分子免疫学杂志,2014,30(4):366-70.
[21]Huang C L,Li Y Y,Fan X M,et al.IL-17A promotes pulmonary inflammation in rats with pulmonary fibrosis induced by bleomycin [J].Chin J Cell Mol Immunol,2014,30(4):366-70.
[22]钱 红,刘理静.IL-17单克隆抗体对病毒性心肌炎小鼠的保护作用[J].细胞与分子免疫学杂志,2014,30(5):509-12.
[22]Qian H,Liu L J.Protective effect and mechanism of IL-17 mono-clonal antibody on mice with viral myocarditis[J].Chin J Cell Mol Immunol,2014,30(5):509-12.
[23]Metelev V G,Kubareva E A,Oretskaya T S,et al.Regulation of activity of transcription factor NF-κB by synthetic oligonucleotides [J].Biochemistry(Mosc),2013,78(8):867-78.
[24]郭江燕,高梓珊,姜姝姝,等.IL-17和NF-κB通路与类风湿性关节炎的相关性研究[J].长春中医药大学学报,2015,31 (1):192-4.
[24]Guo J Y,Gao Z S,Jiang S S,et al.Study progress of IL-17 and NF-kappa B pathway in RA[J].J Changchun Univ Chin Med,2015,31(1):192-4.
[25]Gu C,Wu L,Li X.IL-17 family:cytokines,receptors and signa-ling[J].Cytokine,2013,64(2):477-85.
[26]Guo T,Lok K Y,Yu C,et al.Lung fibrosis:drug screening and disease biomarker identification with a lung slice culture model and subtracted cDNA library[J].Altern Lab Anim,2014,42(4):235 -43.
[27]刘理静,钱 红.上调miR-21表达促进肺成纤维细胞增殖和胶原蛋白合成[J].细胞与分子免疫学杂志,2015,31(7):918-22.
[27]Liu L J,Qian H.Up-regulation of miR-21 promotes cell prolifera-tion and collagen synthesis in pulmonary fibroblasts[J].Chin J Cell Mol Immunol,2015,31(7):918-22.
Protective effect of IL-17 monoclonal antibody on rats with pulmonary fibrosis and its partial mechanisms
LIU Li-jing1,2,QIAN Hong1,YIN Hui-ming2,ZHANG Ping3,WANG Zai-yan3,XIAO Hua3
(1.School of Clinical Medicine,Hunan University of Medicine,Huaihua Hunan 418000,China;2.Dept of Respiration,the First Affiliated Hospital,Hunan University of Medicine,Huaihua Hunan 418000,China;3.Dept of Respiration,the First Affiliated Hospital,University of South China,Hengyang Hunan 421001,China)
Abstract:Aim To explore the protective effects of in-terleukin-17(IL-17)monoclonal antibody(mAb)on bleomycin-induced pulmonary fibrosis rats and the re-lated mechanisms.Methods Seventy-five male SD rats were randomly divided into normal control group,sham operation group,model group,non-specific IgG group and IL-17 mAb group.Each group included fif-teen rats.Rats in the latter three groups were intratra- cheally administered with bleomycin A5 to establish pulmonary fibrosis model,whereas the ones in sham operation group were treated with the same volume of physiological saline.On day 7,14 and 21,rats in non-specific IgG group and IL-17 mAb group were in-jected with non-specific IgG and IL-17 mAb,respec-tively,through the caudal vein.However,the ones in the other groups were administered with the same volume
of physiological saline.All rats were sacrificed on day 28.Pulmonary tissues were then removed,and HE and Masson staining was performed.The contents of IL-17,IL-6 and tumor necrosis factor-α(TNF-α)in pulmo-nary tissues were measured by enzyme linked immu-nosorbent assay(ELISA).Western blot was used to analyze the pulmonary tissues protein expression of nu-clear factor-κB(NF-κB)p65 in the nucleus as well as collagen type I(ColⅠ)and collagen type III(ColⅢ)in the whole cells.The levels of ColⅠand Col Ⅲin the pulmonary tissues were detected by fluores-cence real-time quantitative PCR.Serum was separa-ted,and the concentrations of procollagen type 1carboxyterminal propeptide(PICP)and procollagen type III aminoterminal propeptide(PIIINP)in serum were then measured by ELISA.Results The severity of alveolitis and pulmonary fibrosis was lower in IL-17 mAb group than that in model group and non-specific IgG group(P<0.01).In comparison with normal control group and sham operation group,pulmonary tissues IL-17,IL-6 and TNF-α contents,NF-κB p65 protein expression in the nucleus,ColⅠand ColⅢmRNA and protein levels,and serum PICP and PIIINP concentrations were significantly increased in model group and non-specific IgG group(P<0.01).Follow-ing treatment with IL-17 mAb,the above indicators were significantly decreased as compared to model group and non-specific IgG group(P<0.01).How-ever,there was no significant difference in these indi-cators between non-specific IgG group and model group (P>0.05).Similar results were also seen between sham operation group and normal control group(P>0.05).Conclusion IL-17 mAb protects rats from pulmonary fibrosis by inhibiting inflammatory response via downregulating NF-κB expression and decreasing collagen synthesis in the pulmonary tissues.
Key words:IL-17 monoclonal antibody;pulmonary fi-brosis;inflammatory response;IL-6;TNF-α;NF-κB;ColⅠ;ColⅢ
作者简介:刘理静(1976-),男,硕士,副主任医师,研究方向:肺纤维化的防治,E-mail:wsfyz-000@163.com;张 平(1956-),男,教授,主任医师,硕士生导师,研究方向:肺纤维化的防治,通讯作者,Tel:0734-8281948,E-mail:zp9707@sohu.com
基金项目:湖南省教育厅优秀青年项目(No 14B142);湖南省教育厅重点项目(No 10A107)
收稿日期:2015-07-31,修回日期:2015-08-27
文献标志码:A
文章编号:1001-1978(2015)11-1586-07
doi:10.3969/j.issn.1001-1978.2015.11.021

