蛇床子素通过Wnt/β-catenin信号通路促进转染APP基因的神经干细胞分化为更多神经元且减少神经元凋亡
姚璎珈,孔 亮,教亚男,李少恒,陶震宇,闫宇辉,杨静娴
(辽宁中医药大学药学院药理学教研室,辽宁大连 116600)
蛇床子素通过Wnt/β-catenin信号通路促进转染APP基因的神经干细胞分化为更多神经元且减少神经元凋亡
姚璎珈,孔 亮,教亚男,李少恒,陶震宇,闫宇辉,杨静娴
(辽宁中医药大学药学院药理学教研室,辽宁大连 116600)
中国图书分类号:R284.1;R322.8;R329.25;R341;R394.2;R745.702.6
摘要:目的 通过转染APP基因于神经干细胞,研究蛇床子素对其增殖和分化能力的影响,及对神经元凋亡的影响,并研究其机制。方法 体外建立阿尔茨海默病的神经干细胞模型,利用免疫组化染色法,研究蛇床子素对转染APP基因的神经干细胞增殖和分化能力的影响;通过CCK-8法检测神经干细胞存活率;Hoechst 33258法检测神经元凋亡情况;RT-PCR法检测GSK-3β和β-catenin mRNA的表达变化情况;Western blot法检测GSK-3β和β-catenin蛋白的表达变化情况。结果 与APP组相比,蛇床子素组的神经干细胞增殖能力提高了10.24%;分化为神经元的能力提高了6.74%。与APP组相比,蛇床子素组神经干细胞的存活率明显提高;神经元凋亡明显减少;RT-PCR和Western blot结果显示,蛇床子素可抑制GSK-3β基因和蛋白的表达,促进β-catenin基因和蛋白的表达。结论 蛇床子素可促进转染APP基因的神经干细胞的增殖,可促进其分化为更多的神经元,并减少神经元凋亡,可能与通过激活Wnt/β-catenin信号通路有关系。
关键词:阿尔茨海默病;神经干细胞;增殖;分化;神经元;蛇床子素;Wnt/β-catenin信号通路
网络出版时间:2015-10-16 9:52 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20151016.0952.018.html
阿尔茨海默病(Alzheimer′s disease,AD)是最常见的一种与年龄有关的痴呆病,AD主要的病理特征是β淀粉样蛋白(Aβ)的沉积,神经元纤维的缠结(NFTs)和大量神经元的丢失[1]。AD的病理特征为认知功能退行性病变和记忆、学习能力的下降,且中老年人群中发病率较高[2-3]。神经再生是一个由神经干细胞产生新的神经元的过程[4],保持着神经干细胞的增殖、迁移和分化为神经元功能之间的平衡,很多神经退行性疾病正是因为此功能下降导致的。那么,提高大脑内内源性神经干细胞的存活和增殖能力,补充丢失的神经元,将是一个非常有潜力的治疗途径。我们之前的研究已经证明了蛇床子素(osthole,Ost)对正常状态下的神经干细胞的增殖和分化的影响,可减少Aβ孵育的神经细胞中Aβ蛋白的表达[5],这为后续实验提供了实验依据。可溶性Aβ寡聚体的沉积和神经元的丢失是导致AD认知功能障碍的主要致病因素[6]。现有大量文献证明,与AD发生有关的这些有毒性的Aβ是由Aβ前体样蛋白(APP蛋白)通过β-分泌酶和γ-分泌酶水解而产生的[7]。体内还存在与APP蛋白结构相似的APLP1[8]和APLP2[9]蛋白。大量的文献表明,AD的发生是与Wnt/β-catenin信号通路介导的Aβ产生神经毒性有关[10]。
Wnt/β-catenin信号通路参与了细胞的增殖、分化、神经元凋亡等,且在AD的发生和发展中发挥着重要作用。Wnt信号通路存在两种途径:一种是经典Wnt途径,另一种是非经典Wnt/PCP或者Wnt/Ca2+途径[11]。GSK-3β是一种高度保守的丝氨酸/苏氨酸激酶,也是Wnt/β-catenin信号通路上重要的媒介,它对细胞蛋白的合成、增殖、分化和凋亡等均有影响。Toledo等[12]已经通过体内实验发现,氯化锂作为GSK-3β的抑制剂,激活Wnt信号通路,上调β-catenin表达水平,同时减轻AD模型APPswe/PSEN1ΔE9双转基因小鼠的空间记忆障碍,减少Aβ聚集。Balaraman等[13]发现在AD患者脑内,Wnt/β-catenin通路活性处于抑制状态,导致GSK-3β表现出高活性。β-catenin为该信号通路上一个关键点,它是GSK-3β下游靶点,在AD中明显下降。它的丢失将破坏增殖、生长,引起神经元的死亡[14]。β-catenin代表着经典Wnt/β-catenin信号通路,对神经发生和发展有重要的作用[15]。因此,通过刺激内源性神经干细胞的再生和增殖将是治疗AD的一种有效的治疗途径。
蛇床子素(7-甲氧基-8-异戊烯基香豆素,ost-
hole,Ost)化学式:C15H16O3,分子质量:244.38 u,是一种从多种中药如蛇床子(Angelica pubescens Maxim.f.biserrata Shan et Yuan)中提取的天然香豆素,现如今确定的药理作用包括抗炎、调节免疫作用等[16-17]。我们之前的研究已经证明,Ost能够减轻神经细胞由Aβ产生的神经毒性[4],又可提高以神经干细胞为基础实验性的自身免疫性脑脊髓炎的治疗效率[18]。
在之前的研究中,我们发现Ost对正常状态下的神经干细胞具有促进其增殖和分化的作用,但是,Ost对由APP转染产生Aβ的神经干细胞增殖、分化和迁移能力的报道却少见。因此,我们想通过实验证明Ost可提高转染APP基因的神经干细胞的增殖和存活能力,并促进其分化为神经元,减少神经元凋亡,这将为Ost预防和治疗AD提供新的理论依据。
1 材料与方法
1.1材料
1.1.1试剂 Ost(批号:110822-200305,纯度>98%,244.39分子质量;结构见Fig 1)购自于中国药品检验所(北京,中国);DMEM/F12培养基、胎牛血清(FBS)、双抗(100 kU·L-1青霉素+100 mg·L-1链霉素)(美国Gibco公司);碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、表皮生长因子(epidermal growth factor,EGF)(美国Peptide公司);B27添加剂(B27)(美国Invitrogen公司);DM-SO(美国Sigma公司);LiCl(上海生工生物公司);IWR-1-endo(美国Selleck公司);CCK-8试剂盒(美国Dojindo公司);大鼠抗巢蛋白(Nestin)抗体、兔抗干细胞关键蛋白(SOX2)抗体(美国Millipore公司);Cy3标记驴抗兔IgG抗体(美国Jackson公司);兔抗Ki67抗体、兔抗胶质纤维酸性蛋白(GFAP)抗体、兔抗少突胶质细胞前体蛋白(NG2)抗体、兔抗神经元核(NeuN)抗体(北京博奥森公司);Hoechst 33258试剂(北京碧云天公司);第一链cDNA合成(RevertAidTMFirst Strand cDNA Synthesis Kit)试剂盒和PCR引物扩增(PCR Master Mix Kit)试剂盒(美国Thermo公司);全蛋白提取试剂盒、Braford法检测蛋白浓度试剂盒、蛋白缓冲液上样试剂盒(南京凯基生物科技发展有限公司)。

Fig 1 Chemical structure of osthole
1.1.2动物 自然分娩48 h内的小鼠(SPF级昆明种小鼠),体质量2~3 g,购自大连医科大学实验动物中心,动物许可证编号:SCXK(辽)2008-0002。
1.1.3仪器 倒置荧光生物显微镜(日本尼康公司);超低温冰箱(青岛海尔股份有限公司);CO2培养箱(型号:NU-4750E,美国Nuaire公司);紫外-可见光分光光度计(型号:UV-5600,深圳迈瑞生物医疗电子股份有限公司);酶标仪(型号:MR-96A,深圳迈瑞生物医疗电子股份有限公司);PCR仪(型号:MG96G,杭州朗基科学仪器有限公司);凝胶成像仪(型号:4100,上海天能科技有限公司);水平核酸电泳仪(型号:PowerPac系列,美国Bio-Rad公司)。
1.2方法
1.2.1实验分组 将细胞随机分为7组,每组3个复孔,重复3次。分别为:①GFP组;②APP组;③Ost组;④LiCl组;⑤APP+LiCl组;⑥IWR-1-endo组;⑦IWR-1-endo+Ost组。
1.2.2蛇床子素的配制 Ost溶解于二甲基亚砜(DMSO)中,DMSO浓度最大比例不超过0.1%。用磷酸盐缓冲盐水(PBS)液稀释成浓度为1 nmol· L-1Ost母液,并在-20℃储存备用[19]。本实验中APP组细胞经过DMSO溶剂处理,且DMSO体积与给药组的DMSO体积相等,即APP组为溶剂(DM-SO)对照组。
1.2.3神经干细胞的培养 取新生2 d内乳鼠的脑室下区(SVZ)和海马区(hippocampus)[20],然后将神经干细胞培养在完全培养基内,完全培养基包括1%B 27、20 μg·L-1bFGF、20 μg·L-1EGF和100 kU·L-1的双抗。分离纯化的神经干细胞以1 ×109个·L-1的密度接种于24孔板,放在37℃、5%CO2和95%空气的培养箱内开始培养[21]。在3 d后半量换液,然后细胞开始慢慢地悬浮成长为神经干细胞。
1.2.4APP基因转染 第3代的神经干细胞用于后续实验,我们的实验要通过慢病毒转染1个与AD致病因素有关的APP质粒[22],此方法已经成功用于IL-10转染神经干细胞[23]和CCR5转染骨髓源神经干细胞[24]。先将GFP和APP质粒用试剂脂质体2000来包装293T细胞,在24 h后,荧光显微镜下观察荧光情况。在36、72 h后收集上清病毒液,并将神经干细胞打散为单个细胞,用于转染GFP和APP基因,在转染3 d后,荧光显微镜下观察转染情况。
1.2.5荧光免疫组化染色和Hoechst 33258染色96孔板培养的神经干细胞在4℃,用4%多聚甲醛
固定30 min,然后用PBS液清洗,再用1%Triton室温透化30min[25]。然后选择相应的一抗抗体:小鼠抗巢蛋白、兔抗星形胶质细胞、兔抗少突胶质细胞、小鼠抗神经元和兔抗Ki67,用1%BSA溶解后4℃孵育过夜,次晨用相对应的二抗孵育1 h后,用PBS液清洗3次。细胞核用4′6-二脒基-2-苯基吲哚(DAPI)染色15 min。用免疫荧光显微镜计数每孔免疫荧光阳性细胞。分化24 h后的细胞再用PBS液溶解Hoechst 33258染料,孵育30 min[26],凋亡的细胞会出现细胞核内的颗粒块荧光[27],从而确定凋亡细胞百分比,每孔实验重复3次。
1.2.6CCK-8法检测细胞存活率 神经干细胞的存活率通过CCK-8试剂盒检测[28],打散的单个神经干细胞以每孔5×107个·L-1细胞密度接种于96孔板,每组重复3孔。不同组别在培养箱内孵育48 h后,每孔加入10 μL的CCK-8试剂,再培养4 h。在450 nm波长处,用酶标仪检测吸光度,该吸光度的数值大小与神经干细胞存活的数量密切相关。
1.2.7RT-PCR检测相关基因的表达情况 提取转染了APP和GFP基因神经干细胞的总RNA,根据说明书,加入1 mL TRIzol试剂,然后用第一链cDNA合成试剂盒逆转录成cDNA。我们所用引物纯度几乎接近100%,所用引物序列为:APP-F(5′-GACTGACCACTCGACCAGCAGGTTCTG-3′),APP-R (5′-CTTGTAAGTTGGATTCTCATATCCG-3′);GSK-3β-F(5′-CAACAGCCACCCCAAGAC-3′),GSK-3β-R (5′-GATCCCATCTGGTCATCC-3′);β-catenin-F(5′-CCACTCCAGGAATGAAGG-3′),β-catenin-R(5′-AG-CAGTCTCATTCCAAGC-3′);β-actin-F(5′-GG-GAAATCGTGCGTGACAT-3′),β-actin-R(5′-TCAG-GAGGAGCAATGATCTTG-3′)。使用PCR试剂盒进行35个循环的PCR反应[5]。用Image J图像分析软件对条带进行吸光度扫描,结果用相对光密度表示,相对光密度=光密度目的基因/光密度β-actin。
1.2.8免疫蛋白印迹法检测相关蛋白的表达情况神经干细胞用预冷的PBS液清洗,然后加入蛋白抑制剂,根据总蛋白提取试剂盒的说明书提取总蛋白,然后通过Braford方法检测总蛋白浓度[29]。每孔加入100 μg蛋白,用8%烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)转移到聚偏二氟乙烯膜(PVDF)上[30],用一抗抗体和适合的辣根酶标记过的二抗抗体孵育,PVDF膜用二氨基联苯胺(DAB)染色试剂盒染色。用Image J图像分析软件对条带进行吸光度扫描,结果表示蛋白表达量变化情况。
1.2.9统计学分析 统计数据分析使用的是SPSS 13.0软件,数据以平均数±方差表示,对所得数据进行单因素方差分析和t检验。所有的实验数据都独立重复至少3次。
2 结果
2.1转染神经干细胞中APP和GFP的表达 我们从C57BL/6新生乳鼠的SVZ和海马区分离提取神经干细胞,在大约d 7,神经干细胞增殖为半径更大的神经球。第3代典型的神经球用免疫组化染色法染色,共同表达神经干细胞特异性标志物Nestin(绿色)和Sox2(红色),见Fig 2A。然后用APP和GFP慢病毒转染神经干细胞,质粒结构图如Fig 2B。神经干细胞转染APP基因的转染率大概为85% (Fig 2C),大量表达APP基因和APP蛋白,见Fig 2D和2E。
2.2蛇床子素可促进转染APP基因的神经干细胞增殖 Ost具有明显的促进神经球形成的作用(Fig 3A)。我们将第5代神经干细胞在d 1、4、8、12、15采用机械法将其打散为单个细胞,并在增殖培养基内培养,通过对单个细胞的计数,绘制生长曲线图[19]。Fig 3B生长曲线显示Ost促进转染APP基因的神经干细胞数目的增多。在d 7,用Ki67染色法检测其增殖能力[31],见Fig 3C。结果发现,与正常组相比,APP组Ki67阳性率明显下降了24.80% (P<0.01);给药组Ki67阳性率比APP组明显增强了10.24%(P<0.05),见Fig 3D。
2.3蛇床子素可促进转染APP基因的神经干细胞分化为更多的神经元 为了证明Ost(100 μmol· L-1)对体外转染APP质粒的神经干细胞分化能力的影响,我们将打散后的单个细胞放在分化培养基内培养。大约在12d后,通过免疫组化法检测神经干细胞分化为星形胶质细胞(GFAP+)、神经元(Ne-uN+)和少突胶质细胞(NG2+)的情况[32],见Fig 4A。根据定量分析后可得(Fig 4B),Ost作用后神经干细胞分化为更少的星形胶质细胞(APP组vs Ost组:62.67%±2.05%vs 54.27%±1.79%,P<0.01)和更多的神经元(APP组vs Ost组:19.53% ±2.25%vs 26.27%±3.19%,P<0.05),但是对少突胶质细胞无明显影响(APP组vs Ost组:29.9%± 2.85%vs 28.2%±1.68%)。
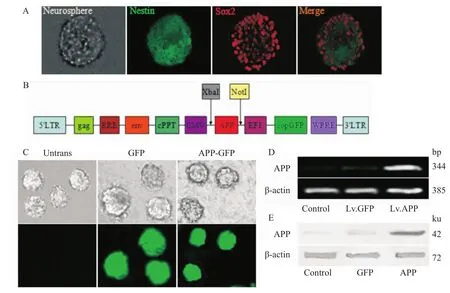
Fig 2 Transduction of NSCs for APP and GFP expression

Fig 3 Osthole promotes APP transduced NSCs proliferation in vitro
2.4蛇床子素通过Wnt/β-catenin通路提高神经干细胞存活率并且减少神经元凋亡 为了验证Ost是否通过Wnt/β-catenin信号通路来提高神经干细胞的存活率,我们在实验中用Wnt通路的抑制剂来阻断通路信号和Wnt通路的激动剂来激活信号。神经干细胞用Ost(100 μmol·L-1)、IWR-1-endo
(Wnt信号通路抑制剂,10 μmol·L-1)和LiCl(20 mmol·L-1)作用后[33],我们采用免疫荧光染色法检测,绘制出凋亡细胞百分比,见Fig 5A和5B,结果显示Ost作用后,降低了神经元的凋亡。然后,再将细胞重新接种后的d 3采用CCK-8试剂孵育4 h,检测细胞存活率。正如Fig 5C所示,LiCl组、Ost组、LiCl+Ost组的细胞存活率与APP组相比有明显升高(85.76%±4.02%、77.30%±3.41%、94.02%± 4.12%vs 69.03%±3.98%,P<0.05,P<0.01),IWR-1-endo组、IWR-1-endo+Ost组的存活率与APP组相比有明显下降(53.03%±3.19%、54.25% ±4.03%vs 69.03%±3.98%,P<0.05),但是IWR-1-endo组和IWR-1-endo+Ost组之间的细胞存活率差异无显著性。

Fig 4 Osthole promotes differentiation into greater number of neurons

Fig 5 Osthole promotes the survival of transfected NSCs and reduces neuronal apoptosis
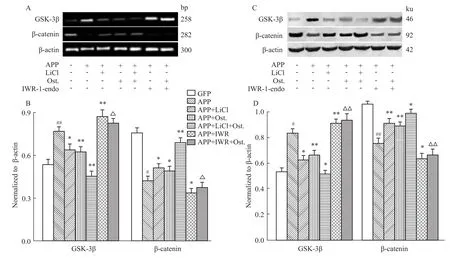
Fig 6 Effects of various treatment on the expression of GSK-3β,β-catenin mRNA and protein
2.5蛇床子素激活Wnt信号通路并抑制GSK-3β活性 Fig 6结果显示,Ost能够降低转染APP质粒的神经干细胞中GSK-3β的mRNA表达,使β-cate-nin的mRNA表达升高。正如这样的情况,LiCl作用后,β-catenin蛋白增多。当用抑制剂IWR-1-endo作用后,GSK-3β mRNA及GSK-3β蛋白表达升高,但是与给药组之间相比无明显变化。
3 讨论
AD是一种神经退行性疾病,在工业大国约有2%的人口会得此病,并且这个数目在50年内会翻两倍[34]。通过查阅文献,我们知道与AD有关的Aβ是由APP蛋白水解产生的,而这些有毒性的Aβ寡聚体沉积与AD病人的认知功能下降有密切关系[35]。Ost是一种天然香豆素类化合物,因为具有不同的药理作用,被认为具有强大的治疗潜能[36]。根据已知的Ost的药理作用,例如抗炎[17]、抗氧化[37]和神经保护作用[38],还有我们之前实验研究发现,Ost可促进正常状态下的神经干细胞的增殖和分化,那么,我们通过成功构建一种模拟AD病理特点的体外AD细胞模型,来研究Ost对转染APP的神经干细胞的增殖和分化能力的影响。
通过实验,我们发现由APP产生的Aβ寡聚体会抑制神经干细胞的增殖和分化。通过Ki67染色法发现,与APP组相比,Ost组的增殖能力明显提高,并分化为更多神经元,但两组比较,分化为少突胶质细胞的能力差异无显著性。
为了探索Ost的作用机制,我们选取了Wnt/β-catenin信号通路上的激动剂和抑制剂。利用NeuN 和Hoechst 33258染色,神经元凋亡数目的结果说明Ost具有抗神经元凋亡的作用。再用CCK-8试剂盒检测神经干细胞的存活率,我们的结果显示,Ost可促进神经干细胞的存活率,但IWR-1-endo组和IWR-1-endo+Ost组之间的细胞存活率差异无显著性。为了进一步了解Ost抗神经元凋亡的分子机制,我们随后利用RT-PCR技术检测了Wnt/β-cate-nin信号通路上的基因。本实验的结果表明,在LiCl 或Ost作用后,GSK-3β的mRNA表达下降,而β-catenin的mRNA表达上升。我们又用Western blot技术检测了GSK-3β、β-catenin蛋白表达,Western blot结果与RT-PCR结果是一致的。以上结果说明
Ost是通过激活Wnt/β-catenin信号通路,抑制GSK-3β活性,并激活β-catenin活性,在体外发挥减少神经元凋亡的作用。
一直以来,AD的发病机制尚未清楚,所以对神经干细胞用于AD潜在治疗的研究已经远远落后于其他神经退行性疾病。为了发现Ost是通过激活Wnt/β-catenin信号通路,促进神经干细胞的增殖和存活能力,提高向神经元的分化能力,并且减少神经元的凋亡,我们使用了Wnt/β-catenin信号通路的激动剂和抑制剂,证明了Ost发挥药理作用是与此通路有关。从所有结果来看,Ost将会是一种非常具有潜能用于治疗AD或者其他神经退行性疾病的药物。
参考文献:
[1] Castellani R J,Lee H G,Zhu X,et al.Alzheimer disease pathol-ogy as a host response[J].J Neuropathol Exp Neurol,2008,67 (6):523-31.
[2] Castellani R J,Rolston R K,Smith M A.Alzheimer disease[J].Dis Mon,2010,56(9):484-546.
[3] 张 喻,肇玉明,王晓良,彭 英.干细胞治疗阿尔茨海默病的研究进展及挑战[J].中国药理学通报,2015,31(7):889-94.
[3] Zhang Y,Zhao Y M,Wang X L,Peng Y.Advance and challen-ges in stem cell therapy for Alzheimer's disease[J].Chin Pharma-col Bull,2015,31(7):889-94.
[4] Zhao C,Deng W,Gage F H.Mechanisms and functional implica-tions of adult neurogenesis[J].Cell,2008,132(4):645-60.
[5] Hu Y,Wen Q,Liang W,et al.Osthole reverses beta-amyloid peptide cytotoxicity on neural cells by enhancing cyclic AMP re-sponse element-binding protein phosphorylation[J].Biol Pharm Bull,2013,36(12):1950-8.
[6] Lee I S,Jung K,Kim I S,Park K I.Amyloid-β oligomers regu-late the properties of human neural stem cells through GSK-3β sig-naling[J].Exp Mol Med,2013,45:e60.
[7] Kayed R,Head E,Thompson J L,et al.Common structure of sol-uble amyloid oligomers implies common mechanism of pathogenesis [J].Science,2003,300(5618):486-9.
[8] Wasco W,Bupp K,Magendantz M,et al.Identification of a mouse brain cDNA that encodes a protein related to the Alzheimer disease-associated amyloid beta protein precursor[J].Proc Natl Acad Sci USA,1992,89(22):10758-62.
[9] Wasco W,Gurubhagavatula S,Paradis M D,et al.Isolation and characterization of APLP2 encoding a homologue of the Alzheimer′s associated amyloid beta protein precursor[J].Nat Genet,1993,5(1):95-100.
[10]Inestrosa N C,Toledo E M.The role of Wnt signaling in neuronal dysfunction in Alzheimer′s Disease[J].Mol Neurodegener,2008,3:9.
[11]Gordon M D,Nusse R.Wnt signaling:multiple pathways,multi-ple receptors,and multiple transcription factors[J].J Biol Chem,2006,281(32):22429-33.
[12]Toledo E M,Inestrosa N C.Activation of Wnt signaling by lithium and rosiglitazone reduced spatial memory impairment and neurode-generationin brains of an APPswe/PSEN1ΔE9 mouse model of Alzheimer′s disease[J].Mol Psychiatry,2010,15(3):272-85,228.
[13]Balaraman Y,Limaye A R,Levey A I,Srinivasan S.Glycogen synthase kinase 3beta and Alzheimer's disease:pathophysiological and therapeutic significance[J].Cell Mol Life Sci,2006,63 (11):1226-35.
[14]Zhang Q G,Wang R,Khan M,et al.Role of Dickkopf-1,an an-tagonist of the Wnt/beta-catenin signaling pathway,in estrogen-in-duced neuroprotection and attenuation of tau phosphorylation[J].J Neurosci,2008,28(34):8430-41.
[15]Lie D C.Wnt signalling regulates adult hippocampal neurogenesis [J].Nature,2005,437(7063):1370-5.
[16]Chen T,Liu W,Chao X,et al.Neuroprotective effect of osthole against oxygen and glucose deprivation in rat cortical neurons:in-volvement of mitogen-activated protein kinase pathway[J].Neuro-science,2011,183:203-11.
[17]Ji H J,Hu J F,Wang Y H,et al.Osthole improves chronic cere-bral hypoperfusion induced cognitive deficits and neuronal damage in hippocampus[J].Eur J Pharmacol,2010,636(1-3):96-101.
[18]Gao Z,Wen Q,Xia Y,et al.Osthole augments therapeutic effi-ciency of neural stem cells-based therapy in experimental autoim-mune encephalomyelitis[J].J Pharmacol Sci,2014,124(1):54 -65.
[19]Zhang N,Kang T,Xia Y,et al.Effects of salvianolic acid B on survival,self-renewal and neuronal differentiation of bone marrow derived neural stem cells[J].Eur J Pharmacol,2012,697(1-3):32-9.
[20]Van Praag H,Schinder A F,Christie B R,et al.Functional neu-rogenesis in the adult hippocampus[J].Nature,2002,415 (6875):1030-4.
[21]成 薇,沈长波,王 莉,等.白藜芦醇预处理对氧糖剥夺/再复氧损伤大鼠皮质神经干细胞增殖的影响[J].中国药理学通报,2015,31(1):113-8.
[21]Cheng W,Shen C B,Wang L,et al.Effect of resveratrol pretreat-ment on proliferation of cortical neural stem cells after oxygenglucose deprivation/reoxygenation injury in rats[J].Chin Phar-macol Bull,2015,31(1):113-8.
[22]Escribano L,Simón A M,Gimeno E,et al.Rosiglitazone rescues memory impairment in Alzheimer′s transgenic mice:mechanisms involving a reduced amyloid and tau pathology[J].Neuropsycho-pharmacology,2010,35(7):1593-604.
[23]Yang J,Jiang Z,Fitzgerald D C,et al.Adult neural stem cells expressing IL-10 confer potent immunomodulation and remyelina-tion in experimental autoimmune encephalitis[J].J Clin Invest,2009,119(12):3678-91.
[24]Yang J,Yan Y,Ma C G,et al.Accelerated and enhanced effect of CCR5-transduced bone marrow neural stem cells on autoimmune encephalomyelitis[J].Acta Neuropathol,2012,124(4):491-503.
[25]Hamamoto R,Furukawa Y,Morita M,et al.SMYD3 encodes a histone methyltransferase involved in the proliferation of cancer cells[J].Nat Cell Biol,2004,6(8):731-40.
[26]Zhang N,Wen Q,Ren L,et al.Neuroprotective effect of arctige-nin via upregulation of P-CREB in mouse primary neurons and hu-man SH-SY5Y neuroblastoma cells[J].Int J Mol Sci,2013,14 (9):18657-69.
[27]Fang M,Wang J,Zhang X,et al.The miR-124 regulates the ex-pression of BACE1/β-secretase correlated with cell death in Alzhe-imer′s disease[J].Toxicol Lett,2012,209(1):94-105.
[28]Yang J,Bridges K,Chen K Y,Liu A Y.Riluzole increases the a-mount for latent HSF1 for an amplified heat shock response and cy-toprotection[J].PLoS One,2008,3(8):e2864.
[29]Trazzi S,Mitrugno V M,Valli E,et al.APP-dependent up-regu-lation of Ptch1 underlies proliferation impairment of neural precur-sors in Down syndrome[J].Hum Mol Genet,2011,20(8):1560 -73.
[30]Itokazu Y,Yu R K.Amyloid β-peptide 1-42 modulates the prolif-eration of mouse neural stem cells:upregulation of fucosyltrans-ferase IX and notch signaling[J].Mol Neurobiol,2014,50(1):186-96.
[31]Schonk D M,Kuijpers H J,van Drunen E,et al.Assignment of the gene(s)involved in the expression of the proliferation-related Ki-67 antigen to human chromosome 10[J].Hum Genet,1989,83(3):297-9.
[32]Yang J,Yan Y,Xia Y,et al.Neurotrophin 3 transduction aug-ments remyelinating and immunomodulatory capacity of neural stem cells[J].Mol Ther,2014,22(2):440-50.
[33]Chen B,Dodge M E,Tang W,et al.Small molecule-mediated dis-ruption of Wnt-dependent signaling in tissue regeneration and cancer[J].Nat Chem Biol,2009,5(2):100-7.
[34]Mattson M P.Pathways towards and away from Alzheimer′s disease [J].Nature,2004,430(7000):631-9.
[35]Kim S U,Lee H J,Kim Y B.Neural stem cell-based treatment for neurodegenerative diseases[J].Neuropathology,2013,33(5):491-504.
[36]Ji H J,Hu J F,Wang Y H,et al.Osthole improves chronic cere-bral hypoperfusion induced cognitive deficits and neuronal damage in hippocampus[J].Eur J Pharmacol,2010,636(1-3):96-101.
[37]Hua K F,Yang S M,Kao T Y,et al.Osthole mitigates progres-sive IgA nephropathy by inhibiting reactive oxygen species genera-tion and NF-κB/NLRP3 pathway[J].PLoS One,2013,8(10):e77794.
[38]Chao X,Zhou J,Chen T,et al.Neuroprotective effect of osthole against acute ischemic stroke on middle cerebral ischemia occlu-sion in rats[J].Brain Res,2010,1363:206-11.
Osthole promotes differentiation into neurons and reduces neuronal apoptosis via Wnt/β-catenin signaling pathway in APP transduced neural stem cells
YAO Ying-jia,KONG Liang,JIAO Ya-nan,LI Shao-heng,TAO Zhen-yu,YAN Yu-hui,YANG Jing-xian
(Dept of Pharmacology,School of Pharmacy,Liaoning University of Traditional Chinese Medicine,Dalian Liaoning 116600,China)
Abstract:Aim To investigate the effects of osthole (Ost)on the ability of proliferation and differentiation in APP transduced neural stem cells(NSCs),and neu-ronal apoptosis,in order to find related mechanism.Methods A model of Alzheimer′s disease(AD)cells was successfully established by transducing APP gene into NSCs in vitro.The ability of proliferation and dif-ferentiation was tested by staining.The viability of NSCs was determined by using CCK-8 assay.The cell apoptosis was tested by Hoechst 33258 staining.The expression of GSK-3β and β-catenin mRNA was deter-mined by RT-PCR.The expression of GSK-3β and β-catenin protein was determined by Western blot.Re-sults The ability of proliferation had increased by 10.24%with Ost treatment,compared with APP group. The ability of differentiation had increased by 6.74% with Ost treatment,compared with APP group.The vi-ability of NSCs had increased and cell apoptotic rate had decreased significantly.From the results of RT-PCR and Western blot,we could find the expression of GSK-3β mRNA and protein had decreased,and the ex-pression of β-catenin mRNA and protein had increased significantly,compared with APP group.Conclusion Ost could enhance the ability of proliferation and dif-ferentiation into more neurons of NSCs transducing APP gene,and reduce neuronal apoptosis.It might be relat-ed with activiting Wnt/β-catenin signaling pathway.
Key words:Alzheimer′s disease;neural stem cells;proliferation;differentiation;neurons;osthole;Wnt/β-catenin signaling pathway
作者简介:姚璎珈(1990-),女,硕士生,研究方向:神经药理学,E-mail:yaoyj23@qq.com;杨静娴(1963-),女,博士,教授,博士生导师,研究方向:神经药理学,通讯作者,Tel:0411-87586009,E-mail:jingx-ianyang@yahoo.com
基金项目:国家自然科学基金资助项目(No 81173580)
收稿日期:2015-06-11,修回日期:2015-07-20
文献标志码:A
文章编号:1001-1978(2015)11-1516-08
doi:10.3969/j.issn.1001-1978.2015.11.009

