有氧运动抑制高血压大鼠肠系膜动脉BKCa通道蛋白亚基表达上调
张 琳,张寒梦,叶 芳,石丽君
●成果报告 Original Articles
有氧运动抑制高血压大鼠肠系膜动脉BKCa通道蛋白亚基表达上调
张 琳,张寒梦,叶 芳,石丽君
目的:探究有氧运动对高血压大鼠(SHR)肠系膜动脉血管平滑肌细胞大电导钙激活钾(BKCa)通道α和β1亚基蛋白表达及血管舒缩性的影响。方法:选用12周龄雄性自发性高血压大鼠(SHR,n=24)以及正常血压对照组(WKY,n=12)。将SHR随机分组,高血压安静对照组(SHR,n=12)和高血压有氧运动组(SHR-EX,n=12),各组大鼠先进行1周适应性训练,之后SHR-EX组进行为期8周的跑台训练。9周后,取各组大鼠的肠系膜动脉(2~3级),进行HE染色,离体微血管张力测定及蛋白免疫印迹分析。结果:(1)SHR组肠系膜动脉的管壁厚度明显高于WKY组(P<0.01),但SHR-EX组肠系膜动脉的管壁厚度明显低于SHR组(P<0.01);(2)Iberiotoxin(10-7M)作为BKCa通道选择性阻断剂可诱发各组血管张力增加,增高幅度为SHR>SHR-EX>WKY,NS11021作为BKCa通道选择性激动剂可使血管张力下降,下降幅度为SHR>SHE-EX>WKY;(3)SHR组BKCa通道的α和β 1亚基表达上调,且以β1亚基上调更为显著,SHR-EX组的两亚基上调减弱,且以β1亚基变化更为显著。结论:高血压诱导大鼠肠系膜动脉BKCa通道功能增强,负反馈调节血管张力增加,但有氧运动可显著抑制高血压伴随的大鼠肠系膜动脉BKCa通道的α和β1亚基表达上调,从而改善血管功能。
有氧运动;肠系膜动脉;BKCa通道;血管张力;蛋白表达
高血压作为心血管疾病死亡的主要原因,一直以来严重威胁人类的健康。大量研究表明,慢性高血压导致血管的紧张性增加,管壁增厚,官腔变窄,血管丧失弹性,使其硬度增加[1]。高血压导致血管平滑肌离子通道的结构和功能发生改变,有氧运动具有降低血压,改变血管弹性,促进血管平滑肌的功能改善的作用,但其机制尚不明确。
BKCa通道的分子结构由4个α和4个β亚单位组成,BKCa通道的四聚体结构是由一个α亚单位结合一个β亚单位之后形成的[2]。BKCa通道参与细胞功能调节,如激素的分泌、平滑肌的紧张等[3]。目前已经证实,BKCa通道的功能失调或量的改变会引起心率不齐、心肌肥大、动脉粥样硬化和高血压等多种心血管疾病,高血压可诱导BKCa通道结构和功能发生变化,如蛋白表达量增加[4-7]。有关有氧运动能够降低血压,调节血管张力,是否是通过控制甚至逆转高血压诱导的BKCa通道结构或功能的改变来缓解高血压还未曾涉及。本实验旨在探究有氧运动对高血压诱导的BKCa通道结构和功能的影响。
1 材料与方法
1.1 实验动物与分组
12周龄雄性SHR大鼠24只,WKY大鼠12只,大鼠均由北京维通利华实验动物中心提供,许可证号为SCXK(京)2013-0001。将24只SHR随机分成2组,高血压有氧运动组(SHR-EX,n=12)和高血压安静对照组(SHR,n=12),并与WKY安静对照组(WKY,n=12)进行对比。大鼠4只一笼,全部大鼠均用国家标准啮齿类动物常规饲料进行喂养。大鼠先进行一周的适应性跑台训练,随后SHR-EX组再进行为期8周的正式跑台运动,以最大摄氧量的55%~65%进行训练,20 m/min,60 min/d,5 d/周[8]。
1.2 主要药物及溶液制备
Anti-KCa1.1(BKCa)和Anti-sloβ1(KCNMB1)购自Alomone Labs(以色列),β-Actin(R-22):sc-130657购自SantaCruz(美国),二抗使用辣根过氧化物酶标记山羊抗兔IgG购自Proteintech Group(美国),NE(Norepinephrine)、Iberiotoxin(IbTX)、Hepes、EDTA均购自Sigma(美国),NaCl、KCl、MgCl2、Glucose、NaHCO3等购自北京化学试剂公司。Krebs液成分(mM):131.5 NaCl,5 KCl,1.2 NaH2PO4,1.2 MgCl2,2.5 CaCl2,11.2 glucose,13.5 NaHCO3,0.025 EDTA,持续充氧(95%O2~5%CO2),pH=7.4。4%多聚甲醛磷酸缓冲液:称取40 g多聚甲醛混匀于500 ml 0.1M PBS后加热至60℃,搅拌并滴加1 mol/L NaOH至溶液清晰为止,冷却后用0.1 mol/L PBS定容至1 000 ml。苏木素作为碱性染液对细胞核着色,伊红作为酸性染液对细胞质进行着色(染液均购自北京中杉生物技术有限公司)。电泳缓冲液:Tris碱3.03 g,甘氨酸14.41 g,SDS 1 g,双蒸水溶解后定容至1 L,4℃保存。转膜缓冲液:Tris碱3.03 g,甘氨酸14.41 g,无水甲醇200 ml,双蒸水定容至1 L,4℃保存。
1.3 大鼠基础指标的测定
各组大鼠体重、心率、基础血压在实验前与实验后各测试1次,其中心率及尾动脉无创血压测试采用全自动大小鼠无创血压测量系统(BP-300A,由成都泰盟科技有限公司提供)。
1.4 肠系膜2、3级动脉横切面的形态学分析
选取各组6只大鼠的肠系膜动脉进行HE染色和血管环张力测定,取大鼠的肠系膜动脉于Na+HEPES中去除周围脂肪,剪下部分2、3级分支(血管外径在100~300 μm之间)血管环备用,剩余迅速将其放入4%的多聚甲醛中,4℃固定12 h,然后用流水冲洗12 h。使用70%酒精Ⅰ20 min—70%酒精Ⅱ20 min—80%酒精20 min—95%酒精Ⅰ20 min—95%酒精Ⅱ20 min—100%酒精Ⅰ20 min—100%酒精Ⅱ20 min进行梯度酒精脱水后,经二甲苯Ⅰ(100%)和二甲苯Ⅱ(100%)进行透明。浸蜡后的组织进行包埋。组织进行冠状切片,切片厚度为4 μm,切片放入水浴锅展片后贴附在处理后的载玻片(载玻片提前编号)。将切片放在60℃烤箱烤2 h,取出恢复到室温,脱蜡及水化后,先用苏木素染细胞核3~5 min,用盐酸酒精分化几秒,抽插数下,直至无蓝色液体流下,再用伊红染细胞质。最后用中性树脂封片。
1.5 离体血管环制备及其张力的测定
各组选取6只大鼠的肠系膜动脉2、3级分支进行离体的血管环张力测定。腹腔麻醉大鼠成功后,打开腹腔取其肠系膜动脉,并迅速放于4℃Krebs液中,剥离血管壁周围脂肪,并将血管中的残留血液挤出。剪下2、3级的分支,再将其制成2 mm血管环,进行血管张力测定。先用0.12 mol/L KCl刺激血管收缩,以其净收缩幅度作为100%最大收缩,之后分别再给予去甲肾上腺素(NE,10-9~10-5mol/L)、IbTX(10-7mol/L)和NS11021刺激血管环,观察各组血管张力及反应性的变化。
1.6 蛋白免疫印迹分析
每组剩余6只进行肠系膜动脉的BKCa通道α和β1亚基蛋白免疫印迹分析。麻醉成功后,取其肠系膜动脉,除去脂肪后,立刻投入液氮中暂存,之后转入-80℃超低温冰箱中保存。称取研磨后的100 mg组织,迅速加入500 μl RIPA裂解液,用匀浆器在冰水浴中匀浆10次,每次匀4~5 s,间隔4~5 s。将匀浆液置于4℃,在摇床上结合1 h,随后以13 000 r/min的转速离心30 min,轻轻拿出后取上清液待测,借助BCA试剂盒配置出标准液并与上清的蛋白浓度进行比对,从而确定提取的蛋白浓度。随后,用一定比例的样品缓冲液及生理盐水对提取的上清液进行稀释。制备电泳缓冲液,聚丙烯酰胺凝胶(上样量每孔保持40~50 μg,根据蛋白浓度自行调整上样量),转膜(BKCa α-亚基300 mA恒流1.5 h,BKCa β1亚基250 mA恒流50 min)、5%BSA封闭2 h。加一抗,用BSA稀释一抗(Anti-KCa1.1(BKCa),1:200;Anti-sloβ1(KCNMB1),1:200;β-Actin(R-22):sc-130657,1:200),置于4℃冰箱过夜。第2天复温1 h,后用TBST洗3×10 min,二抗使用TBST稀释的辣根过氧化物酶标记的山羊抗兔IgG(1:8 000)孵育1 h。蛋白免疫印迹分析用image lab进行操作,框出各个条带,进行灰度值的分析。
1.7 统计学分析
应用Image J对肠系膜2、3级动脉血管石蜡切片HE染色图片进行分析,Image Lab对蛋白免疫印迹条带进行分析,SPSS17.0对3部分实验数据进行平均数、标准误、显著性差异的分析,使用GraphPad Prism 5作柱状统计图。用均数±标准误(M±SD)表示实验结果,其中WKY组和SHR组、SHR-EX组和SHR组间比较采用单因素方差分析,P<0.05有显著性差异,P<0.01有非常显著性差异。
2 结 果
2.1 有氧运动对大鼠基础指标的影响
12周龄时,WKY和SHR大鼠体重差异无统计学意义;21周龄时,3组体重均显著性升高(P<0.01)。与12周龄时相比,21周龄时SHR组收缩压、舒张压和脉压均显著性升高(P<0.01),而SHR-EX组收缩压却显著性降低(P<0.05)(见表1)。
经过9周后,SHR组的心重、心重/体重比、收缩压、舒张压、脉压均显著性高于WKY组(P<0.01),同时心率也显著性升高(P<0.05);SHR-EX组的收缩压显著低于SHR组(P<0.01),舒张压、脉压和心率也显著性降低(P<0.05)(见表1)。

表1 有氧运动对大鼠体重、心脏重量、心重/体重、基础血压及心率的影响Table1 Effects of aerobic exercise on the rat body weight,heart weight,heart weight/body weight,basal blood pressure and heart rate
2.2 有氧运动对SHR肠系膜动脉管壁厚度的影响
取大鼠肠系膜动脉的2、3级分支的横切面进行对比,经过8周的有氧运动后,SHR组的外径与WKY组相比无显著性差异,SHR-EX组的外径与SHR组相比无显著性差异。内径指标中,与WKY组相比,SHR组呈显著性低水平(P<0.01),而与SHR组相比,SHR-EX组呈显著性高水平(P<0.01);动脉管壁厚度指标中,SHR组高于WKY组(P<0.01),但SHR-EX组显著低于SHR组(P<0.01);内径/动脉管壁厚度指标中,SHR组低于WKY组(P<0.01),而SHR-EX组显著高于SHR组(P<0.01)(见表2、图1~图2)。表明,高血压可使肠系膜动脉血管的管壁变厚、官腔变窄,但有氧运动可以逆转这种改变。

表2 大鼠肠系膜动脉2、3级分支的形态学分析Table2 Morphology analysis of MAs in each group
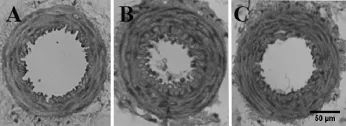
图1 大鼠肠系膜动脉2、3级分支横切面的HE染色图Figure1 Mesenteric artery cross-sections(HE staining)
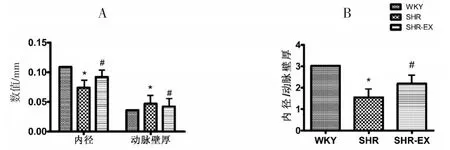
图2 大鼠肠系膜动脉2、3级分支HE染色统计图Figure2 The statistical of HE in MAs
2.3 有氧运动对SHR肠系膜动脉血管收缩性的影响
2.3.1 高钾诱发的肠系膜动脉收缩反应 KCl(0.12 mol/L)可诱发各组肠系膜动脉收缩,SHR、SHR-EX和WKY组大鼠的最大收缩张力(Kmax)分别为(15.1±1.8)×10-3N、(14.6±1.6)×10-3N和(14.4±1.5)×10-3N。由数据可知,3组之间无差别(P>0.05)(见表3)。
2.3.2 有氧运动对NE诱发的肠系膜动脉收缩反应的影响 去甲肾上腺素(NE)作为一种肾上腺素受体激动药物,具有收缩血管、升高血压的作用。本实验采用10-9~10-5mol/L浓度梯度的NE诱发肠系膜动脉收缩。与SHR组相比,NE对SHR-EX组肠系膜的最大收缩具有显著下降的趋势。实验中,为了防止内皮功能的干预,单纯地对血管平滑肌的功能进行检测,使用内皮型一氧化氮合酶(eNOS)的抑制剂L-NAME(100 μM)对肠系膜动脉孵育20 min后再加NE进行刺激,观察血管的收缩情况。NE诱发的3组肠系膜动脉最大收缩力分别为WKY(105.8± 7.2%Kmax)、SHR(128.5±8.0%Kmax)、SHR-EX(112.6±7.8%Kmax)。从实验数据中可以看出,高血压使动脉NE诱导血管收缩作用增强,但有氧运动使高血压大鼠的肠系膜动脉对NE的敏感性下降(见表3)。

表3 有氧运动对SHR大鼠肠系膜动脉血管收缩性的影响Table3 Effects of aerobic exercise on the vascular contractility in MAs from SHR
2.3.3 有氧运动对IBTX诱发的离体肠系膜动脉收缩反应的影响 IbTX(10-7mol/L)作为BKCa通道的特异性阻断剂,可诱发大鼠肠系膜动脉收缩反应。在WKY、SHR、SHR-EX 3组中,IbTX诱导的血管收缩反应增加,SHR组比WKY呈显著性增加(P<0.01),但SHR-EX组与SHR组相比则明显减少(P<0.01)(见表3、图3)。

图3 有氧运动对IbTX诱发的离体肠系膜动脉收缩反应的影响Figure3 Effects of aerobic exercise on IbTX-induced vascular tension in MAs from SHR
2.3.4 有氧运动对NS11021诱发的离体肠系膜动脉舒张反应的影响 BKCa通道的特异性激动剂NS11021诱发大鼠肠系膜动脉舒张。NS11021(10-5mol/L)降低血管张力的程度为SHR>SHR-EX>WKY。与WKY相比,SHR组中NS11021(10-5mol/L)诱导的血管舒张程度更为显著(P<0.05),而与SHR组相比,SHR-EX组中NS11021诱导的血管舒张程度则呈显著性低水平(P<0.05),但仍高于WKY组(见表3、图4)。由数据可知,高血压使BKCa的贡献率增加,而有氧运动缓解了高血压BKCa的贡献率上调。
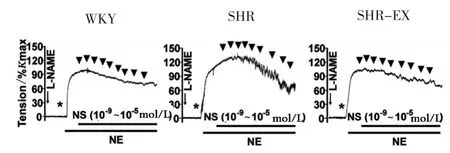
图4 有氧运动对NS11021诱发的离体肠系膜动脉舒张反应的影响Figure4 Effects of aerobic exercise on NS11021-induced vascular tension in MAs from SHR
2.4 有氧运动对SHR肠系膜动脉BKCa通道α和β1亚基表达量的影响
4 个α亚单位和4个β亚单位组成BKCa通道的分子结构。用α、β1的特异性抗体检测α(125kDa)、β1(28 kDa)蛋白的表达量。与WKY组相比,SHR组的α和β1亚基表达均上调,β1亚基的升高更为显著(P<0.05);与SHR相比,SHR-EX组α和β1亚基表达均下调,β1亚基的下调更为显著(P<0.05)(见表4、图5)。表明,高血压伴随着肠系膜动脉BKCa通道α和β1亚基的蛋白表达量增加,但有氧运动可抑制这种改变,使α和β1亚基的蛋白表达量下降。
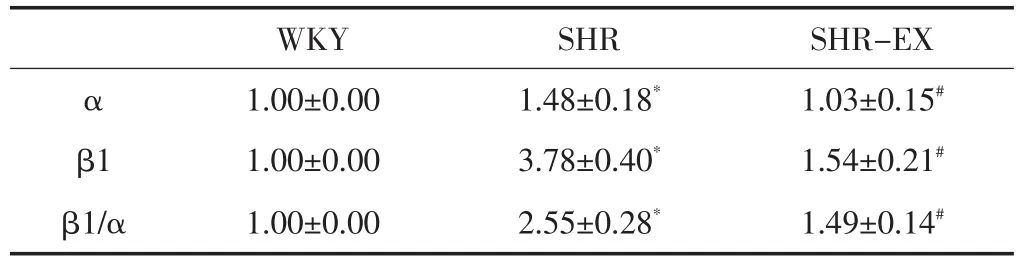
表4 有氧运动逆转SHR肠系膜动脉BKCa通道α和β1亚基表达量上调Table4 Aerobic exercise reversed the up-regulation of protein expression of α-and β1-subunit of BKCachannel in mesenteric arterial myocytes

图5 有氧运动抑制SHR肠系膜动脉BKCa通道α和β1亚基表达量上调Figure5 Aerobic exercise reversed the up-regulation of protein expression of α-and β1-subunit of BKCachannel in mesenteric arterial myocytes
3 分析与讨论
高血压的基本病理生理机制是阻力动脉的血管张力持续增加,而血管张力的调节主要取决于VSMCs离子通道尤其是K+通道的活动[9]。VSMC各离子通道的正常调节作用是血管平滑肌兴奋收缩过程的关键,K+通道是作为调节VSMC膜电位的重要离子通道,具有稳定膜电位的作用。激活K+通道可以诱发K+外流,导致细胞膜超极化,从而抑制电压门控Ca2+通道,使血管平滑肌舒张[10]。研究表明,高血压的发病过程中,各类K+通道的结构和功能都发生了变化,其中BKCa这一通道对血管张力的调节起着重要负反馈调节作用。之前的研究显示,8周有氧运动可使大鼠胸主动脉平滑肌细胞BKCa通道活性增强。本实验以3月龄的雄性SHR与WKY作为研究对象,并对SHR实施为期8周的有氧运动干预。本实验首次报导了长期规律性有氧运动对高血压大鼠肠系膜动脉血管平滑肌细胞BKCa离子通道的有利调节作用。有氧运动除了可以降低血压,同时还可以抑制高血压诱导的BKCa离子通道的重构。
有氧运动作为不涉及药物的单纯性物理疗法被大家广泛接受。大量研究证明,有氧运动会使心脏结构和功能发生一系列有利的适应性改变,使迷走张力增加出现窦性心动徐缓[11]。运动前,SHR组的收缩压、脉压都明显高于WKY组。8周正式运动后,SHE-EX组的体重、收缩压、脉压和心率都明显低于SHR组,表明有氧运动可以起到有效减轻体重,降低血压的作用。
本实验中,对在有氧运动干预下的肠系膜动脉血管形态学也进行了研究。正常情况下,动脉血管管壁光滑,富有弹性,血流速度通畅。但当高血压发生后,血管的结构和功能会发生一系列恶性变化,如管壁硬度增加、弹性下降,严重时管壁增厚,使得管腔变窄,甚至内膜出现钙化和脂类物质沉积,堵塞血管。研究表明,增龄伴随的血管结构和功能的退行性改变可以通过长期规律性的有氧运动得到改善,同时有氧运动也可使动脉管壁增厚的速率减慢,延缓动脉管壁结构的衰老[12]。本实验中的形态学观察可知,高血压导致肠系膜动脉的血管壁增厚、官腔变窄,但有氧运动可以抑制这种管腔变化的发生。长期规律性的有氧运动可以抑制肠系膜动脉管壁的增厚、管腔变窄,维持管壁应有的弹性结构。
有氧运动可使内皮型一氧化氮合酶(eNOS)表达增多,刺激内皮细胞,从而使NO生成增多,进而使血管舒张功能增强[13],有氧运动可以提高肠系膜动脉eNOS的生物利用率[14]。为了排除内皮功能的干扰,研究有氧运动对血管平滑肌的影响,首先用L-NAME(eNOS的阻断剂)进行处理,再对血管张力进行测定。实验选取3组大鼠的肠系膜2、3级动脉血管,NE通过与血管平滑肌上的α肾上腺素能受体结合,使血管收缩,从而产生生物学效应,并且NE所诱发的肠系膜动脉收缩反应是呈浓度依赖性的。随年龄的增加,大鼠肠系膜动脉对NE的敏感性和最大收缩反应都显著降低[15]。和正常鼠相比,高血压使得NE诱导的血管收缩程度显著增加,但有氧运动后使得NE诱导的血管收缩幅度下降,这表明高血压导致血管平滑肌功能下降,弹性收缩减弱,但坚持长期规律的有氧运动能够改善血管平滑肌功能,恢复血管弹性。
目前为止,已发现4种不同类型的钾通道存在于血管平滑肌细胞上,在VSMC上表达密度最高的离子通道是大电导钙激活钾通道(BKCa),它的生理作用是控制细胞膜电位,负反馈调节膜的去极化水平。当BKCa离子通道被激活,K+就会外流,从而引起细胞膜超极化,电压依赖性钾通道就会受到抑制,内流的Ca2+将会减少,使得细胞内Ca2+浓度降低,导致平滑肌舒张[16]。R.QUINLANT等[17]研究表明,高血压使VSMCs的BKCa通道功能增强的机制可能是当血压升高时,BKCa通道负反馈地抑制血管张力增加,从而阻止血压升高,对机体起到保护作用。本实验中,选用BKCa的特异性阻断剂IbTX来观察有氧运动对BKCa通道调节血管张力作用的影响。实验数据可知,BKCa通道特异性阻断剂IbTX(10-7M)可诱发各组肠系膜动脉张力增加的幅度为SHR>SHR-EX>WKY。同时,选用BKCa通道的激动剂NS11021,其可诱发各组肠系膜动脉张力下降的幅度为SHR>SHR-EX>WKY。S.J.CHEN[18]研究显示,有氧运动不仅能提高肠系膜动脉NO的利用率,同时还可以提高BKCa通道的活性,使其起到舒张血管的作用。本实验数据表明,高血压使BKCa通道在维持血管基础张力中的贡献率显著增加,但长期有规律的有氧运动能抑制此变化,缓解高血压BKCa的贡献率上调。这可能是有氧运动调节血管张力,有效缓解高血压的重要生理机制。
一个完整的BKCa通道是由4个构成通道结构对称排列的α亚基(编码基因KCNMA1)和4个具有调控功能的β亚基(编码基因KCNMB1-4)组成[2]。其中,BKCa通道的四聚体孔道结构正是由每个α亚基和每个β亚基结合后形成的。目前为止,α亚基只发现了一种,但它有不同的剪接变异体,是BKCa通道的小分子组分,约由1 200个氨基酸残基组成,分子量约为125 kDa。虽然β亚基存在4种不同的亚型,但VSMCs中只有β1亚型,β1由191个氨基酸残基组成,分子量为28 kDa。C.M.NIMIGEAN等[19]研究发现,增强BKCa通道对Ca2+的敏感性、减慢BKCa通道的激活动力学基础是β1亚基与α亚基的共表达。有研究表明,衰老通过显著降低β1亚基功能(即α亚基和β1亚基非1:1下降)使BKCa通道的电压敏感性和钙敏感性下降,平均开放概率降低[16]。本实验中,猜想高血压同样导致α亚基和β1亚基的上调,且以β1亚基的上调为主,但有氧运动可抑制这种上调趋势。
本实验采用蛋白免疫印迹分析法,观察正常大鼠和高血压大鼠肠系膜动脉BKCa通道α亚基和β1亚基蛋白表达量,以及对高血压大鼠进行有氧运动干预后,检测BKCa通道α亚基和β1亚基蛋白表达量的变化。由本实验数据可知,高血压大鼠的BKCa通道α亚基和β1亚基蛋白表达量都要高于正常大鼠,且β1亚基蛋白表达量上调更为显著。SHR-EX组和SHR组相比,BKCa通道α亚基和β1亚基蛋白表达量均明显下调,其中以β1的下调更为显著。由此可知,高血压使BKCa通道α亚基和β1亚基蛋白表达量上调,且以β1亚基蛋白表达量上调为主,有氧运动可使BKCa通道α亚基和β1亚基蛋白表达量下调,且以β1亚基蛋白表达量下调为主。实验结果表明,高血压导致BKCa通道的代偿作用增加,这可能是一种病理性的变化,而有氧运动可以减缓BKCa通道作用的代偿性增加,从而起到降低血压的效果。这也为有氧运动可调节高血压诱导的BKCa通道重构,从而起到降血压的作用提供分子依据。
本研究从整体水平、组织水平和分子水平对高血压大鼠、高血压运动大鼠以及正常血压大鼠的肠系膜动脉的BKCa结构和功能进行研究。研究发现,高血压导致BKCa通道在维持血管基础张力中的贡献率显著增加,这可能是病理性代偿的结果,但BKCa通道功能的代偿性增加可通过有氧运动得以缓解。在细胞分子水平上观察,BKCa通道的结构蛋白α亚基和β1亚基蛋白表达量在高血压病的诱导下呈上调趋势,且以β1上调更为显著,但有氧运动能抑制高血压诱导的BKCa通道结构的改变,其中以β1的下调为主。这也为运动可降低血压,重新恢复肠系膜动脉的功能提供理论依据,这也进一步证实对于高血压的病理性治疗,有氧运动可以作为一种有效的非药物治疗手段。
4 结论
长期规律的有氧运动可以降低血压的一个重要机制为抑制高血压诱导的BKCa通道病理性代偿作用的增加,从而引起BKCa通道的结构和功能发生重构。
[1]MARUYAMA Y.Aging and arterial-cardiac interactions in the elderly[J].Int J Cardiol,2012,155:14-19.
[2]GHATTA S,NIMMAGADDA D,XU X,et al.Large-conductance,calcium-activated potassium channels:structural and functional implications [J].Pharmacology&therapeutics,2006,110(1):103-116.
[3]马彬云,汲娟娟.BKCa通道的结构与功能[J].ACTA BIOPHYSICA SINICA,2007,23(1):11-19.
[4]ENGLAND S K,WOOLDRIDGE T A,STEKIEL W J,et al.Enhanced single-channel K+current in arterial membranes from genetically hypertensive rats[J].American Journal of Physiology-Heart and Circulatory Physiology,1993,264(5):H1337-H1345.
[5]LIU Y,JONES A W,STUREK M.Ca(2+)-dependent K+current in arterial smooth muscle cells from aldosterone-salt hypertensive rats[J].American Journal of Physiology-Heart and Circulatory Physiology,1995,269(4):H1246-H1257.
[6]LIU Y,PLEYTE K,KNAUS H G,et al.Increased expression of Ca2+-sensitive K+channels in aorta of hypertensive rats[J].Hypertension,1997,30(6):1403-1409.
[7]MARTENS J R,GELBAND C H.Alterations in rat interlobar artery membrane potential and K+channels in genetic and nongenetic hypertension[J].Circulation research,1996,79(2):295-301.
[8]AGARWAL D,WELSCH M A,KELLER J N,et al.Chronic exercise modulates RAS components and improves balance between pro-and anti-inflammatory cytokines in the brain of SHR[J].Basic research in cardiology,2011,106(6):1069-1085.
[9]薛志敏.有氧运动对增龄大鼠动脉平滑肌BKCa通道表达的影响[D].北京:北京体育大学,2013.
[10]DAVIS M J,HILL M A.Signaling mechanisms underlying the vascular myogenic response[J].Physiological Reviews,1999,79(2):387-423.
[11]石丽君,曾凡星,朱一力,等.有氧运动诱导大鼠胸主动脉平滑肌细胞大电导钙激活钾通道活性增加[J].体育科学,2012,32(2):64-68.
[12]王松涛,曾云贵,王安利.有氧运动对大鼠心血管自主神经调节功能的影响[J].体育学刊,2007,14(3):41-45.
[13]GREEN D J,SPENCE A,HALLIWILL J R,et al.Exercise and vascular adaptation in asymptomatic humans[J].Experimental physiology, 2011,96(2):57-70.
[14]ROQUE F R,BRIONES A M,GARC I A-REDONDO A B,et al.Aerobic exercise reduces oxidative stress and improves vascular changes of small mesenteric and coronary arteries in hypertension[J].British journal of pharmacology,2013,168(3):686-703.
[15]张严焱,张寒梦,石丽君,等.增龄通过下调平滑肌细胞BKCa通道α和β1亚基表达改变肠系膜动脉舒缩性[J].中国动脉硬化杂志,2014,22(8):757-762.
[16]KURIYAMA H,KITAMURA K,NABATA H.Pharmacological and physiological significance of ion channels and factors that modulate them in vascular tissues[J].Pharmacological Reviews,1995,47(3):387-573.
[17]QUINLANT R,LI D,LAUBACH V E,et al.eNOS-deficient mice show reduced pulmonary vascular proliferation and remodeling to chronic hypoxia[J].American Journal of Physiology-Lung Cellular and Molecular Physiology,2000,279(4):L641-L650.
[18]CHEN S J,WU C C,YEN M H.Exercise training activates large-conductance calcium-activated K+channels and enhances nitric oxide production in rat mesenteric artery and thoracic aorta[J].Journal of biomedical science,2001,8(3):248-255.
[19]NIMIGEAN C M,MAGLBEY K L.The β subunit increases the Ca2+sensitivity of large conductance Ca2+-activated potassium channels by retaining the gating in the bursting states[J].The Journal of general physiology,1999,113(3):425-440.
Aerobic Exercise Inhibits Protein Expression Level of BKCa Channel in Mesenteric Arteries from Spontaneous⁃lyHypertensiveRats
ZHANG Lin,ZHANG Hanmeng,YE Fang,SHI Lijun
(Sport Science College,Beijing Sport University,Beijing 100084,China)
Objective:The present study was designed to investigate the effects of chronic exercise on the molecular expression of α-and β1-subunit of large-conductance Ca2+-activated K+(BKCa)channels and vascular contractility in rat mesenteric arterial smooth muscle cells from spontaneously hyperten⁃sive rats.Methods:Three-month-old male normotensive Wistar-Kyoto rats(WKY,n=12)and SHRs(n=24)were used.SHRs(n=24)were separated into a sedentary group(SHR)and an exercise group(SHR-EX)at random(n=12 in each group).After a 1-week acclimation period,rats in SHR-EX were sub⁃jected to aerobic exercise on a motor-driven treadmill.After 8 weeks,HE staining was used to analyze the vascular morphology change.Mesenteric arterial tensions were measured in vitro.Immunohistochemistry and Western blots assay were also conducted.Results:1)Compared with WKY,the systolic blood pressure and pulse pressure were significantly increased with hypertension(P<0.01).However,they significantly dropped in SHR-EX compared with its sed⁃entary group(P<0.01).2)The wall thickness of mesenteric artery in hypertension group was obviously increased,but it effectively decreased in SHR-EX compared with SHR.Selective BKCa channel blocker(Iberiotoxin10-7M)induced a marked increase of vascular tension in MAs in all three groups.Howev⁃er,these effects were greatly increased in SHR group.3)Selective BKCa channel activator(NS11021)induced concentration-dependent vasorelaxation in MAs precontracted with norepinephrine.However,these effects were greatly decreased in SHR group.4)Western blotting showed that the protein expression of BKCa α-and β1-subunit was significantly increased with hypertension,and the increase of β1 subunits was larger than that of α subunits,whereas aero⁃bic exercise could effectively ameliorate the changes.Conclusions:Hypertension is associated with an increase of BKCa channel protein expression,which is a negative feedback to regulate vascular contractility,whereas aerobic exercise can significantly weaken this hypertension-associated pathological up-regula⁃tion of BKCa channels to improve the vascular function.
aerobic exercise;mesenteric arteries;BKCa channels;vascular contractility;molecular expression
G 804.5
:A
:1005-0000(2015)01-042-05
10.13297/j.cnki.issn1005-0000.2015.01.008
2014-10-02;
2014-12-21;录用日期:2014-12-23
国家自然科学基金项目(项目编号:31371201);北京市自然科学基金项目(项目编号:5132017);新世纪优秀人才支持计划项目(项目编号:NCET-11-0850)
张 琳(1991年-),女,山东聊城人,在读硕士研究生,研究方向为运动与心血管生理学。
北京体育大学运动生理教研室,北京100084。

