表达硫氧还蛋白1的幽门螺杆菌对人胃上皮细胞株GES-1生长的影响
表达硫氧还蛋白1的幽门螺杆菌对人胃上皮细胞株GES-1生长的影响
刘琳娜1丁士刚2#石岩岩2贾淑娟1
北京大学首钢医院消化科1(100041)北京大学第三医院消化科2

*本课题由国家自然科学基金(30770980)资助
背景:幽门螺杆菌(Hp)感染在胃癌的发生过程中发挥重要作用,细菌毒力因子是导致不同胃疾病的重要因素。目的:研究高、低表达硫氧还蛋白1(Trx1)的Hp对人胃上皮细胞株GES-1生长的作用。方法:按1∶50、1∶100、1∶200的细胞/细菌比例分别加入GES-1细胞和高、低表达Trx1的Hp菌株共培养,并设不加菌株的空白细胞作为对照组,分别于培养24 h和48 h时采用倒置相差显微镜观察细胞形态变化,MTT法检测细胞存活率。收集1∶100浓度组和对照组GES-1细胞,采用流式细胞术检测细胞周期。结果:高、低表达Trx1的Hp对GES-1细胞有损伤作用,细胞存活率降低,且呈时间和浓度依赖性,在Trx1高表达组中尤为明显。流式细胞术显示Trx1高表达组GES-1细胞进入S期的比例在24 h和48 h均明显高于Trx1低表达组。结论:高、低表达Trx1的Hp对GES-1细胞生长具有抑制作用,高表达Trx1的Hp具有更强的致病性,与致胃癌作用有关。
关键词幽门螺杆菌;硫氧还蛋白质类;GES-1;细胞增殖;细胞周期
幽门螺杆菌(Helicobacterpylori, Hp)感染是人类最常见的慢性细菌感染之一,感染后临床结局的不同可能与细菌毒力因子和宿主感染后的反应不同有关[1]。最新研究显示,高致病性Hp菌株的菌体成分和毒力因子与低致病性菌株明显不同,这些成分和毒力因子与胃癌的发生密切相关[2-3]。
硫氧还蛋白(thioredoxin, Trx)于1964年首先由Laurent等[4]在大肠杆菌中分离,Windle等[5]首先分析了Hp的Trx,Trx系统是Hp惟一的抗氧化系统,含有两个亚型,即Trx1和Trx2。Trx1可作为AhpC的电子供体发挥作用,而Trx2则无此作用[6]。张静等[7]发现Trx在胃癌相关菌株中呈高表达,推测其可能在胃癌的发生、发展过程中发挥重要作用。石岩岩等[8]采用实时定量荧光PCR法检测不同胃疾病Hp的Trx1 mRNA表达量,结果显示Trx1高表达的Hp与胃癌密切相关,可作为致胃癌的毒力因子发挥作用。本研究旨在探讨高、低表达Trx1的 Hp对GES-1细胞生长的影响。
材料与方法
一、材料
1. Hp菌株:本研究所用高、低表达Trx1的Hp菌株(由北京大学第三医院消化科实验室培养并测定)来源于前期工作中采用PCR法比较不同胃疾病来源的Trx1 mRNA,并确定了其高、低表达量的界限,10%区间值为8.86,90%区间值为28.05[8]。
2. 细胞株:GES-1细胞株购自北京康为世纪生物科技有限公司。
3. 主要试剂:胎牛血清购自Gibco公司,RPMI-1640培养基购自HyClone公司,哥伦比亚琼脂基础培养基购自北京奥博星生物技术有限责任公司,二甲基亚砜(DMSO)和碘化丙啶(PI)购自Sigma公司,四甲基偶氮唑蓝(MTT)购自南京凯基生物科技发展有限公司。
4. 主要仪器:倒置相差显微镜(Leica DMIL 090-135.001)、流式细胞仪、酶联免疫检测仪(Thermo Scientific)。
二、方法
1. 细菌培养:取-80 ℃保存的高、低表达Trx1的Hp菌株,室温下解冻,取菌株悬液接种于哥伦比亚固体培养基(含新鲜全羊血10%),并置于37 ℃微需氧环境(5% O2,10% CO2,85% N2)中,72 h后细菌生长良好,收集细菌,采用分光光度计在波长660 nm 处测定细菌浓度。
2. 细胞培养:将GES-1细胞置于细胞培养箱,于37 ℃ 50 mL/L CO2饱和湿度环境中培养,置于含10%胎牛血清的RPMI-1640培养基中,每周更换3次营养液,并于细胞生长约80%融合时,用2.5 g/L胰蛋白酶消化并以1∶3传代。
3. 细菌、细胞共培养:收集对数生长期GES-1细胞,分别接种于6孔板(1×105/孔)和96孔板(1×104/孔,复3孔),实验组细胞按1∶50、1∶100、1∶200 的细胞/细菌比例加入菌株,另设不加菌株的空白细胞作为对照组,于37 ℃ 50 mL/L CO2饱和湿度环境中共同孵育。
4. 细胞形态学观察:共培养24、48 h时,通过倒置相差显微镜观察GES-1细胞的形态变化。
5. 细胞存活率检测:采用MTT法。细胞经胰酶消化制成单细胞悬液,按2×103/孔的密度接种于96孔板,设3个复孔,加入20 μL MTT 4 h,DMSO 10 min,在波长550 nm处测定吸光度(A)值,重复3次,存活率=(实验组A值/对照组A值)×100%。
6. 细胞周期检测:分别于共培养24、48 h时收集1∶100浓度组和对照组的细胞原培养液,制成细胞悬液,1 000×g离心5 min,弃上清,冷PBS洗涤1次,然后重悬于-20 ℃预冷的75%乙醇中,-20 ℃保存,测量时调整细胞浓度为1×106/mL,取1 mL细胞悬液,PBS洗涤3次,细胞重悬于1 mL PI染液中,30 min后上流式细胞仪检测。
三、统计学分析
结果
一、GES-1细胞形态变化
倒置相差显微镜下见对照组细胞壁光滑,细胞饱满,状态良好,细胞呈长梭型,均一贴壁生长,培养液清亮。实验组细胞状态随Hp浓度增高以及观察时间延长而出现细胞壁欠光滑,细胞不饱满,贴壁细胞数量减少,细胞变圆,悬浮细胞增多,培养液变浑浊,其中Trx1高表达组的GES-1细胞受损状态较Trx1低表达组严重,且在48 h时更为明显(图1)。
二、高、低表达Trx1的Hp对细胞的影响
GES-1细胞的增殖活性随时间延长和Hp浓度的增加逐渐受到抑制,呈时间和浓度依赖性。与对照组相比,随着Hp浓度的增高和观察时间延长,实验组细胞的存活率逐渐降低,其中Trx1高表达组的细胞存活率低于相同Hp浓度的Trx1低表达组(表1)。
三、细胞周期
与对照组相比,实验组GES-1细胞进入S期的比例升高,且48 h时细胞进入S期的比例明显高于24 h,Trx1高表达组GES-1细胞进入S期的比例亦明显高于Trx1低表达组(表2)。

图1 Trx1高、低表达的不同Hp浓度组GES-1细胞损伤状态(倒置相差显微镜,×100)


组 别1∶50Trx1高表达组Trx1低表达组1∶100Trx1高表达组Trx1低表达组1∶200Trx1高表达组Trx1低表达组24h 对照组0.556±0.0420.556±0.0420.556±0.0420.556±0.0420.556±0.0420.556±0.042 实验组0.343±0.026*#0.402±0.029*0.286±0.036*#0.326±0.040*0.257±0.016*0.277±0.013*48h 对照组0.540±0.0120.540±0.0120.540±0.0120.540±0.0120.540±0.0120.540±0.012 实验组0.204±0.035*#0.343±0.040*0.192±0.059*#0.222±0.001*0.141±0.029*0.208±0.029*
*与对照组比较,P<0.05;#与相同Hp浓度的Trx1低表达组比较,P<0.05
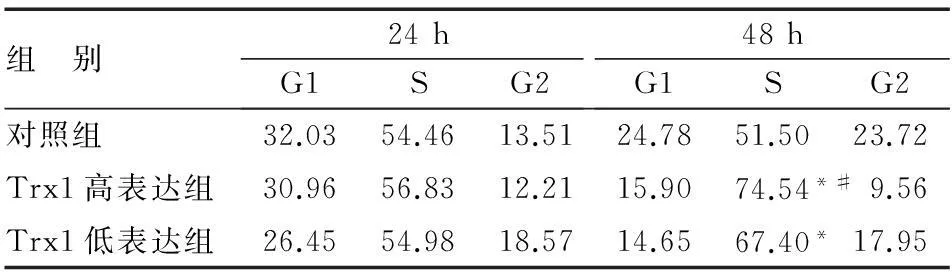
表2 GES-1细胞周期变化(%)
*与对照组比较,P<0.05;#与Trx1低表达组比较,P<0.05
讨论
在正常情况下,胃黏膜细胞增殖与凋亡处于动态平衡状态以保持胃黏膜结构的完整性,大量研究发现Hp感染可使这一平衡遭到破坏,促进胃癌的发生,但Hp感染引起上述变化的机制仍未阐明[9]。西方国家的研究显示,含CagA和VacA的Hp细菌毒力强,与引起溃疡、胃癌等发生密切相关,在致病过程中起有关键作用;但我国等东亚国家的研究[10-12]结果显示,超过90%的东亚人群感染的Hp含有上述因子,可能存在与西方不同的致病毒力;但目前仍未取得令人满意的结果。
Trx1为分泌蛋白,当受到化学、生物、环境等应激刺激时,可能通过Ⅳ分泌系统等分泌。在Hp定植宿主的过程中,Trx1可通过催化还原反应减轻宿主对Hp的反应,诱导宿主局部黏膜组织黏蛋白结构破坏,使Hp易于定植,并且还有保护Hp免受宿主胃酸损害等作用。Trx1还可对精氨酸酶进行翻译后刺激,使其活性增加,而精氨酸酶可抑制宿主氮氧化物的产生,在胃癌的发生、发展过程中发挥重要作用。
何红梅等[13]采用胃癌高发区和低发区的差异基因型Hp与GES-1细胞共培养,结果显示胃癌高发区差异基因型对GES-1细胞具有更强的损伤作用,其作用机制可能是增加8-羟基脱氧鸟苷的表达而引起细胞恶性转化。郭涛等[14]的研究显示,Hp可通过上调Fas受体表达直接介导胃上皮细胞凋亡,Hp相关细胞因子白细胞介素-8可能通过上调Fas受体表达增强Hp诱导的GES-1细胞凋亡。何兴祥等[15]采用Hp慢性感染胃上皮细胞,结果显示可诱导胃上皮细胞产生凋亡耐受,并可增加胃上皮细胞癌变的危险性。
本研究采用高、低表达Trx1的Hp与GES-1细胞共培养,结果显示与对照组相比, Trx1 高表达和低表达组细胞壁欠光滑,细胞不饱满,贴壁细胞数量减少,细胞变圆,悬浮细胞增多,培养液变浑浊,Trx1高表达组对细胞的损伤作用更明显,且这种作用与Hp浓度、共育时间呈正相关。MTT结果显示Trx1高表达组GES-1细胞生长明显受抑制,细胞存活率下降,与低表达组相比,细胞:细菌浓度比为1∶50和1∶100时,两者差异有统计学意义(P<0.05)。细胞周期检测显示Trx1高表达组的GES-1细胞周期分布受到明显影响,处于S期的细胞比例增多,与观察时间呈正相关,与低表达组相比差异有统计学意义(P<0.05),且伴有明显的亚二倍体出现,结合MTT结果提示细胞阻滞于S期,凋亡趋势明显。由此推测Trx1可能为毒力因子,其通过使GES-1细胞阻滞于S期,抑制细胞增殖活力,可能导致DNA的合成以及表达发生变化,使正常胃上皮细胞增殖与凋亡的平衡发生紊乱。说明Trx1可能作为一种毒力因子,对细胞有损伤作用,且Trx1表达越高,对细胞的损伤作用更明显。此外,Trx1对胃上皮细胞的损伤作用可能使细胞产生氧化应激,进而刺激细胞代偿性增生,使细胞DNA合成增加,进入S期的比例升高,这种增殖活性受到抑制而引起的代偿性增生反应过程,有可能存在癌变的危险,可能是Trx1致胃癌发生的机制之一。
参考文献
1 Gong M, Ling SS, Lui SY, et al.Helicobacterpyloriγ-glutamyl transpeptidase is a pathogenic factor in the development of peptic ulcer disease[J]. Gastroenterology, 2010, 139 (2): 564-573.
2 Jang SH, Lim JW, Morio T, et al. Lycopene inhibitsHelicobacterpylori-induced ATM/ATR-dependent DNA damage response in gastric epithelial AGS cells[J]. Free Radic Biol Med, 2012, 52 (3): 607-615.
3 Gowda KL, Marie MA, John J, et al. Cytopathic effects of toxogenic strains ofHelicobacterpylorion different cell lines[J]. Indian J Pathol Microbiol, 2014, 57 (2): 187-190.
4 Laurent TC, Moore EC, Reichard P. Enzymatic synthesis of deoxyribonucleotides. Ⅳ. isolation and chatacterization of thioredoxin, the hydrogen donor fromEscherichiacoliB[J]. J Biol Chem, 1964, 239: 3436-3444.
5 Windle HJ, Fox A, Ni Eidhin D, et al. The thioredoxin system ofHelicobacterpylori[J]. J Biol Chem, 2000, 275 (7): 5081-5089.
6 Baker LM, Raudonikiene A, Hoffman PS, et al. Essential thioredoxin-dependent peroxiredoxin system fromHelicobacterpylori: genetic and kinetic characterization[J]. J Bacteriol, 2001, 183 (6): 1961-1973.
7 张静, 丁士刚, 钟丽君, 等. 消化性溃疡、胃炎与胃癌患者幽门螺杆菌蛋白质组的差异分析[J]. 中华医学杂志, 2006, 86 (38): 2690-2694.
8 石岩岩, 丁士刚, 鲁凤民, 等. 胃癌和消化性溃疡患者幽门螺杆菌临床菌株硫氧还蛋白-1表达量分析[J]. 胃肠病学, 2011, 16 (10): 601-604.
9 Mimuro H, Suzuki T, Naqai S, et al.Helicobacterpyloridampens gut epithelial self-renewal by inhibiting apoptosis, a bacterial strategy to enhance colonization of the stomach[J]. Cell Host Microbe, 2007, 2 (4): 250-263.
10张莉, 林三仁, 金珠, 等. 幽门螺杆菌的cag-A基因和iceA基因与胃十二指肠疾病的关系[J]. 北京医科大学学报, 2000, 32 (2): 117-120.
11Lee KM, Lee JS, Jung HS, et al. Late reactivation of sonic hedgehog byHelicobacterpyloriresults in population of gastric epithelial cells that are resistant to apoptosis: Implication for gastric carcinogenesis[J]. Cancer Lett, 2010, 287 (1): 44-53.
12Wei J, Nagy TA, Vilgelm A, et al. Regulation of p53 tumor suppressor byHelicobacterpyloriin gastric epithelial cells[J]. Gastroenterology, 2010, 139 (4): 1333-1343.
13何红梅, 宫月华, 袁媛. 胃癌高低发区差异基因型幽门螺杆菌菌株对人胃上皮细胞系GES-1的损伤作用[J]. 世界华人消化杂志, 2005, 13 (22): 2681-2684.
14郭涛, 钱家鸣, 张建中, 等. 幽门螺杆菌及其相关细胞因子对胃上皮细胞凋亡的调控及相关机制[J]. 中华医学杂志, 2006, 86 (38): 2670-2673.
15何兴祥, 胡品津. 幽门螺杆菌慢性感染诱导胃上皮细胞产生凋亡耐受[J]. 中华医学杂志, 2003, 83 (1): 42-45.
(2014-07-17收稿;2014-08-23修回)
·共识与指南·
Effect ofHelicobacterpyloriwith Thioredoxin-1 Expression on Growth of Human Gastric Epithelial Cell Line GES-1LIULinna1,DINGShigang2,SHIYanyan2,JIAShujuan1.1DepartmentofGastroenterology,PekingUniversityShougangHospital,Beijing(100041);2DepartmentofGastroenterology,PekingUniversityThirdHospital,Beijing
Correspondence to: DING Shigang, Email: dingshigang222@163.com
Background:Helicobacterpylori(Hp) infection plays an important role in the process of development of gastric cancer. Bacterial virulence factor is very important in the causation of various gastric diseases. Aims: To investigate the effect of Hp with thioredoxin-1 (Trx1) expression on growth of human gastric epithelial cell line GES-1. Methods: GES-1 cells and Hp with high or low Trx1 expression were co-cultured with different ratio of cell to Hp (1∶50, 1∶100, 1∶200) for 24 and 48 hours, respectively; cells cultured without Hp were served as blank controls. Morphological change of GES-1 cells was observed by inverted phase contrast microscope, and cell survival rate was assessed by MTT assay. Cell cycle was measured by flow cytometry in GES-1 cells with 1∶100 concentration ratio and blank control groups. Results: The results of inverted phase contrast microscope and MTT assay showed that Hp with high or low Trx1 expression could induce injury of GES-1 cells and decrease cell survival rate in a time- and concentration-dependent manner, especially in high Trx1 expression group. Flow cytometry showed that the percentage of GES-1 cells in S phase in high Trx1 expression group was significantly higher than that in low Trx1 expression group at both 24thand 48thhour. Conclusions: Hp with high or low Trx1 expression can inhibit the growth of GES-1 cells, the pathogenicity is higher for Hp with high Trx1 expression, and is related to the development of gastric cancer.
Key wordsHelicobacter pylori;Thioredoxins;GES-1;Cell Proliferation;Cell Cycle
通信作者#本文,Email: dingshigang222@163.com
DOI:10.3969/j.issn.1008-7125.2015.02.007

