蛋白酶结合自溶酶提取南极磷虾油工艺研究
于海宁,陶艳红,冯莹超,华允芬,沈生荣,单伟光
(1.浙江工业大学 药学院,浙江 杭州 310014; 2.浙江大学 生物系统工程与食品科学学院,浙江 杭州 310058)
蛋白酶结合自溶酶提取南极磷虾油工艺研究
于海宁1,陶艳红1,冯莹超1,华允芬1,沈生荣2,单伟光1
(1.浙江工业大学 药学院,浙江 杭州 310014; 2.浙江大学 生物系统工程与食品科学学院,浙江 杭州 310058)
摘要:南极磷虾油含有丰富的磷脂型ω-3不饱和脂肪酸,具有极大的开发价值.南极磷虾含有丰富的自溶酶体系,其自溶作用是否有利于活性物质的提取尚不清楚.采用木瓜蛋白酶对南极磷虾油进行提取,探索自溶酶体系在南极磷虾油提取过程中的作用.结果表明:南极磷虾自溶作用有利于南极磷虾油的提取,木瓜蛋白酶结合自溶酶体系共同作用可取得最佳提取效果.以EPA与DHA质量分数之和为检测指标,探讨了不同酶解温度、料液比、加酶质量分数、酶解时间和pH对南极磷虾油提取效果的影响.先通过单因素实验,再通过正交实验,分析确定了最佳提取工艺条件:酶解温度50 ℃,料液比1∶22 g/mL,加酶质量分数1.25%,酶解时间2 h,pH7.0.在此条件下提取的虾油,EPA和DHA质量分数之和为75.77%。
关键词:南极磷虾;木瓜蛋白酶;自溶;提取
Study on extraction of Antarctic krill oil by protease combined with autolysis
YU Haining1, TAO Yanhong1, FENG Yingchao1, HUA Yunfen1,
SHEN Shengrong2, SHAN Weiguang1
(1.College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China;
2.School of Biosystems Engineering and Food Science, Zhejiang University, Hangzhou 310058, China)
Abstract:Antarctic krill oil is rich in phospholipid type of ω-3 unsaturated fatty acids, and has a great value of development. There are many kinds of self-plasmin in antarctic krill, till now, whether the autolysis of Antarctic krill accelerated extracting of Antarctic krill oil is unclear. In this work, papain was used to extract Antarctic krill oil, while the role of self-lysosomal system in the Antarctic krill oil extraction process was evaluated. The results showed that krill autolysis was beneficial for Antarctic krill oil extraction, and lysosomal system combined with papain can work together to achieve the best extraction results. The content of eicosapentaenoic acid(EPA) and docosahexaenoic acid(DHA) in shrimp oil was investigated with respect to extraction parameters such as enzymatic hydrolysis temperature, solid-liquid ratio, enzyme dosage, hydrolysis time and pH. One-factor-at-a-time experiments followed by orthogonal test analysis were carried out to achieve the optimal extraction conditions as below: At a temperature of 50 ℃, solid-liquid ratio of 1∶22 g/mL, enzyme dosage of 1.25%, pH7.0 hydrolysis 2 hours. Under the optimal conditions, the total content of EPA and DHA in the shrimp oil is up to 75.77%。
Keywords:Antarctic krill; papain; autolyzed; extraction
南极磷虾渔业始于20世纪60年代,80年代达到鼎盛期,1982年上岸量达到历史最高的52.8 万吨.据估计,南极磷虾的生物量为6.5~10.5 亿吨[1-2],是整个南大洋生态系统能量和物质流动的关键环节[3-4],具有巨大的开发和利用潜力.南极磷虾营养比例适中,必需氨基酸占总氨基酸的一半以上,蛋白质含量丰富,被视为人类食品中最有希望,也是最后一个动物蛋白库[5].同时,南极磷虾中含有大量以磷脂形式存在的ω-3长链多不饱和脂肪酸[6]和丰富的虾青素,以ω-3长链多不饱和脂肪酸为主要功能成分的南极磷虾油成为新兴产品.目前,市场上的南极磷虾油以进口产品为主,价格昂贵.近几年,我国对南极磷虾油的提取技术研究也逐渐成为热点领域[7-9]。
南极磷虾油提取方法包括碱解法、有机溶剂浸提法[10]、超临界流体萃取法及酶解法等.在酶解技术制备南极磷虾油的报道中,均采用添加蛋白酶的方法对南极磷虾粉进行酶解,并结合溶剂进行提取.自溶是南极磷虾的重要特点,其体内含有丰富的自溶酶体系,而自溶酶体系是否在南极磷虾油提取过程中发挥了作用仍不清楚[11-12].在前人研究的基础上,笔者首次对自溶酶体系在南极磷虾油提取中的作用进行探索,并对木瓜蛋白酶、自溶酶及两者复合体系酶解效果进行比较,通过工艺优化,以期获得高效、低耗的南极磷虾油最优提取方法。
1材料与方法
1.1材料和试剂
南极磷虾由上海水产集团总公司提供;色谱纯正己烷购自天津市四友精细化学品有限公司;活性为≥3 units/mg的木瓜蛋白酶购自阿拉丁;盐酸、甲醇、无水乙醇、丙酮、正己烷、石油醚和乙酸乙酯均为分析纯,购自国药集团。
1.2仪器和设备
EL204电子天平购自梅特勒-托利多仪器公司;ST16R台式离心机购自赛默飞世尔科技(中国)有限公司;7890A气相色谱仪购自美国安捷伦公司;R-210旋转蒸发仪购自瑞士Buchi公司;SH2-D(Ⅲ)真空泵购自巩义市予华仪器有限公司;DK-S24水浴锅购自上海精宏实验设备有限公司。
1.3方法
1.3.1提取溶剂的选择
根据油脂的极性大小,分别选用油脂提取过程中常用的正己烷、石油醚、乙酸乙酯、丙酮和无水乙醇等5种提取剂进行提取[13-15].取10 g南极磷虾粉末,酶解,离心,加入100 mL提取剂提取2 h,离心,取上清.下层再加入100 mL提取剂,相同条件提取,上清合并,旋干,得虾油。
1.3.2不同处理提取效果比较
1) 自溶酶体系实验:取100 g鲜虾,经匀浆后加100 mL水,在50 ℃下酶解2 h,取出后离心,取下层固体,用乙醇提取两次,每次加100 mL,50 ℃条件下提取2 h,合并提取液,旋干,获得样品。
2) 木瓜蛋白酶酶解实验:取100 g鲜虾,先于80 ℃烘箱中灭活,然后取出,经匀浆后,加100 mL蒸馏水和适量木瓜蛋白酶,在50 ℃下酶解2 h,取出后离心,取下层固体,用乙醇提取两次,每次加100 mL,50 ℃条件下提取2 h,合并提取液,旋干,获得样品。
3) 木瓜蛋白酶结合自溶酶体系酶解实验:取100 g鲜虾,经匀浆后加100 mL水和适量的木瓜蛋白酶,在50 ℃下酶解2 h,取出后离心,取下层固体,用乙醇提取两次,每次加100 mL,50 ℃条件下提取2 h,合并提取液,旋干,获得样品。
1.3.3虾油提取工艺优化
基于南极磷虾自溶的特性,考虑到生产实际,本实验首先对南极磷虾进行冻干,既可保持南极磷虾体内自溶酶活性,又易于工业化贮藏.在优化提取工艺条件时,采用南极磷虾冷冻干燥粉进行实验.具体工艺如下:
鲜南极磷虾→冷冻干燥→粉碎→酶解→离心得下层沉淀→浸提→离心→上清→旋干→虾油
1.3.4南极磷虾油甲酯化
取0.5 mL虾油于离心管中,快速加入体积分数为5%盐酸甲醇2 mL,立即密封放入100 ℃恒温箱中反应3 h,冷却至室温,加入等体积的高纯水,用3 mL正己烷分三次萃取,回收正己烷相,用无水硫酸钠除水并经0.22 μm滤膜过滤,氮气吹干.用正己烷定容至1 mL,进样。
1.3.5气相色谱分析
1) 气相色谱条件
色谱柱:DB-23(0.25 mm,60 m);程序升温条件:130 ℃保留1 min,6.5 ℃/min升至180 ℃,然后2.5 ℃/min升至225 ℃并保持10 min;分流比:1∶50;进样量10 μL;以N2为载气流速1.0 mL/min。
2) EPA与DHA总质量分数计算
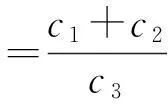
式中:c1为EPA质量浓度,ng/μL;c2为DHA质量浓度,ng/μL;c3为总脂肪酸质量浓度,ng/μL。
2结果与分析
2.1不同溶剂对提取效果的影响
根据图1可知:乙酸乙酯的提取效果最好,无水乙醇的提取效果次之.基于生产安全及产品质量考虑,选择无水乙醇作为提取溶剂。
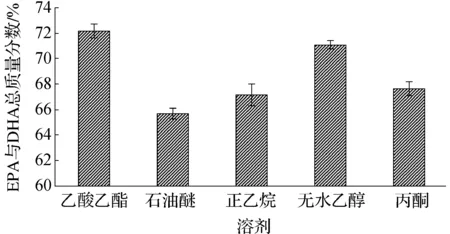
图1 不同溶剂对南极磷虾油提取的影响Fig.1 Effect of different solvents on the extraction to Antarctic krill oil
2.2不同处理提取效果比较
在其它条件相同的情况下,分别采用木瓜蛋白酶、自溶酶体系及两者复合体系对南极磷虾进行酶解,不同处理所得磷虾油中EPA与DHA总质量分数,如图2所示。
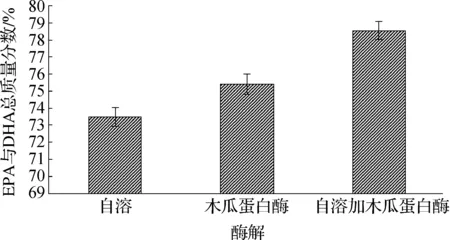
图2 自溶酶、木瓜蛋白酶及两者复合体系对南极磷虾油中EPA与DHA总质量分数的影响Fig.2 Comparison of enzymatic hydrolysis, autolysis and a combination of both
由图2可知:木瓜蛋白酶与自溶酶复合体系制备的南极磷虾油中EPA与DHA总质量分数比自溶酶或木瓜蛋白酶单独作用高,说明两种酶体系在南极磷虾油提取过程中均发挥了作用,故在后续研究中,采用木瓜蛋白酶与自溶酶复合作用方法进行南极磷虾油提取工艺优化。
2.3复合酶制备南极磷虾油工艺优化
2.3.1酶解温度对提取效果的影响
取南极磷虾粉末10.0 g,控制料液比1∶10 g/mL,加酶质量分数1%,酶解时间2 h,pH7.0,分别在30,40,50,60,70 ℃温度下进行酶解.酶解后进行溶剂提取,不同处理所得磷虾油中EPA与DHA总质量分数,如图3所示。

图3 酶解温度对南极磷虾油提取的影响Fig.3 Effect of different enzymatic hydrolysis temperature on the extraction to Antarctic krill oil
由图3可知:随着温度的升高,EPA和DHA在总脂肪酸的质量分数先减少,后增加,最后略微下降,趋于平衡.出现这种现象的原因,可能与南极磷虾自溶酶系统与木瓜蛋白酶在不同温度下水解能力差异性有关.温度为50 ℃时,含量最高,是因为在pH为7.0的条件下,南极磷虾自溶酶的活性最高[13],且50~65 ℃是木瓜蛋白酶的最适温度.因此,选择45,50,55,60 ℃作为正交实验的4个水平。
2.3.2料液比对提取效果的影响
取南极磷虾粉末10.0 g,控制温度50 ℃,加酶质量分数1%,酶解时间2 h,pH7.0,料液比分别为1∶6,1∶10,1∶14,1∶18,1∶22 g/mL,进行单因素实验,不同处理所得磷虾油中EPA与DHA总质量分数,如图4所示。
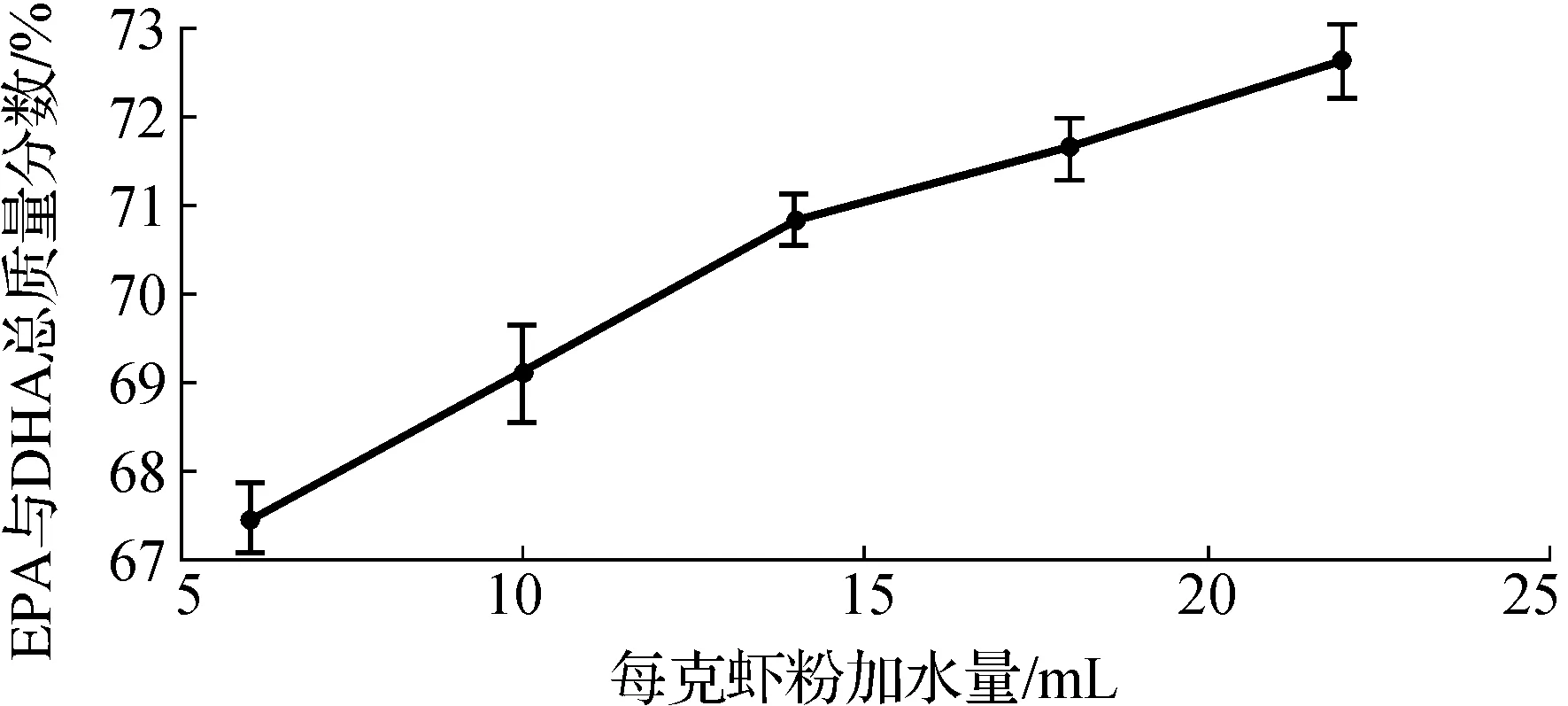
图4 料液比对南极磷虾油提取的影响Fig.4 Effect of different material-to-liquid ratio on the extraction to Antarctic krill oil
由图4可知:随着料液比的增加,EPA和DHA在总脂肪酸中的质量分数逐渐增加,这可能与酶活性位点与底物是否完全接触有关.由于料液比为1∶22 g/mL时EPA与DHA总质量分数处于最高点,故在后续正交实验中,增加1∶26,1∶30 g/mL作为考察水平.因此,选择料液比为1∶18,1∶22,1∶26,1∶30 g/mL作为正交实验的4个水平。
2.3.3加酶质量分数对提取效果的影响
取南极磷虾冷冻粉末10.0 g,控制温度50 ℃,料液比1∶22 g/mL,酶解时间2 h,pH7.0,加酶质量分数分别为0.5%,1.0%,1.5%,2.0%,2.5%,进行单因素实验,各处理所得磷虾油中EPA与DHA总质量分数,如图5所示。

图5 加酶质量分数对南极磷虾油提取的影响Fig.5 Effect of different enzyme dosage on the extraction to Antarctic krill oil
由图5可知:随着木瓜蛋白酶量的增加,EPA和DHA在总脂肪酸中的质量分数变化不明显.基于生产实际考虑,最佳加酶质量分数为1.0%~1.5%,故选择0.75%,1.0%,1.25%,1.5%作为正交试验的4个水平。
2.3.4酶解时间对提取效果的影响
取南极磷虾粉末10.0 g,控制温度50 ℃,料液比1∶22 g/mL,加酶质量分数1.0%,pH7.0,酶解时间分别为1.0,1.5,2.0,2.5,3.0 h,进行单因素实验,各处理所得磷虾油中EPA与DHA总质量分数,如图6所示。
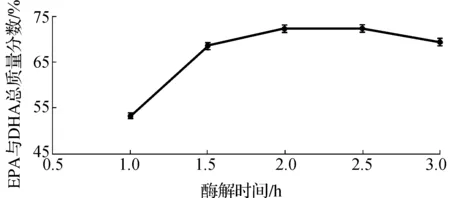
图6 酶解时间对南极磷虾油提取的影响Fig.6 Effect of different enzymatic hydrolysis time on the extraction to Antarctic krill oil
由图6可知:随着酶解时间的增加,EPA和DHA在总脂肪酸中的质量分数,先增加,后续逐渐趋于平稳.究其原因,可能开始时酶的底物较为丰富,酶的活性较高,但是随着酶解时间的增加,底物逐渐减少,蛋白酶之间相互发生水解加剧,蛋白酶的活力逐渐下降.因此,最佳水解时间为2 h,故选择1.6,2.0,2.4,2.8 h作为正交试验的4个水平。
2.3.5pH对提取效果的影响
取南极磷虾粉末10.0 g,控制温度50 ℃,料液比1∶22 g/mL,加酶质量分数1.0%,酶解时间2.0 h,pH分别为4.0,5.0,6.0,7.0,8.0,进行单因素实验.各处理所得磷虾油中EPA与DHA总质量分数,如图7所示。

图7 pH对南极磷虾油提取的影响Fig.7 Effect of different pH on the extraction to Antarctic krill oil
由图7可知:随着pH的增大,EPA和DHA在总脂肪酸中的总质量分数先减小,后增大,最后趋于水平.出现这种现象的原因是南极磷虾自溶酶系统中有两种酸性蛋白酶,最适pH为3.0[16];有一种类胰蛋白酶,最适pH为8.0[17];有两种羧肽酶,最适pH为5.5~6.5[18].然而,木瓜蛋白酶的最适pH为6.0~7.0.所以在pH为4.0时,主要是自溶酶系统中的酸性蛋白酶在发挥水解作用;在pH为6.0~8.0时,是木瓜蛋白酶与自溶酶共同发挥水解作用.因此,选择pH为6.0,6.5,7.0,7.5作为正交实验的4个水平。
2.4正交试验结果
在单因素实验的基础上,以pH、酶解温度、酶解时间、料液比和加酶质量分数为参考因素,每个因素设4个水平,正交表设计及结果如表1,2所示。
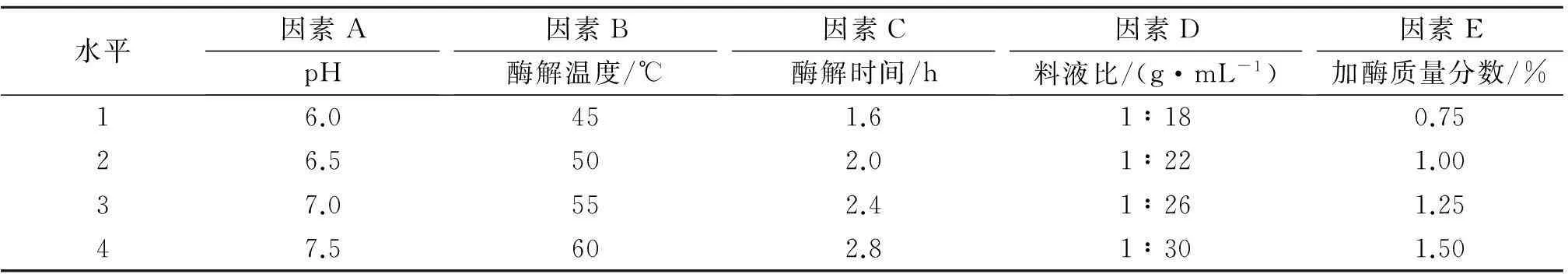
表1 酶解结合自溶法提取工艺因素水平表
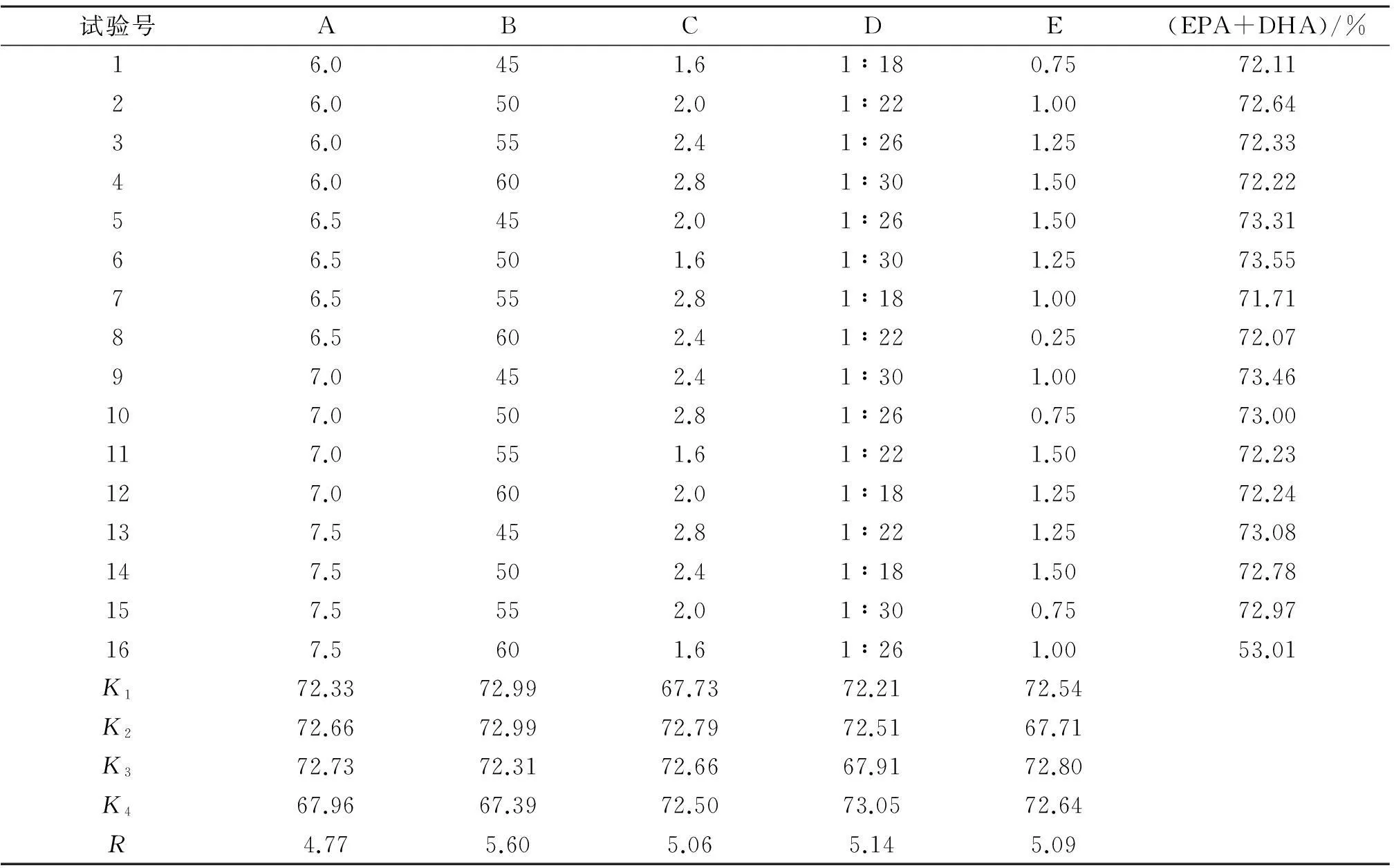
表2 酶解结合自溶法法提取工艺L16(45)正交试验结果
由表2可知:RB>RD>RE>RC>RA,即酶解温度对提取效果影响最大,料液比次之,加酶质量分数第三,酶解时间第四,pH值影响最小.在pH的影响中,K3最大;在酶解温度的影响中,K1最大;在酶解时间的影响中,K2最大;在料液比的影响中,K4最大,考虑到K2与K4接近,料液比的增大显著增加成本,故选择K2最优;在加酶质量分数的影响中,K3最大.综上,正交试验的最优组合为A3B1C2D2E3。
2.5验证试验
取南极磷虾粉末10.0 g,控制温度45 ℃,料液比1∶22 g/mL,加酶质量分数1.25%,酶解时间2.0 h,pH为7.0,进行3组实验.测得的EPA和DHA在总脂肪酸中的质量分数分别为75.99%,75.42%,75.91%,平均值为75.77%.显著大于正交实验中的EPA和DHA在总脂肪酸中的质量分数,证明该结果合理可靠。
3结论
南极磷虾中存在的自溶酶体系参与了南极磷虾油的提取过程,木瓜蛋白酶与自溶酶体系共同作用提取南极磷虾油,不仅充分利用了南极磷虾自身含有的自溶酶体系,而且效果优于两者单独作用.所得到的虾油,活性成分EPA与DHA质量分数总和明显高于两者单独使用,质量更优;以南极磷虾中EPA和DHA总质量分数作为指标,获得的南极磷虾油最佳提取工艺:在温度为45 ℃及pH为7.0时,控制料液比为1∶22 g/mL,加酶质量分数为1.25%,水浴酶解2.0 h.该条件下所得南极磷虾油EPA和DHA在总脂肪酸中的质量分数为75.77%。
参考文献:
[1]唐建业,石桂华.南极磷虾渔业管理及其对中国的影响[J].资源科学,2010,32(1):11-18.
[2]ROGER P H, ELIZABETH L L. The flishery on Antarctic krill defining an ecosystem approach to management[J]. Reviews in Fisheries Science,2000,8(3):235。
[3]朱国平.南极磷虾种群生物学研究进展Ⅱ-繁殖[J].水生生物学报,2013,37(4):751-757.
[4]刘志东,陈雪忠,黄洪亮,等.南极磷虾粉的营养成分分析及评价[J].中国海洋药物杂志,2012,31(2):31.
[5]刘志东,陈雪忠,曲映红,等.南极冰鱼与南极磷虾营养成分分析及比较[J].现代食品科技,2014,30(2):228-232.
[6]GIGLIOTTI J C, DAVENPORT M P, BEAMER S K, et al. Extraction and characterisation of lipids from Antarctic krill (Euphausia superba)[J]. Food Chemistry,2011,125(3):1028-1030。
[7]王亚恩,姜国良,徐恺,等.南极磷虾油对高脂血症大鼠血脂和抗氧化力的影响[J].中国海洋药物杂志,2008,30(3):56-59.
[8]刘丽,刘承初,赵勇,等.南极磷虾的营养保健功效以及食用安全性评价[J].食品科学,2010,31(17):443.
[9]徐吟梅,邱卫华,余丽萍,等.南极磷虾粉的营养与功能[J].现代渔业信息,2010,25(8):14.
[10]JOSEPH C G, MATTHEW P D, SARAH K B, et al. Extraction and characterisation of lipids from Antarctic krill(Euphausia superba)[J]. Food Chemistry,2001,125:1028-1036。
[11]薛勇,赵明明,王超,等.响应面法优化南极磷虾蛋白自溶工艺的研究[J].食品工业科技,2012,33(04):346-348.
[12]杭虞杰,李学英,杨宪时,等.南极磷虾自溶酶性质的初步研究[J].食品科学,2011,32(13):198-199.
[13]于海宁,孙晨,单伟光,等.杭白菊中抗癌活性成分的半仿生提取[J].浙江工业大学学报,2012,40(6):631-633.
[14]汪倩雯,汪琨,杨霄,等.89种中草药醇提物体外抗菌活性的研究[J].浙江工业大学学报,2009,37(3):290-294.
[15]董玲玲,黄鑫,齐阳光,等.酶解-微波法提取黄芪多糖的工艺研究[J].浙江工业大学学报,2011,39(5):528-531.
[16]KIMOTO N. Classification of proteases in Antarctic krill[J]. Agricultural and Biological Chemistry,1983,47(11):2577-2583。
[17]SJODAHL J, EMMER A, KARLSTAM B, et al. Separation of photolytic enzymes originating from Antarctic krill (Euphausia superba) by capillary electrophoresis[J]. Journal of Chromatography Biomedical Applications,1998,705(2):231-241。
[18]OSNES K K, VIGGO M. On the purification and characterization of three anionic, serine-type peptide hydrolases from Antarctic krill (Euphausia superba)[J]. Comparative Biochemistry and Physiology,1985,82(2):607-619。
(责任编辑:陈石平)
中图分类号:R774.1
文献标志码:A
文章编号:1006-4303(2015)02-0143-05
作者简介:于海宁,(1977—)女,山东潍坊人,副教授,研究方向为天然药物,E-mail: yuhaining@zjut.edu.cn。
基金项目:浙江省自然科学基金资助项目(LQ12C02003)

