中药白术SCAR分子鉴定标记的筛选和克隆
李 敏,陈 强,茅学群
(浙江工业大学 药学院,浙江 杭州 310014)
中药白术SCAR分子鉴定标记的筛选和克隆
李敏,陈强,茅学群
(浙江工业大学 药学院,浙江 杭州 310014)
摘要:获取四种白术的SCAR分子标记,并对SCAR分子标记进行回收和克隆.利用PCR技术和10个碱基组成的随机引物对浙白术、河北小白术、湖南平术、安徽徽术进行分子鉴定标记的筛选,对分子鉴定标记进行回收和T-载体克隆.利用随机引物S9,S10经PCR技术,分别从浙白术和河北小白术中获取到SCAR分子标记ZBZ和HBZ,这两个SCAR标记经回收后成功克隆进入T-载体.实验筛选获得浙白术和河北小白术的SCAR分子标记ZBZ和HBZ,克隆后的SCAR标记经测序后,可以为白术特异性PCR鉴定方法的引物设计奠定基础。
关键词:白术;SCAR分子标记;中药分子鉴定
The screening and cloning of SCAR molecular marker from
AtractylodesmacrocephaLaKoidz
LI Min, CHEN Qiang, MAO Xuequn
(College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China)
Abstract:A sequence characterized amplified region (SCAR) markers from four kinds of Atractylodes macrocephaLa Koidz was obtained, and then these SCAR markers were recycled and cloned. Methods SCAR markers of Atractylodes macrocephaLa Koidz from Zhejiang, Hebei, Hunan, Anhui province were screened using ten random primers by PCR. The SCAR markers obtained were recycled from the gel and inserted into T-vector to get cloned. According to the PCR results of primers S9 and S10, two SCAR markers from Zhejiang and Hebei province were screened, one named ZBZ, and the other named HBZ. These two SCAR markers successfully had been recycled and cloned into T-vector. Atractylodes macrocephaLa Koidz SCAR marker ZBZ and HBZ obtained from Zhejiang and Hebei province was screened, and then sequenced. The message of the sequence could provide a basis of primer design for Atractylodes macrocephaLa Koidz specific PCR。
Keywords:Atractylodes macrocephaLa Koidz, SCAR, molecular identification of Chinese traditional medicine
中药白术是菊科植物白术AtractylodesmacrocephaLaKoidz的干燥根茎,素有“十方九术”、“北参南术”之称,具有治脾益气,燥湿利水,止汗安胎的功效,在临床上应用广泛[1].白术在我国的种植主产地包括浙江、河北、湖南及安徽.浙江磐安、新昌、嵊县和东阳等地所产品种统称为“浙白术”,是道地药材“浙八味”之一;河北安国盛产“小白术”,是全国最大的白术种苗基地;湖南所产白术中以平江所产最为著名,名为“平术”;安徽亳州所产白术,名为“徽术”.由于白术种植市场的不断扩大,种植户使用的种质混杂,种植方法不规范,以及商家以次充好等原因,导致了目前白术流通市场的混种情况较为严重[2].因此,需要对白术品种做出准确的鉴定,以保证相关药物的质量.由于中药材产地的区别,有效成分的含量也不同,从而导致药效存在很大的不同[3].白术种植地广,品种多,各品种的外观和理化性质较为接近,使用传统的中药鉴定方法较难进行区分,应用中药分子鉴定方法,可以从白术的基因分子水平进行鉴定,具有快速、准确及重现性好等优点。
SCAR(Sequence characterized amplified region,特征性扩增片段区域)分子标记是研究对象基因组中特定序列的DNA分子,找到SCAR分子标记,并获得它的序列,就可以根据序列设计特异性引物,对研究对象实现特异性PCR分子鉴定方法[4-5].比较成功的例子有蒋超等人利用SCAR分子标记技术成功地鉴别出了金银花的真伪[6];龙平等应用SCAR技术研究出了基于位点特异性PCR黄芪与红芪鉴别方法[7].本实验以四种白术为研究对象,通过PCR技术筛选SCAR分子标记,并对SCAR标记进行回收和克隆,为建立白术特异性PCR分子鉴定方法打下基础。
1材料与方法
1.1材料
1.1.1药材
实验所采用的四种白术新鲜植株于2013年5月—2013年7月分别采自于浙江、河北、湖南和安徽四个白术主产地,经硅胶快速干燥,保存于-70 ℃冰箱备用.以上白术品种经浙江工业大学药学院华允芬副教授鉴定为正品.药材信息详见表1。
表1四种白术的产地及种质类型
Table 1Origin and type of four kinds ofAtractylodesmacrocephaLaKoidz

序号品种品种地理位置种质类型1浙白术浙江绍兴市新昌白术生产基地大白术2河北小白术河北安国市齐村种植基地小白术3湖南平术湖南岳阳市平江县农户半野生白术4安徽徽术安徽亳州市大白术
1.1.2试剂与仪器
植物基因组DNA快速抽提试剂盒,SanPrep柱式DNA胶回收试剂盒,EZ-10 Spin Column Plasmid DNA Minipreps Kit,pUCm-T vector试剂盒,PCR相关试剂,琼脂糖,LB培养基,AMP,X-gal,IPTG,10 mg/mL溴化乙锭(EB)溶液,50×TAE缓冲液均购于生工®生物工程(上海)有限公司.My Cycler Thermal Cycler和凝胶成像仪Molecular Imager® Gel Doc XR+ Imaging System均购于Bio-Rad Laboratories, Inc。
1.2室验方法
1.2.1白术基因组DNA的提取
取新鲜白术嫩叶70 mg,用液氮充分研磨.依次加入400 μL的Buffer PCL、20 μL的RNase A和8 μL的β-巯基乙醇,振荡混匀1 min,置于65 ℃温浴45 min,间或混匀.加入200 μL的Buffer PP混匀,充分颠倒混匀,-20 ℃冰箱放置5 min.10 000 r/min离心5 min.取上清液加入新的1.5 mL离心管中,加入500 μL的氯仿,颠倒混匀,室温12 000 r/min离心5 min.取上清液加等体积的异丙醇,4 ℃冰箱过夜,室温10 000 r/min离心5 min,弃上清,加入1 000 μL的75%乙醇混匀,颠倒混匀1~3 min,10 000 r/min离心5 min,倒去上清液,晾干残留乙醇,加入800 μL的TE Solution,65 ℃温浴溶解DNA,-20 ℃保存。
1.2.2白术基因组DNA的质量检测
制备质量分数为1.0%的琼脂糖凝胶,DNA样品与上样液混合后加入加样孔中.凝胶在TAE缓冲液中电泳40~50 min.电泳结束后将胶块浸没于EB染色液中染色10 min,取出后用清水漂洗数次,在凝胶成像系统中观察结果,拍照留存.通过电泳结果可以初步估计DNA的质量,使用紫外-可见光分光光度法可以获得DNA的纯度.DNA样品经过稀释后,放入紫外-可见光分光光度计中测定260 nm和280 nm波长处的吸光度,两处波长的吸收值的比例可以显示样品的纯净度,DNA样品的浓度的计算公式:DNA质量浓度=A260×稀释倍数×50。
1.2.3白术SCAR标记的筛选
实验所使用的引物是由10 个碱基组成的单一随机引物.引物的筛选参考了文献报道[8-10],从随机引物库中挑选了10 条,由生工®生物工程(上海)有限公司合成,引物序列见表2.SCAR标记的筛选技术使用了随机引物结合下的PCR反应.PCR反应体系参照文献[11-14],设定为2 μL 10×PCR buffer,1.2 μL MgCl2(25 mmol/L),0.5 μL dNTPs(10 mmol/L),0.5 μL随机引物(20 μmol/L),1.2 μL白术基因组DNA模板,0.3 μL Taq DNA polymerase,补加ddH2O至总体积为20 μL.PCR扩增程序为95 ℃预变性5 min,94 ℃变性45 s,40 ℃复性45 s,72 ℃延伸1 min,44 个循环,最后72 ℃延伸7 min.PCR产物在质量分数为1.2%的琼脂糖凝胶中进行电泳,胶块经溴化乙锭染色后用凝胶成像系统观察结果,拍照留存。

表2 随机引物序列
1.2.4白术SCAR分子标记的回收
用刀片将胶块中的目的条带切下,放置已灭菌的1.5 mL离心管中,称重.按照100 mg胶块加300~600 μL的Buffer B2的比例向离心管中加入试剂.将离心管放置温度为50 ℃的水浴锅中水浴15 min,间断性混匀,直至胶块溶化,不再出现固体为止.将上述得到的溶液全部移入吸附柱中,转速为8 000 r/min离心30 s,倒掉收集管中的废液,将吸附柱放入上述收集管中.加入500 μL的Wash Solution于吸附柱中,转速为9 000 r/min离心30 s,再次倒掉收集管中的废液,将吸附柱放入原来的收集管中.上述步骤重复一次.将得到的空吸附柱和收集管放入离心机,转速为9 000 r/min离心1 min.把吸附柱放入一干净的1.5 mL的EP管中,在吸附膜中央加入30 μL的Elution Buffer,室温放置1~2 min,9 000r/min离心1 min,DNA溶液置于-20 ℃保存.回收产物通过琼脂糖凝胶来检测回收效果。
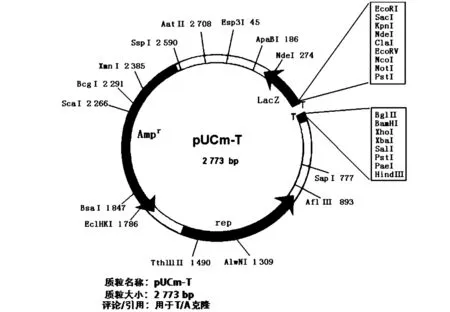

图1 pUCm-T质粒图Fig.1 pUCm-T vector
1.2.5白术SCAR分子标记的克隆
按照pUCm-T试剂盒说明,将回收得到的SCAR分子标记与pUCm-T载体(质粒图谱见图1)进行连接:在0.6 mL的微型离心管中依次加入1 μL的10×Ligation Buffer,1 μL的50%PEG,1 μL的pUCm-T vector,4 μL的纯化后的回收产物,最后加1 μL的T4 DNA Ligase,补加ddH2O至10 μL,连接反应体系混匀后在20 ℃水浴中反应30 min.同时根据感受态细胞制备盒的操作方法制备DH5α感受态细胞.将连接产物与受体细胞按照1∶20的比例量导入受体细胞,涂平板,37 ℃培养过夜.采用蓝白斑筛选法得到阳性克隆.通过EZ-10 Spin column plasmid DNA minipreps kit试剂盒得到重组质粒。
将所得到的重组质粒作为DNA模板,相应随机引物作为引物,对重组质粒进行PCR扩增,PCR扩增反应体系:2 μL 10×PCR buffer,1.2 μL MgCl2(25 mmol/L),0.5 μL dNTPs(10 mmol/L),0.5 μL随机引物(20 μmol/L),1.2 μL重组质粒DNA,0.3 μL Taq DNA polymerase,补加ddH2O至总体积为20 μL.PCR扩增程序:95 ℃预变性5 min,94 ℃变性45 s,40 ℃复性45 s,72 ℃延伸1 min,44 个循环,最后72 ℃延伸7 min.重组质粒和PCR扩增产物通过琼脂糖凝胶电泳进行鉴定。
2结果与分析
2.1白术基因组DNA的提取及质量检测
从四种白术嫩叶中提取获得的白术基因组DNA的琼脂糖凝胶电泳鉴定结果,见图2.从图2中可知:白术基因组DNA片段大小在23 kb左右,条带清晰,无拖尾现象,说明提取获得的白术基因组DNA纯度较高,所含杂质较少,DNA质量较高,DNA分子完整无降解.紫外-可见光分光光度法测定白术基因组DNA的相关数据见表3,表3的数据显示四种白术基因组DNA的OD260/OD280值均在1.8~1.9之间,DNA质量浓度在120~240 μg/mL之间,说明白术基因组DNA的纯度较高,质量较好,为后续实验提供了优质模板。
2.2白术SCAR分子标记的筛选
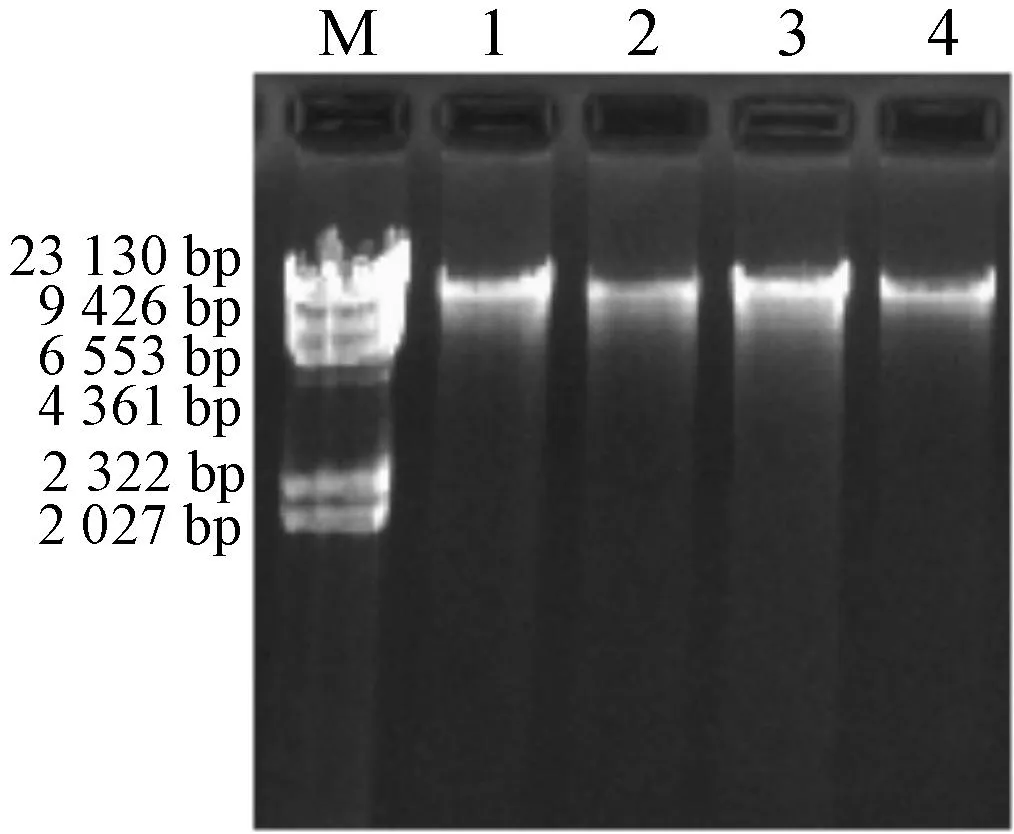
M—Marker;1—浙白术基因组DNA;2—河北小白术基因组DNA;3—湖南平术基因组DNA;4—安徽徽术基因组DNA图2 四种白术基因组DNA电泳图Fig.2 Genomic DNA isolated from four kinds of Atractylodes macrocephaLa Koidz
Table 3The concentration of genomic DNA ofAtractylodesmacrocephaLaKoidz
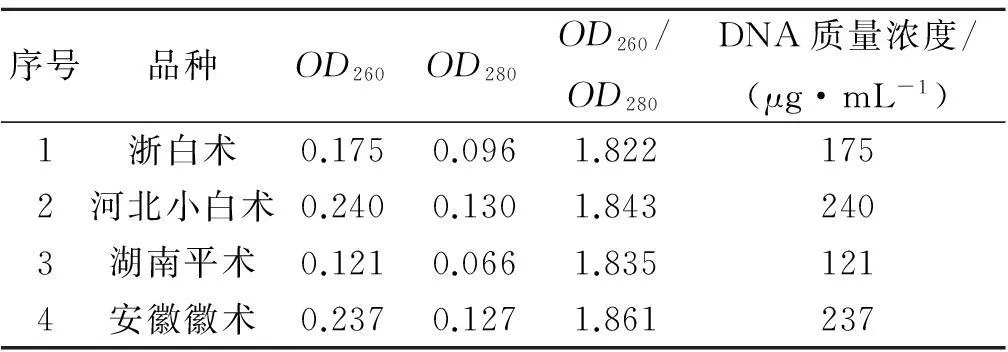
序号品种OD260OD280OD260/OD280DNA质量浓度/(μg·mL-1)1浙白术0.1750.0961.8221752河北小白术0.2400.1301.8432403湖南平术0.1210.0661.8351214安徽徽术0.2370.1271.861237
以四种白术基因组DNA为模板,逐一使用10条随机引物进行PCR扩增.湖南平术和安徽徽术在10 种随机引物结合下的PCR扩增结果中未发现特异性片段.S9(5′-3′:TGGGGGACTC)和S10(5′-3′:CTGCTGGGAC)结合下的PCR扩增图谱中发现了浙白术和河北小白术的特异性扩增条带(图3,4).如图3所示,S9结合下的PCR扩增结果中,浙白术在550 bp左右(箭头所示处)出现了一条扩增条带,这条条带只在浙白术品种中出现,在其他三个白术中不存在,因此,550 bp处的浙白术扩增条带可以作为浙白术SCAR标记,命名为ZBZ.如图4所示,S10结合下的PCR扩增结果中,河北小白术在800 bp(箭头所示处)位置出现了一条扩增条带,这条条带只在河北小白术品种中出现,在其他三个白术中不存在,因此,800 bp处的河北小白术扩增条带可以作为河北小白术SCAR标记,命名为HBZ.ZBZ和HBZ分子量大小适中,条带清晰明亮,是质量较佳的SCAR标记。
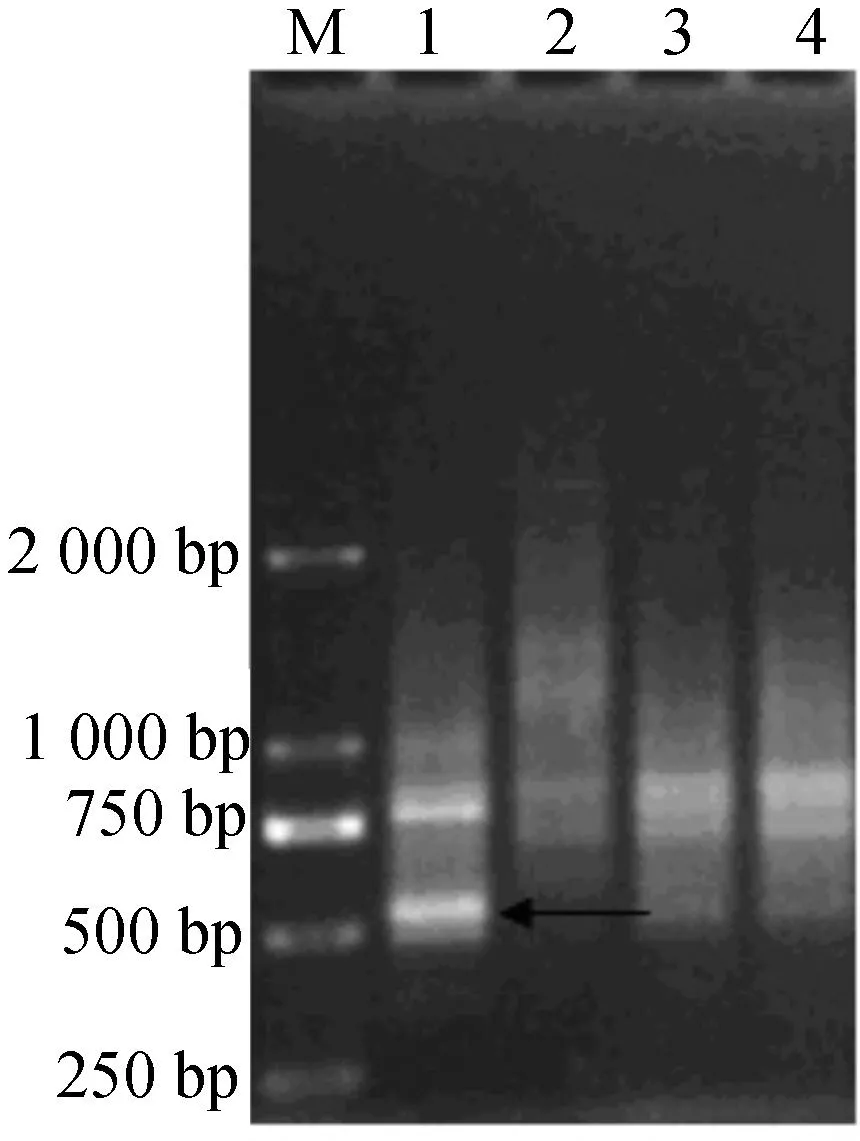
M—Marker;1—以浙白术基因组DNA为模板的扩增结果;2—以河北小白术基因组DNA为模板的扩增结果;3—以湖南平术基因组DNA为模板的扩增结果;4—以安徽徽术基因组DNA为模板的扩增结果图3 引物S9的PCR扩增图Fig.3 PCR products by S9

M—Marker;1—以浙白术基因组DNA为模板的扩增结果;2—以河北小白术基因组DNA为模板扩增结果;3—以湖南平术基因组DNA为模板的扩增结果;4—以安徽徽术基因组DNA为模板的扩增结果图4 引物S10的PCR扩增图Fig.4 PCR products by S10
2.3白术SCAR分子标记的回收
用刀片将浙白术和小白术的SCAR标记从凝胶中小心切下来,两个SCAR标记分子经胶回收试剂盒回收后进行凝胶电泳分析,实验结果见图5.从图5可见:第一泳道在800 bp处出现一条条带,分子量大小与小白术SCAR标记一致;第二泳道在550 bp出现一条条带,分子量大小与浙白术SCAR标记一致.两条回收条带清晰明亮,说明浙白术和小白术的SCAR标记分子已经被成功回收。

M—Marker;1—河北小白术SCAR分子标记的回收结果;2—白术SCAR分子标记的回收结果图5 白术SCAR分子标记的回收电泳图Fig.5 SCAR recycling of Atractylodes macrocephaLa Koidzs
2.4SCAR分子标记的克隆
将回收获得的浙白术和小白术SCAR分子标记分别与T-载体pUCm-T连接,筛选出阳性克隆子.使用PCR方法对阳性克隆进行鉴定,获得重组质粒.重组质粒的PCR鉴定结果见图6,7.在图6中,第一泳道为含有小白术SCAR标记的重组质粒A,第二泳道为以重组质粒A为模板,S10引物结合下的PCR扩增结果,在800 bp处可见一条扩增条带,分子大小与小白术SCAR标记一致,条带清晰明亮,无杂带出现,说明小白术SCAR标记HBZ已成功插入pUCm-T载体中.在图7中,第一泳道为含有浙白术SCAR标记的重组质粒B,第二泳道为以重组质粒B为模板,S9引物结合下的PCR扩增结果,在600 bp处可见一条扩增条带,分子大小与浙白术SCAR标记一致,条带清晰明亮,无杂带出现,说明浙白术SCAR标记ZBZ已成功插入pUCm-T载体中.重组质粒A和B在胶中均显示出三条条带,从上至下分别代表开环DNA,线性DNA,超螺旋DNA,说明重组质粒质量较好,可以为后续的测序和设计引物工作打下基础,为最终实现白术分子鉴定创造条件。

M—Marker;1—重组质粒A;2—重组质粒A以S10为引物的PCR扩增结果图6 重组质粒及以S10为引物的PCR扩增图Fig.6 Recombinant plasmid and PCR product by S10
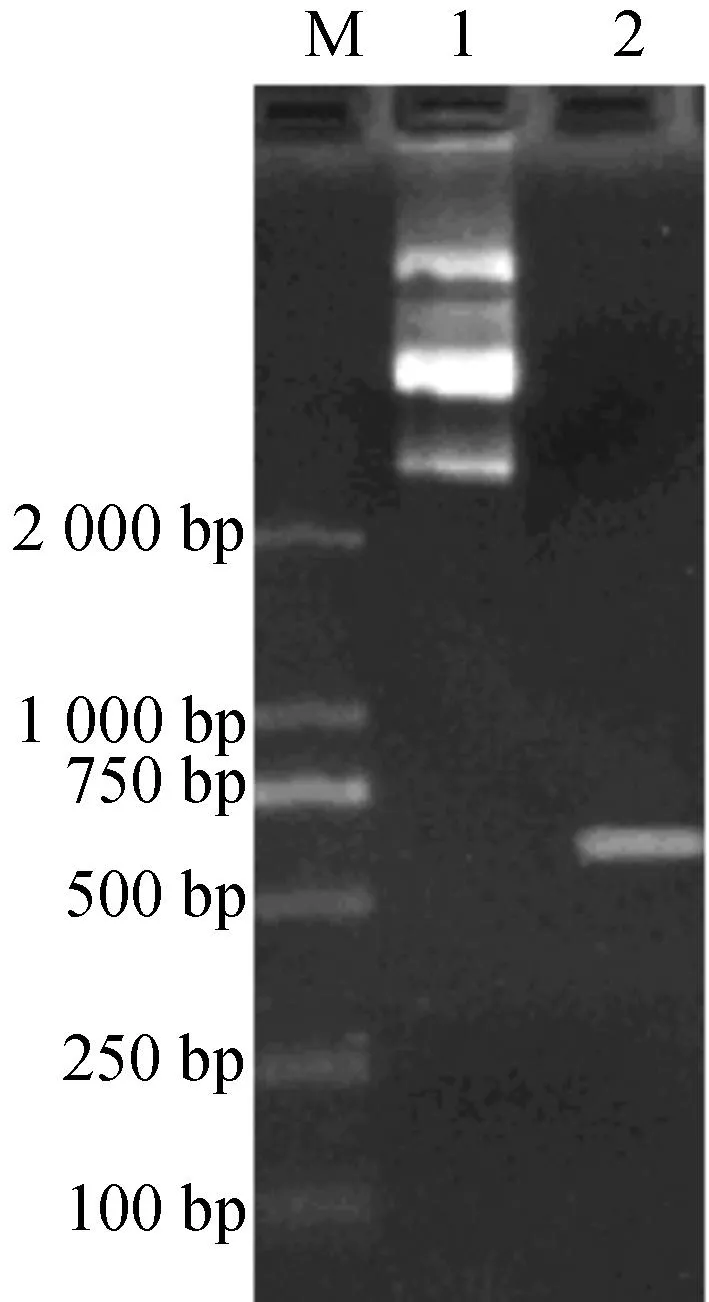
M—Marker;1—重组质粒B;2—重组质粒B以S9为引物的PCR扩增结果图7 重组质粒及以S9为引物的PCR扩增图Fig.7 Recombinant plasmid and PCR product by S9
3结论
通过随机引物结合下的PCR技术对四种不同产地白术进行SCAR分子标记的筛选,成功获得了河北小白术SCAR分子标记HBZ和浙白术SCAR分子标记ZBZ.将HBZ和ZBZ回收并插入至克隆载体pUCm-T vector后得到的重组质粒通过PCR方法实现了鉴定,具有操作简单,结果可靠等优点.安徽徽术和湖南平术尚未获得理想的SCAR标记,今后拟选取更多的随机引物,以期筛选得到SCAR标记.这两个品种未能获得SCAR也提示它们的亲缘性可能较接近,基因相似度较高,因此要获得SCAR标记难度较大.目前,河北小白术和浙白术SCAR分子标记的序列测定及分析工作正在进行中.实验成果为最终建立白术特异性PCR分子鉴定方法打下了基础,也为其他中药品种的SCAR标记研究提供了参考。
参考文献:
[1]国家药典委员会.中国人民共和国药典:第一卷[S].北京:化学工业出版社,2010:95。
[2]王宗宽,曹炜,夏强强,等.白术不同居群亲缘关系RAPD分析[J].安徽林业科技,2011,37(1):14-17。
[3]郭辉,高帅,张祎,等.15种竹叶中碳苷黄酮的含量研究[J].浙江工业大学学报,2014,42(1):37-44。
[4]LU K T, LEE H C, LIU F C, et al. Discriminating astragali radix from hedysarum radix in Chinese medicine preparations using nested PCR and DNA sequencing methods[J]. Journal of Food and Drug Analysis,2009,17(5):380-385。
[5]HUH M K, BANG, K H. Identification of atractylodes Japonica and a-macrocephala by RAPD analysis and SCAR markers[J]. Silvae Genetica,2006,55(3):101-105。
[6]蒋超,张雅华,陈敏,等.基于双向位点特异性PCR的金银花真伪鉴别方法研究[J].中国中药杂志,2012,37(24):3752-3757。
[7]龙平,崔占虎,李虔全,等.基于位点特异性PCR的黄芪与红芪鉴别方法研究[J].中国中药杂志,2013,38(16):2561-2585。
[8]孙靓,郑玉光,袁媛,等.白术遗传多样性ISSR分析[J].中国中药杂志,2012,37(22):3381-3385。
[9]李翼飞,赵月萍,沈青,等.白术不同性状RAPD标记[J].江苏林业科技,2011,38(5):17-19
[10]朱振洪,刘文洪,余勤,等.四种不同产地白术的DNA随机扩增多态性研究[J].浙江中医药大学学报,2011,35(4):575-577。
[11]李敏,赵欣.三种南方贝母RAPD的分析[J].浙江工业大学学报,2012,40(6):634-639。
[12]夏铭,栾非时,李景鹏.RAPD影响因素的研究及实验条件的优化进[J].植物研究,19(2):195-200。
[13]李敏,黄龙妹,陈强.RAPD技术筛选麦冬分子鉴定标记的研究[J].浙江工业大学学报,2014,42(5):504-508。
[14]李敏,黄龙妹,赵欣,等.浙贝母特异性PCR鉴定方法研究[J].中草药,2014,45(12):1754-1757。
(责任编辑:陈石平)
中图分类号:R282.5
文献标志码:A
文章编号:1006-4303(2015)02-0148-06
作者简介:李敏(1975—)女,浙江杭州人,副教授,博士,主要从事中药和肿瘤标志物分子鉴定的研究,E-mail:limin@zjut.edu.cn。
收稿日期:2014-11-06

