黄连多糖不同组分抗氧化活性比较研究
李 云,王 炜,尹登科,高向东
(1.安徽中医药大学药学院,安徽 合肥 230012;2.中国药科大学生命科学与技术学院,江苏 南京 210009)
黄连多糖不同组分抗氧化活性比较研究
李云1,王炜1,尹登科1,高向东2
(1.安徽中医药大学药学院,安徽 合肥230012;2.中国药科大学生命科学与技术学院,江苏 南京210009)
[摘要]目的研究黄连粗多糖和带电量不同的黄连多糖组分的抗氧化活性。方法用二乙氨乙基纤维素(阴离子交换柱层析)分离纯化除蛋白后的黄连粗多糖,用Fenton法、邻苯三酚自氧化法和2,2-二苯基-1-苦味肼基(2,2-diphenyl-1-picrylhydrazyl,DPPH)分析法测定黄连粗多糖及纯化后带电量不同的多糖组分体外抗氧化作用。结果经阴离子交换柱层析,可获得4种带电量不同的黄连多糖组分,且这4种组分和黄连粗多糖对羟自由基、超氧阴离子和DPPH都有一定的清除作用,其中带电量高的组分对不同抗氧化模型均具有较高的清除作用。结论黄连多糖有一定的抗氧化活性,其抗氧化活性和其带电量具有正相关性。
[关键词]黄连多糖;抗氧化活性;羟自由基;超氧阴离子;DPPH
自由基是外层轨道含有未配对电子的基团,其化学性质活泼,且种类多,破坏性极强[1]。
自由基诱导的氧化反应是导致生物衰老和人体多种疾病的主要起因之一[2]。人体内以氧形成的自由基最为重要,包括羟自由基、超氧阴离子和H2O2等,统称为活性氧自由基。尽管机体存在氧化防御和修复机制,但并不能完全有效地阻止过量自由基造成的机体损伤,因此补充外源抗氧化剂就显得十分必要。然而许多合成抗氧化剂存在诸多的安全问题,所以天然抗氧化剂的研究与开发引起人们的广泛关注。
多糖是由单糖连接而成的多聚物,广泛存在于动物细胞和植物、微生物的细胞壁中,对多糖的研究可追溯到1936年Shear对多糖抗肿瘤活性的发现,至1950年代,陆续发现了一些真菌多糖和高等植物多糖具有明显抑瘤活性[3]。除此之外,近年来发现许多植物多糖还具有免疫调节、降血脂、降血糖等生物活性[4],而且对机体几乎无毒性及不良反应,这些作用与多糖的抗氧化活性密不可分,而抗氧化是多糖最重要的生物活性之一。因此,对多糖的研究日益受到国内外研究者的关注。近年来,国内外学者就多糖抗氧化活性作了大量的研究工作[5-6]。
黄连为毛茛科植物黄连CoptischinensisFranch.,三角叶黄连CoptisdeltoideaC.Y. Cheng et Hsiao或云连CoptisteetaWall.的干燥根茎,具有清热燥湿、泻火解毒的作用,最早记载于东汉《神农本草经》,并列于上品[7]。随着对黄连研究越来越深入,研究表明多糖成分可能是黄连发挥药效的成分之一。相关文献报道黄连多糖(Coptischinensispolysaccharide,CCP)具有较好的降糖活性[8]和清除自由基的作用[9],还可能是黄连治疗糖尿病的有效成分之一。因此,为了更好地开发黄连,探讨带电量不同CCP的生物活性,本实验将对CCP提取分离纯化,并研究黄连粗多糖和带电量不同的CCP抗氧化活性。
1材料
1.1药物与试剂黄连采于四川省峨眉山,经鉴定为毛茛科黄连属植物味连CoptischinensisFranch.的干燥根茎。二乙氨乙基(diethylaminoethyl,DEAE)-纤维素和番红花红:安徽省合肥博美生物科技有限公司;抗坏血酸:国药集团化学试剂有限公司;2,2-二苯基-1-三硝基苯肼(2,2-diphenyl-1-picrylhydrazyl,DPPH):上海梯希爱化成工业发展有限公司;乙二胺四乙酸二钠(ethylenediamine tetraacetic acid disodium salt,EDTA-Na2):上海苏懿化学试剂有限公司;FeSO4:江苏徐州试剂二厂;其余试剂均为国产分析纯。
1.2主要仪器BSZ-100自动部分收集器:上海青浦沪西仪器厂;紫外可见分光光度计UV757CRT:上海精科科学有限公司;HL-2恒流泵:上海嘉鹏科技有限公司;AB135-S型电子分析天平:德国METTLER TOLEDO公司;DZF-200型真空干燥箱:上海浦东荣丰科学仪器有限公司;离心机:湖南湘仪实验仪器开发有限公司。
2方法
2.1CCP不同组分的制备黄连粗粉(20目)100 g,加入7 000 mL水,80 ℃提取3次,每次1.5 h,合并3次滤液,减压浓缩至相当于生药0.5 g/mL,加入无水乙醇使醇沉浓度为80%沉淀多糖,4 ℃放置过夜,抽滤,用无水乙醇反复洗涤沉淀,挥至无醇味[10]。真空干燥后即得黄连粗多糖。按Sevage法[11]配制比例(提取液∶氯仿∶正丁醇=25∶5∶1)得到混合液。振动20 min后,于6 000 r/min离心5 min,静置分层,弃去有机层。依此法除5次蛋白。加无水乙醇沉淀得CCP。用DEAE-纤维素色谱柱[12]将再次溶解的多糖进行分离纯化,经透析冻干后,获得带电量不同的4种CCP组分,分别命名为CCP-Ⅰ、CCP-Ⅱ、CCP-Ⅲ、CCP-Ⅳ。
2.2体外抗氧化活性分析
2.2.1清除羟自由基作用测定采用Fenton法[13]检测CCP对羟自由基的清除作用。将不同的多糖组分和除蛋白后的粗多糖配制成100 μg/mL的溶液,作为供试液;并配制相同浓度的维生素C(Vitamin C,Vit C),作为阳性对照。试管中依次加入100 μg/mL番红花红1 mL;0.2 mol/L pH 7.4磷酸盐缓冲溶液(phosphate buffer saline,PBS)1 mL;100 μg/mL供试液1 mL;0.3% H2O21 mL;0.15 mol/L EDTA-Fe2+1 mL;混匀后,37 ℃水浴反应30 min。以蒸馏水为阴性空白,并测定554 nm吸光度,计算清除率(ability of eliminating,E)。
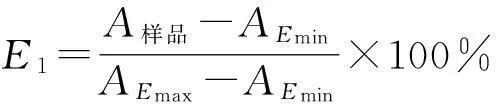
式中Emin为以水代替供试液,Emax为以水代替供试液和EDTA-Fe2+。
2.2.2清除超氧阴离子作用测定采用改良的邻苯三酚自氧化法[14]。将不同的多糖组分和除蛋白后的粗多糖配制成100 μg/mL的溶液,作为供试液;并配制相同浓度的VitC,作为阳性对照。试管中依次加入100 μg/mL供试液4 mL和pH 8.2的0.05 mol/L Tris-HCl 4 mL,37 ℃水浴反应10 min后,加入40 mmol/L邻苯三酚-盐酸溶液1 mL,混匀后,37 ℃水浴反应4 min,立即用1 mL 6 mol/L HCl终止反应。以蒸馏水为阴性空白,并测定318 nm吸光度,计算清除率。
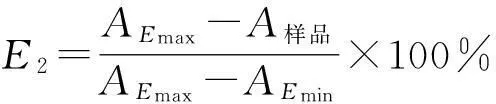
式中Emin为以水代替供试液和Tris-HCl,Emax为以水代替供试液。
2.2.3清除DPPH能力测定根据Kao TH等[15]的方法检测CCP对DPPH的清除能力。将不同的多糖组分和除蛋白后的粗多糖配制成100 μg/mL的溶液,作为供试液;并配制相同浓度的Vit C,作为阳性对照。在棕色容量瓶中加入100 μg/mL供试液3 mL,60 μg/mL DPPH醇溶液2 mL,混匀后,避光,室温下反应30 min。以蒸馏水为阴性空白,并测定527 nm吸光度,计算清除率。

式中Emax为以水代替供试液。
3结果
3.1CCP的分离纯化采用水提醇沉法提取黄连粗多糖,按Sevage法除去粗多糖中蛋白质类杂质。经DEAE纤维素离子交换柱层析,依次以0.02~0.64 mol/L NaCl洗脱,分离得到带电量不同的4个洗脱峰(见图1)。组分峰CCP-Ⅰ、CCP-Ⅱ、CCP-Ⅲ、CCP-Ⅳ分别由0.04、0.08、0.16、0.32 mol/L NaCl溶液洗脱获得,样品经透析袋透析后冻干。
3.2CCP不同组分对羟自由基的清除作用CCP-Ⅰ、CCP-Ⅱ、CCP-Ⅲ和CCP-Ⅳ对羟自由基均有一定的清除作用。同浓度下纯化后的4个组分清除率相比,CCP-Ⅱ对羟自由基的清除作用最强,其次是CCP-Ⅰ、CCP-Ⅳ。见表1。
3.3CCP不同组分对超氧阴离子的清除作用CCP-Ⅰ、CCP-Ⅱ、CCP-Ⅲ和CCP-Ⅳ对超氧阴离子均有较强的清除作用。同浓度下纯化后的4个组分清除率相比,CCP-Ⅰ和CCP-Ⅳ对超氧阴离子的清除作用最强。见表1。
3.4CCP不同组分对DPPH的清除作用CCP-Ⅰ、CCP-Ⅱ、CCP-Ⅲ和CCP-Ⅳ对DPPH均有一定的清除作用。同浓度下纯化后的4个组分清除率相比,CCP-Ⅳ对DPPH的清除作用最强。见表1。
表1 各组羟自由基、超氧阴离子、DPPH清除率比较
注:同列含相同右上标符号的组别相比较,P>0.05;同列不含相同右上标符号的组别相比较,P<0.05。
4讨论
阴离子交换层析是以阴离子交换剂为固定相,依据流动相中组分所含的负电基团与交换剂上平衡离子进行可逆交换时结合力差异而进行分离的一种层析方法。而正电基团和中性基团则不能与离子交换剂结合,随流动相流出而被去除。含有少量负电基团因与离子交换剂的结合力小,先被置换出来,而带负电量多的基团因与离子交换剂结合力强,需要较高的离子强度才能被置换出来,这样各种负电基团就会按其与离子交换剂结合力从小到大的顺序逐步被洗脱下来,从而达到分离目的。本实验根据这个原理,分离得到带电量不同的4种CCP组分。
羟自由基是新陈代谢过程中产生的,对生物体毒性强、危害大的一种自由基,能与活细胞生物膜发生反应,引起氧化性损伤和破坏,导致细胞坏死或突变,衰老、肿瘤等疾病均与羟自由基密切相关。所以,筛选清除羟自由基的天然抗氧化剂具有重要的实际意义[16]。羟自由基可由EDTA-Fe-H2O2产生,且羟自由基可特异性地使番红花红T褪色,褪色程度可以衡量羟自由基生成量,据此原理可评价CCP不同组分对羟自由基的清除作用。实验结果表明黄连粗多糖和纯化后4组带电量不同的CCP对羟自由基均有一定的抑制作用,其中CCP-Ⅱ清除率较强。
超氧阴离子自由基活性强,不仅可以导致细胞内DNA损伤,而且还是很多活性游离基的前体。在体外它可通过邻苯三酚在碱性条件下发生自氧化产生、释放出超氧阴离子,并生成有色中间产物,生成的中间产物在紫外区有吸收[17]。而CCP可以和超氧阴离子结合形成稳态自由基,终止自由基链反应,抑制超氧阴离子的形成,通过检测有色中间物的生成量,判定多糖的清除能力,而发挥抗氧化作用[18]。本研究结果表明黄连粗多糖和纯化后4组带电量不同的CCP对超氧阴离子均有较强的抑制作用。CCP-Ⅰ和CCP-Ⅳ对超氧阴离子自由基的清除作用最强。
DPPH分析方法是目前广泛使用的评价和筛选抗氧化剂的常用方法。DPPH是一种带有不配对电子的比较稳定的自由基,其N原子上有一个游离电子。由于DPPH的40%乙醇-水溶液在527 nm处有最大吸收峰。加入抗氧化剂后,DPPH捕捉一个电子与游离电子配对,使反应体系在527 nm处的吸收减弱[19]。本研究评价了相同质量浓度CCP对DPPH的清除作用。结果表明黄连粗多糖和纯化后4组带电量不同的CCP对DPPH均有一定的清除作用,CCP-Ⅳ对DPPH的清除作用最强。
本实验采用水提醇沉法提取黄连粗多糖,经阴离子层析柱分离得到带电量不同的4种水溶性多糖组分。通过体外分析法证实黄连粗多糖及纯化后多糖组分对羟自由基、超氧阴离子和DPPH均有一定的清除作用。综合考虑各因素,CCP的抗氧化活性随着带电量增多而增强。本实验结果为CCP在抗氧化和抗衰老功能性食品中的应用开发提供了参考。
参考文献:
[1]刘微微,任虹.天然产物抗氧化活性体外评价方法研究进展[J].食品科学,2010,31(17):415-416.
[2]李建喜,杨志强,王学智.活性氧自由基在动物机体内的生物学作用[J].动物医学进展,2006,27(10):33-36.
[3]舒任庚,蒋跃平,蔡永红.植物多糖的提取分离方法探讨[J].中国药房,2011,22(11):1052-1054.
[4]徐翠莲,杜林洳.多糖的提取、分离、纯化及分析鉴定方法研究[J].河南科学,2009,27(12):1524-1526.
[5]Cui JJ,Yuan JF,Zhang ZQ. Anti-oxidation activity of the crude polysaccharides isolated fromPolygonumcillinerve(Nakai)Ohwi in immunosuppressed mice[J].J Ethnopharmacol,2010,132 (2):512-517.
[6]Luo DH,Fang BH. Structural identification of ginseng polysaccharides and testing of their antioxidant activities[J].Carbohydr Polym,2008,72(3):376-381.
[7]刘芳.黄连品质评价的研究及其应用[D].成都:四川大学,2005:1-7.
[8]吴玉娟.黄连多糖的提取及活性研究[D].成都:西南交通大学,2007:32.
[9]吴玉娟,王懿萍,姜延伟,等.黄连多糖含量测定及抗氧化活性研究[J].时珍国医国药,2008,8(19):1906-1908.
[10]连晓佳.不同实验设计方法对黄芪多糖提取率的研究[J].中外医疗,2009,28(30):190.
[11]夏泉,刘钢,葛朝亮,等.Sevage法去除黄芪粗多糖中蛋白质成分的研究[J].安徽医药,2007,11(12):1069-1070.
[12]张岩,马丽娜.中药多糖的分离纯化方法研究进展[J].天津药学,2011,23(3):72-74.
[13]何战胜,罗虹,曹朝辉,等.灿烂绿光度法检测Fenton反应产生的羟自由基[J].美国中华临床医学杂志,2004,6(3):236-237.
[14]Marklund S,Marklund G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase[J].Eur J Biochem,1974,47(3):469-474.
[15]Kao TH,Chen BH. Functional components in soybean cake and their effects on antioxidant activity[J].J Agric Food Chem,2006,54(20):7544-7555.
[16]Ke CL,Qiao DL,Gan D,et al. Antioxidant activityinvitroandinvivoof the capsule polysaccharides fromStreptococcusequisubsp.zooepidemicus[J]. Carbohydr Polym,2009,75(4):677-682.
[17]许伸鸿,杭瑚,李运平.超氧化物歧化酶邻苯三酚测活法的研究与改进[J].化学通报,2001,64(8):516.
[18]Pan DD,Mei XM. Antioxidant activity of an exopolysaccharide purified fromLactococcuslactissubsp.lactis12[J].Carbohydr Polym,2010,80(3):908-914.
[19]Okusa PN,Penge O,Duez P,et al.Direct and indirect antimicrobial effects and antioxidant activity ofCordiagilletiiDeWild[J]. J Ethnopharmacol,2007,112(3):476-481.
Antioxidant Activities of DifferentCoptischinensisPolysaccharides: A Comparative Study
LIYun1,WANGWei1,YINDeng-ke1,GAOXiang-dong2
(1.SchoolofPharmacy,AnhuiUniversityofChineseMedicine,AnhuiHefei230012,China; 2.SchoolofLifeScienceandTechnology,ChinaPharmaceuticalUniversity,JiangsuNanjing210009,China)
[Abstract]ObjectiveTo study the antioxidant activities of crude Coptis chinensis polysaccharides and Coptis chinensis polysaccharides with different charges. MethodsAfter removal of proteins by Sevage method, the crude polysaccharides were further purified by diethylaminoethyl cellulose column chromatography. The antioxidant activities of crude Coptis chinensis polysaccharides and purified Coptis chinensis polysaccharides with different charges were measured by Fenton method, pyrogallol autoxidation method, and 2,2-diphenyl-1-picrylhydrazyl (DPPH) method. ResultsFour polysaccharides with different charges were obtained after the crude Coptis chinensis polysaccharides were isolated and purified by anion-exchange column chromatography. All components could eliminate some hydroxyl free radicals, superoxide anions, and DPPH. The component with a higher charge had a relatively high antioxidant activity in all test methods. ConclusionCoptis chinensis polysaccharides show certain antioxidant activities, which are positively correlated with their charges.
[Key words]Coptis chinensis polysaccharide; antioxidant activity; hydroxyl free radical; superoxide anion; 2,2-diphenyl-1-picrylhydrazyl
收稿日期:(2014-07-28;编辑:曹健)
通信作者:尹登科,yindengke@sina.com
作者简介:李云(1987-),女,硕士研究生
基金项目:天然药物活性组分与功效国家重点实验室(中国药科大学)项目(SKLNMKF201218);安徽省高校优秀人才基金项目(2011SQRL091)
[中图分类号]R932[DOI]10.3969/j.issn.2095-7246.2015.01.021

