丹皮酚对脂多糖诱导的大鼠血管内皮细胞VCAM-1、TNF-α释放及TLR4/NF-κB信号通路的影响
杨 黎, 戴 敏, 陈 鹏
(安徽中医药大学药学院 省部共建新安医学教育部重点实验室,安徽 合肥 230012)
丹皮酚对脂多糖诱导的大鼠血管内皮细胞VCAM-1、TNF-α释放及TLR4/NF-κB信号通路的影响
杨黎, 戴敏, 陈鹏
(安徽中医药大学药学院省部共建新安医学教育部重点实验室,安徽 合肥230012)
[摘要]目的观察丹皮酚(Paeonol,Pae)对脂多糖(lipopolysaccharide,LPS)诱导的大鼠血管内皮细胞(vascular endothelial cells,VECs)释放血管内皮细胞黏附因子-1(vascular endothelial cell adhesion molecule-1,VCAM-1)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)及Toll样受体-4(toll-like receptor,TLR4)/核因子κB(nuclear factor-kappa B,NF-κB)信号通路的影响,以阐明Pae抑制VECs黏附功能的分子机制。方法组织块预消化贴壁法分离培养VECs,采用LPS诱导VECs炎性损伤;健康大鼠灌胃给予Pae制备含药血清,反相高效液相色谱法测定血清Pae的含量;RT-PCR法检测TLR4 mRNA的表达;凝胶迁移试验检测NF-κB蛋白的表达;免疫组织化学检测VCAM-1的表达;放射免疫法检测TNF-α的表达。结果Pae含药血清(2.5,5,10 μg/mL)作用于LPS诱导的VECs 24 h,可抑制VECs中TLR4 mRNA和NF-κB蛋白表达,以及VCAM-1和TNF-α分泌,呈现一定的剂量依赖性,其中Pae 10 μg/mL的抑制作用均具有统计学意义(P<0.05)。结论Pae降低TNF-α的释放和VCAM-1水平,可能是通过下调LPS诱导的TLR4/NF-κB信号通路的活化而实现的。
[关键词]丹皮酚;血管内皮细胞;脂多糖;TLR4/NF-κB信号通路;VCAM-1;TNF-α
炎性反应贯穿于动脉粥样硬化(atherosclerosis,AS)发生发展的全过程[1-2],血管内皮细胞(vascular endothelial cells,VECs)因炎性损伤而引起与单核细胞的黏附在其中扮演着重要的角色[3-4]。微生物感染作为AS的一种诱发因素受到了越来越多的重视,脂多糖(lipopolysaccharide,LPS)是革兰阴性菌外膜成分之一,是一种强烈的炎症启动因子,能与血浆中LPS结合蛋白结合成复合物,运载至靶细胞,与靶细胞膜上的跨膜受体Toll样受体4(toll-like receptor,TLR4)结合,继而活化核因子κB(nuclear factor-kappa B,NF-κB),可导致一系列细胞因子和黏附分子的释放,引起VECs的炎性损伤并促进与单核细胞的黏附,引发AS的病理生理改变[5]。
丹皮酚(Paeonol,Pae)是毛茛科植物牡丹PaeoniaSuffruticoasAndr.的干燥根皮及萝摩科植物徐长卿Cynanchumpaniculatum(Bge.)Kitag.的干燥根及根茎中的有效成分之一。本课题组前期研究[6]发现,Pae含药血清具有显著抗炎作用及抑制VECs的黏附功能,然而Pae对LPS诱导的黏附功能改变是否与对TLR4的表达有关?从而影响了LPS诱导VECs的NF-κB信号通路?调控肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的内源性释放和黏附分子的表达?通过对以上问题的分析有助于进一步确认Pae对LPS诱导的VECs炎性反应的调节位点,为Pae抗AS作用的炎症机制提供依据。
1材料
1.1实验动物健康Sprague-Dawley(SD)大鼠,清洁级,雄性,体质量(160±10)g,安徽医科大学动物实验中心提供,生产许可证号:SCXK(皖)2011-0015。
1.2药物及试剂Pae:安徽省宣城百草植物工贸有限公司,纯度99%,批号 050321,用β-环糊精(中国医药集团上海试剂公司)包合为Pae β-环糊精包合物,用0.5%羧甲基纤维素钠(sodium carboxymethyl cellulose,CMC-Na)配制成混悬液灌胃用;特级胎牛血清(fetal bovine serum,FBS):天津市灏洋生物制品科技责任有限公司,批号 080705c199;LPS:美国Sigma公司,批号 080214;肝素钠:江苏万邦生化医药股份有限公司,批号 0802114;核蛋白提取试剂盒、凝胶迁移试验(electrophoretic mobility shift assay, EMSA)试剂盒、超敏感底物发光试剂盒:美国Pierce公司;链霉亲合素-过氧化酶(streptavidin peroxidase, SP)免疫组织化学试剂盒、二氨基联苯胺(diaminobenzidine, DAB)显色试剂盒:北京中杉生物技术有限公司;TNF-α放射免疫分析试剂盒:北京普尔伟业生物科技有限公司;血管内皮细胞黏附因子-1(vascular endothelial cell adhesion molecule-1,VCAM-1)单克隆抗体:武汉博士德生物工程有限公司;乙二胺四乙酸(ethylenediamine tetraacetic acid, EDTA)、NaCl、KCl、Na2HPO4·12H2O、KH2PO4、Tween-20、乙酸、盐酸和甲醇均为分析纯:上海试剂一厂和上海试剂四厂。
1.3主要仪器CO2培养箱:日本Sanyo公司;洁净工作台:苏净集团安泰公司;Hoefer电泳仪:Amersham Biosciences公司;PCR仪:Biometra TGRADIENT公司;低温高速离心机:德国EPPENDORF公司;凝胶成像系统:意大利Bio-Rad公司;DYY-10 ECP 3000电泳仪:北京六一仪器厂;EL301 strip reader:美国Bio-Tek公司;GSM凝胶图像分析管理系统:黑马仪器公司。
2方法
2.1Pae含药血清的制备[7-8]SD大鼠6只,随机分成空白血清组3只与Pae β-环糊精包合物给药组(400 mg/kg)3只。灌胃给药,每日2次,连续3 d,空白组给予相同容积的溶剂(0.5% CMC-Na)。末次给药后30 min(末次给药前禁食不禁水12 h),采用3.5%水合氯醛麻醉,从腹主动脉取血。室温静置2 h,3 500 r/min离心10 min,无菌条件下分离血清,同种条件血清混匀,56 ℃水浴灭活30 min,0.22 μm微孔滤膜过滤除菌后分装,-20 ℃避光保存备用。RP-HPLC测定含药血清中Pae含量。方法参见课题组前期研究[5]进行。
2.2大鼠主动脉VECs的分离、培养与鉴定
2.2.1鼠尾胶原的制备及培养瓶包被取大鼠1只,全尾剪下并置于75%乙醇溶液中浸泡30 min,无菌条件下抽出尾腱,灭菌三蒸水洗3次,剪碎尾腱,放入100 mL 0.1%乙酸溶液中,置4 ℃冰箱中,不时摇晃,48 h后无菌条件下移入灭菌离心管中,4 000 r/min离心30 min,吸取无色透明胶状上清液,分装,-20 ℃冷冻保存。取培养瓶,无菌条件下加入鼠尾胶原溶液2 mL使其覆盖于培养瓶底部,置于37 ℃、5% CO2培养箱中培养1 h,吸弃多余液体,磷酸盐缓冲液(phosphate buffered saline,PBS)轻洗3次,再用2 mL含有20% FBS和105U/L肝素钠的达尔伯克氏改良伊格尔培养基(Dulbecco’s modified Eagle’s medium, DMEM)漂洗1次即可。
2.2.2大鼠主动脉VECs的分离、培养与鉴定[9]大鼠颈椎脱臼处死,无菌条件下取出胸主动脉,剥离干净血管外结缔组织及脂肪组织,外翻血管,暴露内膜,用灭菌线扎紧血管两端,放入装有0.2% Ⅰ型胶原酶的离心管中,37 ℃、5% CO2消化培养1 h,含20% FBS的DMEM漂洗2次,剪去封口的两端,余下主动脉血管剪成约2 mm×2 mm小块,内膜朝下贴入鼠尾胶原包被的培养瓶中,并加入1 mL含20% FBS的DMEM,37 ℃、5% CO2培养。当原代细胞爬出并生长融合形成致密的单层细胞时即可传代。免疫细胞化学SP法鉴定血管内皮细胞。
2.3LPS诱导大鼠VECs损伤模型分组取3~5代VECs接种于6孔板中,待其融合至80%左右,换入含0.5% FBS的培养液同步化24 h,继而加入含不同浓度(2.5、5、10 μg/mL)Pae含药血清的培养液(20% FBS)培养24 h。另设空白组和单加LPS组,相同处理。
2.4RT-PCR检测TLR4 mRNA表达将VECs经“2.3”项分组处理后,再加入LPS(终浓度为10 ng/mL)培养5 h后,除去旧培养基,用PBS漂洗后,加入TRIzol试剂完全裂解细胞,收集细胞裂解液至无RNA酶的EP管中,用氯仿抽提,异丙醇沉淀,离心静置,回收总RNA于-80 ℃储存备用。紫外分光光度计鉴定浓度和纯度(测定A260/A280比值)。cDNA合成条件:50 ℃下30 min,99 ℃下5 min,-20 ℃保存备用。TLR4引物序列(508 bp):上游为5′-TGGATACGTTTCCTTATAAG-3′,下游为5′-GAAATGGAGGCACCCCTTC-3′;内参β-actin引物序列(318 bp):上游为5′-ATCATGTTTGAGACCTTCAACA-3′,下游为5′-CATCTCTTGCTCGAAGTCCA-3′。PCR反应条件:94 ℃预变性5 min,94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃延伸10 min,4 ℃保存。2%琼脂糖凝胶电泳,于凝胶成像系统下观察分析。
2.5ESMA检测NF-κB的表达将VECs经“2.3”项分组处理后,再加入LPS(终浓度为10 ng/mL)培养1 h后,除去旧培养基,PBS漂洗3次,按核蛋白抽提试剂说明书抽提核蛋白,抽提后的核蛋白保存在-80 ℃下备用。Lowry法蛋白定量后,将蛋白质浓度调整为一致。利用EMSA法进行NF-κB的检测,并通过GSM凝胶图像分析管理系统分析结果。
2.6免疫组化检测VCAM-1的表达将洗净灭菌的盖玻片置于6孔板中,调整细胞数为1×105/mL,加入含不同浓度(2.5,5,10 μg/mL)Pae含药血清的培养液培养24 h,再加入LPS(终浓度为10 ng/mL)继续培养5 h,另设空白组和单加LPS组,相同处理。免疫组织化学鉴定VECs胞浆内VCAM-1的表达,对照组用PBS代替一抗。结果判定:以细胞核呈黄色或棕黄色者为VCAM-1表达阳性细胞,在100倍镜下随机选取10个视野,分别计算每个视野VCAM-1表达阳性细胞百分率(I)并予赋值:0表示无阳性或非常弱阳性,1表示I<25%,2表示25%≤I<50%,3表示50%≤I<75%,4表示75%≤I<100%,以10个视野的平均赋值作为该样本的检测值。
2.7放射免疫法检测血清TNF-α的含量将VECs经“2.3”项分组处理后,再加入LPS(终浓度为10 ng/mL)培养5 h后,吸取细胞上清液,按照放射免疫法试剂盒说明书操作,定量检测细胞上清液中TNF-α。用TNF-α抗血清及125I-TNF-α加在一起进行竞争性结合反应,采用自动放射免疫仪测定并计算TNF-α浓度。
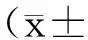
3结果
3.1大鼠血清中Pae的含量本实验所用含药血清与课题组前期所用含药血清为同一批次,参见课题组前期研究[6]方法测得血清中Pae含量10.37 mg/L。
3.2VECs形态学观察及鉴定原代培养的VECs呈多角形单层铺路石样,排列紧密,细胞边缘光滑,胞核清晰(见图1A)。免疫细胞化学SP法检查Ⅷ因子相关抗原,镜下细胞胞浆呈棕黄色,即呈阳性反应,证明所培养细胞为内皮细胞(见图1B)。
图1VECs原代形态学观察及免疫组化鉴定结果
3.3Pae对LPS诱导的VECs表达TLR4 mRNA的影响LPS显著上调了VECs中TLR4 mRNA的表达(P<0.05);Pae作用VECs后,下调了由LPS诱导的TLR4 mRNA表达水平,尤以10 μg/mL Pae组作用最为显著(P<0.05)。见图2、图3。
3.4Pae对LPS诱导的VECs表达NF-κB的影响LPS显著上调VECs中NF-κB的表达水平(P<0.05);Pae作用VECs后,下调了由LPS诱导的NF-κB表达水平,尤以10 μg/mL Pae组的作用最为显著(P<0.05)。见图4、图5。
注:M:Marker;1.空白组;2. 10 ng/mL LPS组;3. LPS+2.5 μg/mL Pae组;4. LPS+5 μg/mL Pae组;5. LPS+10 μg/mL Pae组。
图2Pae对LPS诱导的VECs
表达TLR4 mRNA的影响(RT-PCR法)
注:含有相同右上标符号的组别相比较,P>0.05;不含相同右上标符号的组别相比较,P<0.05。
图3Pae对LPS诱导的VECs
表达TLR4 mRNA的影响(n=5)
注:1. 空白组;2. 10 ng/mL LPS组;3. LPS+2.5 μg/mL Pae组;4. LPS+5 μg/mL Pae组;5. LPS+10 μg/mL Pae组。
图4Pae对LPS诱导的VECs
表达NF-κB的影响(EMSA法)
3.5Pae对LPS诱导的VECs表达VCAM-1的影响经DAB免疫组织化学染色,可见阳性细胞胞核呈淡棕色、细胞核内有棕黄色颗粒,VCAM-1阳性率随Pae含药血清浓度的升高而下降,而且核染色呈棕黄色的细胞数也明显减少。表明LPS可以使VECs表达VCAM-1的阳性细胞数增加,而Pae含药血清可以抑制VCAM-1阳性细胞数的增加。见图6、图7。
3.6Pae对LPS诱导的VECs分泌TNF-α的影响LPS显著上调TNF-α的表达(P<0.05);Pae作用VECs后,显著下调了由LPS诱导的TNF-α表达,尤以10 μg/mL Pae组的作用最为显著(P<0.05)。见图8。
注:含有相同右上标符号的组别相比较,P>0.05;不含相同右上标符号的组别相比较,P<0.05。
图5 Pae对LPS诱导的VECs表达NF-κB的影响(n=5)
图6Pae对LPS诱导的VECs
表达VCAM-1的影响(DAB染色,10×10倍)
4讨论
VECs内衬于血管内壁,发挥着屏障保护作用,也是机体内最大的内分泌腺,能够分泌各种细胞炎性因子、黏附分子等血管活性物质,是多种血管性疾病的关键参与者,VECs的损伤及功能障碍被认为是AS形成的始动因素[10]。当刺激因子作用于VECs导致损伤,VECs出现黏附功能障碍,单核细胞向VECs聚集和黏附是AS炎性反应的早期表现之一。正常情况下的单核细胞难以与VECs黏附,当某些刺激因素介导损伤时才易发生。LPS与VECs上受体结合,诱导细胞黏附因子、炎性因子等在VECs细胞表面表达上升,引起间接损伤,促使单核细胞的黏附及炎症的发生、发展。
注:含有相同右上标符号的组别相比较,P>0.05;不含相同右上标符号的组别相比较,P<0.05。
图7Pae对LPS诱导的VECs
表达VCAM-1的影响(n=5)
注:含有相同右上标符号的组别相比较,P>0.05;不含相同右上标符号的组别相比较,P<0.05。
图8Pae对LPS诱导的VECs分泌TNF-α的影响(n=5)
研究表明,LPS作为炎性刺激因子,可与髓样分化蛋白-2(myeloid differential protein-2, MD-2)蛋白结合形成紧密复合物,使得TLR4激活。TLR4受体是介导炎性反应的跨膜受体,是介导LPS的门户蛋白,当TLR4与相应配体结合,发出相关传递信号,会激活NF-κB信号通路传导级联。NF-κB是细胞炎性反应中许多基因转录活化的必需因子,在炎性反应中具有关键和核心的调控作用,能促进相应细胞因子基因表达上调,如TNF-α、VCAM-1[11]。VCAM-1大量表达会促进单核细胞向内皮细胞黏附、迁移,在进展期促进已迁入病灶的单核细胞滚动、T淋巴细胞的激活,并增加其他细胞与细胞间的相互作用,促进AS的发生发展。TNF-α可刺激VECs上调表达VCAM-1和细胞间黏附分子-1(ntercellular adhesion molecule 1,ICAM-1),导致内皮细胞和白细胞黏附,白细胞迁移、粒细胞脱颗粒和毛细血管通透性增强,并迁移至炎症部位,引起VECs损伤并诱导IL-1、IL-6、IL-8等细胞因子释放,使中性粒细胞趋化,细胞变形,促进炎性反应,造成VECs损伤。
本研究以LPS作为刺激因子诱导VECs损伤,发现LPS可上调TLR4 mRNA的表达,并活化NF-κB信号通路,引起TNF-α和VCAM-1的释放;而Pae可以下调LPS诱导TLR4 mRNA的过表达,降低NF-κB信号通路的活化、降低TNF-α和VCAM-1的释放。该结果提示,Pae可能通过部分抑制TLR4与LPS在细胞膜上的结合,减少LPS进入胞浆内诱导信号的传递,降低NF-κB的活化,从“外层”保护VECs。Pae对TNF-α的释放和VCAM-1基因的转录的抑制表明,Pae下调TLR4/NF-κB信号通路可引起下游细胞因子和黏附分子释放减少;而TNF-α和VCAM-1水平的降低是影响VECs损伤及其与单核细胞黏附功能的重要因素。因此,Pae可以抑制单核细胞向VECs的黏附,保护内皮细胞,达到抗AS的作用。
参考文献:
[1]Ross R.Atherosclerosis an inflammatory disease[J].New Engl J Med,1999,340(2):115-119.
[2]褚现明,李冰,安毅,等.炎症与动脉粥样硬化关系研究进展[J].中国分子心脏病学杂志,2010,11(3):184-188.
[3]李丹,李玉洁,杨庆,等.血管内皮功能障碍与动脉粥样硬化研究进展[J].中国实验方剂学杂志,2012,18(8):272-276.
[4]刘雅蓉, 陈君君, 戴敏, 等. 丹皮酚通过 miR-21 介导的 p38MAPK 信号通路下调氧化低密度脂蛋白诱导的大鼠血管内皮细胞肿瘤坏死因子-α 释放[J]. 安徽中医药大学学报, 2014, 33(1): 51-56.
[5]Sugiyama K,Muroi M,Tanamoto K. A novel TLR4-binding peptide that inhibits LPS-induced activation of NF-kappa B andinvivotoxicity[J].Eur J Pharmacol,2008,594(1-3):152-156.
[6]陈君君,戴敏,陈鹏.丹皮酚对脂多糖诱导大鼠血管内皮细胞黏附的影响[J].中药材,2013,36(3):436.
[7]邢国胜,房德敏,周咏梅,等.丹皮酚的制备及药理作用研究进展[J].中草药,2006,37(11): 311-314.
[8]刘建文.药理学实验方法学:新技术与新方法[M].北京:化学工业出版社,2003:258-268.
[9]潘礼龙,戴敏,王伟.大鼠主动脉内皮细胞原代培养的研究[J].中国药理学通报,2007,23(3):410-413.
[10]Davignon J,Ganz P. Role of endothelial dysfunction in atherosclerosis[J].Circulation,2004,109(23 Suppl 1):Ⅲ27-Ⅲ32.
[11]Yan ZQ. Regulation of TLR4 expression is a tale about tail[J].Arterioscler Thromb Vasc Biol,2006,26(12):2582-2584.
·实验研究·
Effects of Paeonol on Lipopolysaccharide-Induced Release of Vascular Endothelial Cell Adhesion Molecule-1 and Tumor Necrosis Factor-Alpha and TLR4/NF-κB Signaling Pathway in Rat Vascular Endothelial Cells
YANGLi,DAIMin,CHENPeng
(KeyLaboratoryofXin’anMedicineJointlySupportedbyMinistryofEducationandAnhuiProvince&SchoolofPharmacy,AnhuiUniversityofChineseMedicine,AnhuiHefei230012,China)
[Abstract]ObjectiveTo observe the effects of paeonol (Pae) on lipopolysaccharide (LPS)-induced release of vascular endothelial cell adhesion molecule-1 (VCAM-1) and tumor necrosis factor-alpha (TNF-α) and toll-like receptor-4 (TLR4)/nuclear factor-kappa B (NF-κB) signaling pathway in rat vascular endothelial cells (VECs) and to reveal the molecular mechanism for inhibition of VECs adhesion by Pae. MethodsRat VECs were isolated by means of tissue predigested adherent method and LPS was used to induce inflammatory injury in VECs. Serum containing Pae was obtained from healthy rats which were given Pae by intragastric administration. Serum level of Pae was determined by reversed-phase high-performance liquid chromatography. The expression of TLR4 mRNA was measured by RT-PCR. The expression of NF-κB was determined by electrophoresis mobility shift assay. The expression of VCAM-1 was determined by immunohistochemistry and the expression of TNF-α was determined by radioimmunoassay. ResultsAfter 24 hours of treatment with Pae-containing serum (2.5 μg/ml, 5 μg/ml, and 10 μg/ml), the expression of NF-κB and TLR4 mRNA and the secretion of VCAM-1 and TNF-α in LPS-treated VECs were inhibited in a dose-dependent manner. Particularly, serum containing 10 μg/ml Pae had a significant inhibitory effect (P<0.05). ConclusionPae reduces the release of VCAM-1 and TNF-α probably through down-regulating the LPS-induced activation of TLR4/NF-κB signaling pathway.
[Key words]paeonol; vascular endothelial cell; lipopolysaccharide; TLR4/NF-κB signaling pathway; vascular endothelial cell adhesion molecule-1; tumor necrosis factor-alpha
收稿日期:(2014-11-10;编辑:曹健)
通信作者:戴敏,daiminliao@163.com
作者简介:杨黎(1990-),男,硕士研究生
基金项目:国家自然科学基金项目(81473386,81274134)
[中图分类号]R285.5[DOI]10.3969/j.issn.2095-7246.2015.01.016

