产丁醇梭菌优化改造的研究进展
曹长海,关 浩,高慧鹏,佟明友,乔 凯,王领民,张 全
(中国石油化工股份有限公司抚顺石油化工研究院,生物燃料及生物化工重点实验室, 辽宁 抚顺 113001)
产丁醇梭菌优化改造的研究进展
曹长海,关 浩,高慧鹏,佟明友,乔 凯,王领民,张 全
(中国石油化工股份有限公司抚顺石油化工研究院,生物燃料及生物化工重点实验室, 辽宁 抚顺 113001)
由于化石燃料资源的紧缺,木质纤维素生物质发酵生产丁醇作为可再生能源的开发备受各国的关注。然而,发酵生产丁醇的工业化进程受限于丁醇产量、产率及比例低等原因。菌种改良无疑是从根本上解决这一问题的重要策略。着重从理化诱变和基因工程两个方面就近年来国内外产丁醇梭菌改造的最新研究成果进行了相关的评述,进一步展望了菌种改造的发展方向。
丁醇;梭菌;理化诱变;基因工程
随着化石燃料的不断消耗以及各国未来对能源供给不足情况的加重,促使人类寻求可再生的能源来代替不可再生的化石燃料。
目前认为,木质纤维素类生物质是世界上最丰富、最廉价的可再生能源[1],使用木质纤维素类生物质的微生物发酵生产乙醇/丁醇是解决能源问题的重要途径之一,因此,其作为重要的生物转化技术逐渐再次受到人们的重视[2,3],各国科研机构和企业开始重新关注生物发酵生产丁醇的研究。
与乙醇相比,乙醇丁醇的热值、辛烷值与汽油相当,蒸汽压低,可与汽油任意比混溶,使用安全性能高;除此之外,丁醇不会腐蚀管道、不易吸水、便于管道运输[4],这些优点使丁醇成为了理想的燃油替代品。另外,丁醇也是一种重要的化工原料,广泛用于各种塑料和橡胶制品的制造,丁醛、丁酸、丁胺和乳酸丁酯等化学品的合成。近年来,随着下游产业的发展,市场需求量直线上升,有数据显示,2013年我国正丁醇的进口量在40万t左右,成为世界上主要的丁醇进口国家之一。
生物发酵生产丁醇的发酵产物为丁醇、丙酮、乙醇,比例为6:3:1。然而,受其生产成本的制约,发酵法与化工合成方法相比较仍缺乏竞争力,主要原因有三:其一,由于丁醇对菌种的毒性,造成发酵液中丁醇的终浓度较低,目前未见丁醇产量超过20 g/L的相关报道;其二,丁醇体积占总溶剂的60%,造成后续溶剂的分离提纯成本高;其三,发酵原料(碳源)成本相对较高。针对以上三个问题,科研工作者提出了对应的策略:改良菌种,提高丁醇耐受性和丁醇产量;改进发酵工艺和溶剂分离工艺,降低发酵成本;以可再生、丰富廉价的木质纤维素为原料水解制可发酵糖。其中菌种的改造最为根本,是发酵法生产丁醇工业化大规模生产最直接和最为关键的一步。
丁醇发酵工业中的菌种一般是梭状芽孢杆菌属(Clostridium),可以分为 4类:丙酮丁醇梭菌(Clostridium acetobutylicum)、拜氏梭菌(Clostridium beijerinckii)、糖乙酸多丁醇梭菌(Clostridium saccharoperbutylacetonicum)及糖丁酸梭状芽孢菌(Clostridium Saccharobutylicum)。其中,丙酮丁醇梭菌和拜氏梭菌是国内外科研工作者研究最为深入、应用最为广泛的两种菌种,近年来大部分菌种的改造研究也是基于这两种菌种展开的。本文从理化诱变、基因工程两方面入手,就近年来国内外产丁醇梭菌菌种改造的最新研究成果进行了相关的评述,并对未来的发展方向提出了展望。
1 理化诱变
1.1 紫外-化学诱变筛选
紫外诱变是一种使用较早、应用广泛、操作简单的诱变方法,诱变最为合适的波长为254 nm。紫外线可以促使DNA与蛋白质的交联,胞嘧啶和尿嘧啶之间的共价连接,从而引起双联结构的扭曲变形,阻碍碱基间的正常配对,从而引起突变。化学诱变是指利用化学诱变剂对菌株进行处理,致使其遗传物质的改变,如DNA的断裂、缺失、修补,或者造成DNA复制的紊乱及DNA交联引起的遗传失效等,常用的化学诱变剂有烷化剂、核酸碱基类似物、亚硝酸、氯化锂、叠氮化钠等。在实际的诱变操作中通常为两种诱变方法的复合使用,弥补由于单因子诱变出现的“热点”饱和现象,减少无增变效应[5],从而获得较高的正突变概率,进一步提高菌种产丁醇的效率。
张丽丽等[6]以Clostridium beijerinckii NCIMB 8052为原始菌株,利用紫外诱变和高丁醇环境驯化相结合的方法,获得一株耐丁醇的高产突变株Clostridium beijerinckii ZL01,与原始菌株8052相比,ZL01对丁醇初始浓度的耐受能力从10g/L提高到11 g/L, 5 L发酵罐分批发酵的丁醇产量从10.34 g/L增加为15.01 g/L,提高了45.16%,溶剂总产量从12.87 g/L增加到19.55 g/L,提高了49.01%。毛绍名等[7]利用紫外线-氯化锂复合诱变技术对原始菌株Clostridium acetobutylicum DSM 1731进行了诱变,获得一株丁醇耐受性和丁醇产量显著提高的突变菌株M6,与原始菌株1731相比,M6发酵丁醇的最高产量达到了16.01 g/L,产量提高了30.4%,溶剂总产量为20.84 g/L,产量提高了21.3%。
1.2 高能脉冲电子束
高能脉冲电子束(high energy pulsed electron , HEPE)具有极高的辐射剂量率,辐射对生物材料的量剂高达 1010Gy/s,能使水辐解产生更多的羟基自由基,从而对DNA产生显著的氧化损伤,造成难以修复的 DNA双链断裂,获得较多的突变菌株[8]。付玉洁等[9]以Clostridium acetobutylicum CICC 8012为出发菌株,采用HEPE对其进行辐射诱变,再用含丁醇的固体培养基对诱变菌株进行胁迫,经过多次诱变和筛选,获得诱变株S10,其丁醇产量为8.32 g/L, 较出发菌株产量提高了10%。
1.3 等离子体
常 压 室 温等 离子 (atmospheric and room temperature plasma, ARTP)是近年来发展起来的一种等离子体源,它基于射频大气压辉光放电 (radio frequency atmospheric-pressure glow discharge, RF APGD),能够在大气压下产生温度在25~40 ℃之间具有高活性离子浓度的等离子体射流,这些活性离子包括处于激发态的氦原子、氧原子、氮原子、OH自由基等。这些活性粒子作用于微生物时,能够改变微生物细胞壁/膜的结构及通透性,并引起基因损伤,进而使微生物基因序列及其代谢网络发生显著变化,最终导致微生物产生突变[10]。Guo等[11]利用APGD技术对菌株 Clostridium beijerinckii NCIMB 8052进行处理,获得诱变菌株Clostridium beijerinckii NCIMB ATR124,在以葡萄糖为碳源的发酵中,丁醇的产量为10.4 g/L、丙酮产量为3.1 g/L、乙醇产量为0.2 g/L,丁醇产量占溶剂总产量的76%,与原始菌株相比提高了7%。此外,该菌株利用木糖/阿拉伯糖为碳源发酵产溶剂的量与单纯以葡萄糖为碳源发酵产溶剂的量相当。Li等[12]同样利用 ARTP对菌株Clostridium acetobutylicum PW 12进行处理,获得丁醇耐受性好,产量高的诱变菌株 ART18,当以木薯淀粉为碳源的发酵中,丁醇的产量为(11.3±0.5)g/L,比PW12的产量提高了31%,通过优化木薯淀粉的浓度、发酵pH以及维生素的添加等因素,丁醇的最高产量可以达到(15.8±0.8) g/L。
2 基因工程
丙酮丁醇梭菌具有复杂的代谢途径,能生成乙酸、丁酸、乙醇、丙酮、丁醇等多种代谢产物,其代谢途径如图1所示[13]。2001年NÖlling等完成了Clostridium acetobutylicum ATCC 824的测序[14]。2007年,美国能源部联合基因组研究所完成了Clostridium beijerinckii NCIMB 8052的测序[15]。由此,丁醇产生菌的基因工程取得了很大的成效。通过基因的过表达、基因敲除、基因重组以及原生质融合等方法,整合优势性状,增加菌种丁醇耐受性、增强丁醇代谢途径,阻断乙酸、丁酸及丙酮的代谢通路,从而提高丁醇的产量和比例。
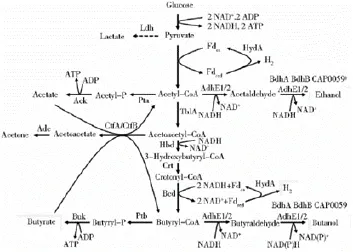
图1 丙酮丁醇梭菌代谢途径[19]Fig.1 Metabolic pathway in Clostridium acetobutylicum[19]
2.1 基因的过表达
丙酮丁醇梭菌的溶剂耐受性与很多伴侣基因有关,如groESL、dnaKJ等。Mann等[16]过表达了groESL、grpE及htpG,显著提高了丙酮丁醇梭菌的丁醇耐受性,野生菌株在体积分数 2%的丁醇中存活无法超过 2h,而基因过表达过的菌株在同样条件下仍有45%存活。丁醇产生途径上的关键酶有AdhE及Bdh A/B,通过提高两者的表达水平,可以提高丁醇的产量。方雪等[17]构建了质粒pTAEE,其中的adhE基因以单交换的方式整合到转化子基因组中,增强了adhE的表达,得到的重组菌T4发酵丁醇得率为41.6%,比野生菌株提高了69%。
2.2 基因敲除
基因敲除是自上世纪 80年代末发展起来的一种新型分子生物学技术,通过一定的途径使机体特定的基因失活或者缺失[18],从而达到对生物遗传物质有目的性的改造,在发酵工业微生物菌种改良种发挥着重要的作用。理论上讲,敲除乙酸支路的Pta、Ack基因,丁酸支路的Buk、Ptb基因以及丙酮支路的Adc、CtfA/CtfB基因均可以使代谢流更多的转向乙酰辅酶A、丁酰辅酶A和乙酰乙酰辅酶A, 从而增强丁醇的代谢流,提高丁醇的产量[19,20]另外,敲除其他的基因同样可以达到提高丁醇产量的目的,Xu等[21]将菌株 Clostridium acetobutylicum ATCC 55025中的 cac3319组氨酸激酶敲除后得到突变菌株Clostridium acetobutylicum JB200,丁醇的产量由(12.6±1.3)g/L增加到了(18.2±0.2)g/L,相比原始菌株提高了44.4%。
2.3 基因重组
与传统的育种相比,基因重组是一种通过DNA重组的方式将优势多母体(multi-partental)基因杂交的方法,是一种较为有效的、向理想表型菌株进化的途径[22]。Gao等[23]以Clostridium acetobutylicum CICC 8012为出发菌株,经过两轮基因重组获得优势菌株F2-GA,发酵72 h,丁醇/丙酮/乙醇总溶剂的产量达到了22.21 g/L,与出发菌株相比,产量提高了34.53%。
原生质体融合(protoplast fusion)是基因重组的另一种方式,即通过一定的理化条件,使遗传性状不同的两个细胞的遗传物质以原生质体的方式进行融合,从而获得具有双亲遗传性状的稳定重组子的过程。原生质融合技术可以在种间、属间及科之间构建出新型的菌株。张延平等[24]以 Clostridium acetobutylicum SMB1 (CGMCC No. 2287)为出发菌株,采用化学诱变和原生质体融合交替进行的方法,获得对产物有较高耐受性的突变菌株 DGF4,其对丁醇的耐受性可以达到 19 g/L,丁醇产量为 10.43 g/L。刘力强等[25]将Clostridium acetobutylicum ATCC 824菌种的原生质体融合得到突变菌株Clostridium acetobutylicum p1147(CGMCC No: 3686 ),该菌株可以将发酵产物中的丙酮转化为异丙醇,产生出含有丁醇、乙醇、异丙醇的混合醇,总混合醇产量可达16 g/L。
2.4 工程菌的构建
工程菌是用基因工程的方法,使外源基因得到高效表达的菌类细胞株,常见的有大肠杆菌、酵母菌等。在工程菌中克隆并表达丙酮丁醇梭菌的丁醇合成途径的关键酶基因,从而构建丁醇合成途径,并通过优化代谢途径,增强丁醇的代谢流。张艳等[26]克隆Clostridium acetobutylicum ATCC 824丁醇合成途径关键酶基因thil、adhE2和BSC operon,构建产丁醇的工程大肠杆菌,在微好氧和厌氧条件下,该菌发酵丁醇的最大产量约为84 mg/L。Steen等[27]在酿酒酵母中表达了Clostridium beijerinckii的3-羟基丁酸酰基辅酶A脱氢酶和酿酒酵母及大肠杆菌的乙酰乙酰辅酶A转移酶,该菌发酵丁醇的产量为2.5 mg/L。
3 展 望
从某种意义上讲,细菌是世界上进化最为完美的物种之一,任何人为的改造对其本身来讲都是一种“负影响”,菌种改造过程中会出现正突变率低、定向性差等问题,导致现有技术对菌种的改造无法使丁醇等溶剂的产量有大幅度的提升,但是不可否认,产丁醇菌种改造依旧是实现发酵法生产丁醇工业化的根本途径。菌种改造应该遵循提高丁醇产量和比例的原则,国内外科研工作者在这两方面开展了大量的研究,取得了一定的成果,并应用于丁醇的实际生产中。除菌种的改良外,从自然界中分离筛选优良性状的菌种[28],开发先进的发酵工艺[29]和分离工艺[30]也是提升生物发酵法竞争力的有利手段。相信,随着丁醇改造技术及其他工艺研究的进一步发展,发酵丁醇产量上的桎梏终究会被突破,发酵法生产丁醇工业化终究会实现。
[1]ZaldivarJ, Nielsen J, Olsson L. Fuel ethanol production from lignoc ellulose: a challenge for metabolic metabolic engineering and proce ss integration[J]. Applied Microbiology and Biotechnology, 2001, 56 (1-2): 17-34.
[2]Cascone R. Biobutanol-a replacement for bioethanol [J]. Chemical engineering Progress, 2008,104(8):54-59.
[3]张宇, 许敬亮, 袁振宏, 等. 世界纤维素燃料乙醇产业化进展[J].当代化工, 2014, 43(2): 198-206.
[4]Dürre P. Biobutanol: an attractive biofuel[J]. Biotechnology Journal, 2007, 2(12): 1525-1534.
[5]彭牡丹. 丁醇高产菌株的诱变筛选及发酵技术的研究[D]. 湖南: 中南林业科技大学, 2014.
[6]张丽丽, 沈兆兵, 史吉平, 刘莉. 紫外诱变和丁醇驯化复合选育产丁醇菌株[J]. 中国酿造, 2013, 32(5): 129-133.
[7]毛绍名, 章怀云. 丙酮丁醇梭菌高耐丁醇突变株的选育及其生理特性的研究[J]. 中南林业科技大学学报, 2012, 32(8): 103-111.
[8]朱虹, 许竟早, 李世强, 等. 高能脉冲电子束对生物大分子的辐射损伤[J]. 中国科学B辑: 化学, 2008, 38(1): 79-84.
[9]付玉洁, 吕江涛, 王言, 等. 高能脉冲电子束诱变筛选丙酮丁醇梭菌及发酵研究[J]. 辐射研究与辐射工艺学报, 2011, 29(5): 297-301李南生,李洪升,丁德义.浅埋集输油管线拟稳态温度场及热工计算[J].冰川冻土,1997,19(1):66-72.
[10]Zhang X, Zhang X F, Li H P, et al. Atmospheric and room temp erature plasma (ARTP) as a new powerful mutagenesis tool[J]. Ap plied Microbiology and Biotechnology, 2014, 98(12): 5387-5396.
[11] Guo T, Tang Y, Xi Y L, et al. Clostridium beijerinckii mutant o btained by atmospheric pressure glow discharge producing high p roportions of butanol and solvent yields[J]. Biotechnoloy Letters, 2 011, 33(12): 2379-2383.
[12]Li H G, Luo W, Wang Q, et al. Direct fermentation of gelatinize d cassava starch to aceton, butanol, and ethanol using Clostridiu m acetobutylicum mutant obtained by atmospheric and room temp erature plasma[J]. Applied Biochemistry and Biotechnology, 2014, 172(7):3330-3341.
[13]Cooksley C M, Zhang Y, Wang H, et al. Targeted mutagenesis of the Clostridium acetobutylicum acetone-butanol-etanol fermentati on pathway[J]. Metabolic Engineering, 2012, 14(6): 630-641.
[14] NÖlling J, Breton G, Omelchenko M V, et al. Genome sequence and comparative analysis of the solvent –producing bacterium Cl ostridium acetobutylicum[J]. Journal of bacteriology, 2001, 183(16): 4823-4838.
[15] http://genome.jgi-psf.org/clobe/clobe.home.html.
[16]Mann M S, Dragovic Z, Schirrmacher G, et al. Over-expression o f stress protein-encoding genes helps Clostridium acetobutylicum to rapidly adapt to butanol stress[J]. Biotechnology Letters, 2012, 34(9): 1643-1649.
[17]方雪, 刘刚, 刑苗, 等. 丙酮丁醇梭菌代谢工程菌的构建及其发酵[J]. 食品与发酵工业, 2014, 40(2):99-105.
[18]Capecchi M R. Altering the genome by homologous recombination [J]. Science, 1989, 224: 1288-1292.
[19]Jang Y S, Lee J Y, Lee J, et al. Enhanced butanol production o btained by reinforcing the direct butanol-forming route in Clostri dium acetobutylicum butyrate kinase inactivation mutant[J]. MBio, 2012, 3(5): e00314-12.
[20]Lehmanm D, Honicke D, Ehrenreich A, et al. Modifying the prod uct pattern of Clostridium acetobutylicum: physiological effects of disrupting the acetate and acetone formation pathways[J]. Applie d Microbiology and Biotechnology, 2012, 94(3): 743-754.
[21]Xu M M, Zhao J B, Yu Le, et al. Engineering Clostridium aceto butylicum with a histidine kinase knockout for enhanced n-butan ol tolerance and production[J]. Bioenergy and Biofuels, 2015, 99 (2): 1011-1022.
[22]Zhang Y X, Perry K, Vinci V A, et al. Genome shuffling leads t o rapid phenotypic improvement in bacteria[J]. Nature, 2002, 415: 2006-2018.
[23]Gao X F, Zhao H, Zhang G H, et al. Genome shuffling of Clostr idium acetobutylicum CICC 8012 for improved production of acet on-butanol-ethanol(ABE)[J]. Current Microbiology, 2012, 65(2): 12 8-132.
[24]张延平, 张天瑞, 李寅. 一株获得丁醇产生菌突变株的方法: 中国, CN 101748114 A[P]., 2010.
[25]刘力强, 牛昆, 贾娟娟, 等. 一种丙酮丁醇梭菌及其构建方法和用途: 中国,CN 101845413 A[P]. 2010.
[26]张艳, 周鹏鹏, 王丕祥, 等. 丁醇合成途径关键酶基因在大肠杆菌中的克隆和表达[J]. 微生物学报, 2012, (5): 588-593.
[27]Steen E J, Chan R, Prasad N, et al. Metabolic engineering of sac charomyces cerevisiae for the production of n-butanol[J]. Microbia l Cell Factories, 2008, 7:36.
[28]裴建新, 左文朴, 庞浩, 等. 高产生物丁醇新菌株的筛选、鉴定及发酵研究[J]. 可再生能源, 2011, 29(5): 99-102.
[29]Lu C C, Zhao J B, Yang S T, et al. Fed-batch fermentation for n-butanol production from cassava bagasse hydrolysate in a fibro us bed bioreactor with continuous gas stripping[J]. Bioresoure Tec hnology, 2012, 104: 380-387.
[30]Zhou H L, Su Y, Chen X R, et al. Separation of acetone, butano l and ethanol(ABE) from dilute aqueous solution by silicalite-1/P DMS hybrid pervaporation membranes[J]. Separation and Purificati on Technology, 2011, 79(3): 375-384.
Research Progress in Optimization and Improvement of Butanol-producing Clostridia Strain
CAO Chang-hai, GUAN Hao, GAO Hui-peng, TONG Ming-you, QIAO Kai, WANG Ling-ming, ZHANG Quan
(Key Laboratory of Biofuels and Biochemical Engineering, Fushun Research Institute of Petroleum and Petrochemicals, SINOPEC, Liaoning Fushun 113001,China)
Butanol produced from lignocellulose biomass by fermentation, as a kind of renewable energy has been focused and studied widely in the world as a result of the shortage of fossil fuel. However, the industrialization process of fermentation for producing butanol is limited by yield, productivity and low proportion of biobutanol. Strain improvement is fundamental and important strategy to solve the problem. In this paper, the latest processes of clostridia strain improvement was emphatically summarized from the two aspects of physicochemical mutagenesis and genetic engineering, and the development direction of strain improvement in future was prospected.
Butanol; Clostridia strain; Physicochemical mutagenesis; Genetic engineering
Q 819
A
1671-0460(2015)08-2014-04
中国石油化工集团公司资助项目,项目号:213105。
2015-06-25
曹长海(1983-),男,山东章丘人,工程师,博士学位,2013年毕业于中国石油大学(华东)化学工程与技术专业,研究方向:纤维素酶、发酵工程、生物能源。E-mail:caochanghai.fshy@sinopec.com,电话:024-56389412。
张全(1977-),男,高级工程师,硕士学位,研究方向:纤维素酶、发酵工程、生物能源。E-mail:zhangquang.fshy@sinopec.com,电话:024-56389412。

