免疫性血小板减少症大鼠模型骨髓基质细胞和TPO的变化
★ 彭文虎 卢晓南 徐国良 严小军 刘红宁 尚广彬
(1. 江西中医药大学/江西省中医病因生物学重点实验室 南昌 330004;2 .江西中医药大学基础医学院 南昌 330004)
免疫性血小板减少症大鼠模型骨髓基质细胞和TPO的变化
★ 彭文虎1卢晓南2徐国良1严小军1刘红宁1尚广彬1
(1. 江西中医药大学/江西省中医病因生物学重点实验室 南昌 330004;2 .江西中医药大学基础医学院 南昌 330004)
目的:通过建立免疫性血小板减少症(ITP)大鼠模型,观察其对血液中血小板生成素(TPO)和骨髓微环境中基质细胞的影响。方法:将18只SD大鼠依据外周血小板数量随机均分为正常组、模型组,模型组大鼠于1、3、4、6、7、8天腹腔注射兔抗大鼠血小板血清(APS),正常组大鼠注射相应量的生理盐水。观察各组动物外周血象的变化,实验结束后进行骨髓涂片,ELISA检测血浆中TPO的含量,体外培养并观察骨髓基质细胞生长状况。结果:与正常组比较,模型组动物血小板数量、TPO含量均显著下降(P<0.05),骨髓涂片巨核细胞数目没有明显变化(P>0.05),基质细胞贴壁时间和贴壁率也显著下降(P<0.05)。结论:免疫性血小板减少症大鼠模型血小板数目降低可能与TPO含量和骨髓微环境基质细胞生长状况密切相关。
免疫性血小板减少症;大鼠模型;骨髓基质细胞;实验研究
免疫性血小板减少症是以血小板减少、血小板生存时间缩短及抗血小板自身抗体出现为特征的疾病,其发病原因未明,但已肯定的是它与血小板相关抗体(PAIgG)升高有关, PAIgG与血小板上相关抗原结合,导致血小板被破坏,引起血小板数量减少,出现紫癜、出血等症状。还可能是血小板生成不足引起的,血小板是由骨髓微环境中巨核细胞逐步生成并释放到外周血中,其与骨髓微环境的状况密切相关。自从蒋文明等[1]利用兔抗大鼠血小板血清建立血小板减少症模型以来,关于治疗血小板减少症的药效学研究大多基于大鼠或小鼠的这种模型进行,但迄今为止很少有研究来揭示模型中APS对巨核细胞生成血小板周边骨髓微环境的影响。本研究利用APS建立免疫性血小板减少症模型并研究其对骨髓微环境主要组成成分——骨髓基质细胞的影响。
1 材料与方法
1.1 实验试剂及仪器 血小板生成素(TPO) ELISA试剂盒购自湖北优尔生科技股份有限公司,生产批号:L150115414,卡介苗购自佛山市南海百合医疗科技有限公司,生产批号:00283,IMDM培养基购自SIGMA,生产批号:SLBH1594V,小牛血清购自浙江天杭科技有限公司,生产批号:130203。全自动动物血细胞分析仪(深圳迈瑞BC-2800 Vet),台式离心机(上海安亭科学仪器厂TDL-60B),CO2培养箱(美国Thermo Scientific Forma 3111),显微镜(日本奥林巴斯IX71),酶标仪(美国MD公司Spectra Max Plus384)。
1.2 实验动物 SD大鼠,清洁级,体重 150~180g,雄性,由湖南斯莱克景达实验动物有限公司提供,许可证号SCXK(湘)2013-0004。日本大耳兔,清洁级,2 kg,由南昌龙平兔业有限公司提供,许可证号:SCXK(赣)2013-0001。
1.3 兔抗大鼠血小板血清(APS)的制备及检测 APS制备参考蒋文明等[1]做法,加以改进。SD大鼠,戊巴比妥钠麻醉,腹主动脉取血,肝素抗凝,800 r/min离心15 min,取上层富含血小板血浆,3000 r/min离心10 min沉淀血小板。PBS洗涤血小板,调整血小板数至1×109个/L。将上述血小板悬液与等体积完全弗氏佐剂混合,制成完全弗氏佐剂抗原,在兔两后肢足垫、腹部及背部进行多点皮下注射,每只注射佐剂抗原4 ml。首次注射后于1、2、4周,分别取上述相同浓度血小板悬液与不完全弗氏佐剂等体积混合制成不完全弗氏佐剂抗原,多点皮下注射增强免疫,每次每只4 ml。第5周,颈总动脉取血,室温放置1 h,3000 r/min离心20 min,分离血清。进行红细胞吸附后ELISA法检测兔抗大鼠血小板血清的效价。
1.4 免疫性血小板减少大鼠模型制作及检测 将18只150g左右的SD大鼠眼眶取血测其血小板后,根据其血小板数量将大鼠随机分为正常组、模型组,每组9只。模型组的大鼠于1、3、4、6、7、8天按1ml/200g的量腹腔注射1:4稀释的APS,正常对照组注射同体积的生理盐水。停止注射APS后的第2天即造模第10天,将各组动物眼眶静脉取血作外周血象检测,离心分离血浆按照ELISA说明书测定各组样品中TPO的含量。
1.5 大鼠骨髓涂片 检测外周血象后脱臼处死动物,无菌条件下取出两侧的股骨,剥离干净,用PBS将一根股骨中的骨髓冲出后涂片,分别过6号针头,4号针头,离心,取出100ul制成骨髓涂片,晾干,瑞氏-姬姆萨染色,观察计算整张玻片骨髓巨核细胞数目
1.6 骨髓基质细胞培养 剪去另一股骨两端,IMDM 培养液冲出骨髓细胞,制备单细胞悬液,调整细胞密度,以 1×107 个/ mL 接种在12孔板中,置于 5%,37℃,CO2 培养箱中培养,第3、5天观察其贴壁率情况。
1.7 统计学方法及分析 采用Graphpad prism 5软件,数据以平均数和标准差(X±SD)表示,用单因素方差分析进行统计分析,P<0.05有统计学意义。
2 结果
2.1 免疫性血小板减少大鼠造模前后血小板数目的变化 经检测制备的兔抗大鼠血小板血清(APS)ELISA效价随着稀释倍数的增大,OD值逐渐减小,效价逐渐降低。与阴性对照组相比较,APS稀释512倍仍然大于阴性对照组的10倍。经过注射APS造模后,血小板数目变化结果如表1所示:造模后的大鼠血小板数量降低明显,几乎是正常组和造模前的一半,有极显著性差异(P<0.01)。

表1 各组大鼠造模前后血小板数目的比较(×109个/L,n=9)
2.2 血小板减少症模型大鼠中巨核细胞数目的变化 造模后眼眶取血,确定血小板明显降低(见表1) ,取各组动物的股骨骨髓涂片,显微镜下统计大鼠骨髓巨核细胞数目,与正常组相比,模型组巨核细胞数目稍有下降,但没有统计学意义(P>0.05)。
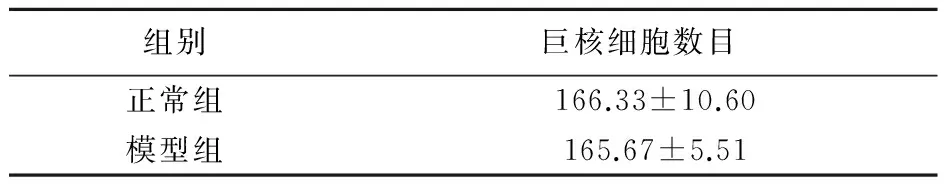
表2 ASP对骨髓巨核细胞的影响 (n=9)
2.3 各组动物血浆中TPO含量比较 实验结果如表3所示:大鼠经APS干预造模后其血浆中的TPO含量与正常组比较显著减少,有显著性意义(P<0.05)。

表3 各组动物血浆中TPO含量 (n=9)
2.4 骨髓基质细胞生长状况 骨髓基质细胞培养24h后,细胞逐渐开始贴壁生长,以长梭形为主,偶见三角形、多角形等。培养3天、5天时骨髓基质细胞贴壁情况如表4所示:模型组基质细胞贴壁率明显比正常组要低得多 ,有显著性差异(P<0.05)。

表4 各组动物骨髓基质细胞贴壁率情况 (n=9)
3 讨论
免疫性血小板减少症是以全身皮下紫癜或内脏黏膜出血为其临床表现特征的一种出血性疾病[2]。它的发病机理不明,目前的研究主要集中在血小板破坏增加和生成减少两个方面,都与血小板相关抗体密切相关,它与血小板上相关抗原结合破坏血小板,或与带相同抗原的巨核细胞结合影响血小板形成,临床表现为巨核细胞不变或增多,伴随成熟分化障碍,血小板急剧下降[3]。本实验利用外源APS注射动物,血小板数目极显著降低(P<0.01),同时巨核细胞数目基本没有变化,巨核细胞成熟程度分类及所占比例可能发生了变化,这与免疫性血小板减少症的临床表现一致,说明模型成功建立。
血小板生成素(TPO)主要存在于肝、肾中,少量在脾和骨髓,1994年得到纯化并被确定为巨核细胞分化、成熟和血小板生成的特异性调控因子,并影响血小板的功能。而在免疫性血小板减少症中TPO含量方面,存在着很大争议[4]。有动物实验和临床研究认为ITP患者[5]和动物[6]的TPO浓度显著高于正常对照组,可能是患者血小板生成明显减少,血小板表面吸附的TPO减少,致使循环中TPO浓度升高。也有文献报道[7-8]ITP患者的血液TPO水平略低于对照组,其原因为ITP血小板破坏而数量减少,巨核细胞增生却成熟障碍,增多的巨核细胞吸附了循环中的TPO,维持血中TPO水平正常偏低,甚至更低,这与本实验结果一致:模型组血浆中TPO显著降低(P<0.05)。
骨髓基质细胞是骨髓内包括成纤维细胞、内皮细胞等多种的总称,其分泌的细胞因子、黏附分子、细胞外基质等形成复杂的网络系统,构成了造血微环境,在造血干细胞向巨核细胞分化,以及巨核细胞最终成熟释放血小板均起到关键作用。例如分泌TPO、IL等促巨核细胞增殖、分化作用的细胞因子,因此骨髓微环境中基质细胞的生长状况直接影响到巨核细胞及血小板的数量。通过注射APS可能会影响骨髓基质细胞构成的微环境,造成巨核细胞成熟障碍,血小板降低。我们体外培养骨髓基质细胞的实验也证明了这一推测:相同时间内模型组大鼠基质细胞的贴壁率明显低于正常组(P<0.05),但血小板相关抗体如何影响骨髓微环境中基质细胞,以及基质细胞与巨核细胞增殖分化生成血小板的具体机制有待进一步研究。
[1]蒋文明, 邓常青, 陈大舜,等. 大鼠免疫性血小板减少模型的研究. 中国实验动物学报[J].1996, (02): 104-108.
[2]中华医学会血液学分会血栓与止血学组.成人原发免疫性血小板减少症诊治的中国专家共识(修订版) [J].中华血液学杂志,2011,32(3):214-216.
[3]秦平,侯明. 2012版成人原发免疫性血小板减少症诊治的中国专家共识解读[J]. 临床血液学杂志,2013(2):151-155.
[4]崔庆荣,初杰,杨广栋. TPO和TGF-β1在特发性血小板减少性紫癜发病机理中的作用探析[J]. 辽宁中医药大学学报,2014,(6):82-84.
[5]李杨,曲道炜,林庶如,等. 紫癜汤及其拆方对特发性血小板减少性紫癜模型小鼠网织血小板和血小板生成素的影响[J]. 中国中医药信息杂志,2014,21(6):53-56.
[6]王红美,沈柏均,时庆,等. TPO和TGF-β1在儿童ITP 发病中的意义[J]. 临床血液学杂志,2002,15 ( 5 ):218-220.
[7]许冰莹, 尚学琴, 杨玲, 等. ITP 患者促血小板生成素水平和白细胞介素-11 水平的检测及意义[J]. 昆明医学院学报, 2006,5:550-551.
[8]刘娟,马骥. 紫癜颗粒对ITP小鼠外周血小板调控因子影响[J].辽宁中医药大学学报[J].2014,(08):45-47.
国家自然科学基金项目(81260653);江西省自然科学基金项目(20114BAB215039);江西省教育厅科技计划项目(GJJ13582);江西省卫生厅中医药科研计划项目(2013A006)。
尚广彬,男,讲师。研究方向:中西医结合基础。E-mail: shanggb107@126.com.
R52
B
2015-04- 25)编辑:王河宝

