EGFR表达与晚期食管鳞腺癌放化疗效果及预后的关系
王国玉,武如芳,杜 娟,潘永奎,洪 燕
(1. 河北省邢台县医院,河北 邢台 054001;2. 河北省邢台市第三医院,河北 邢台 054000)
EGFR表达与晚期食管鳞腺癌放化疗效果及预后的关系
王国玉1,武如芳1,杜 娟1,潘永奎1,洪 燕2
(1. 河北省邢台县医院,河北 邢台 054001;2. 河北省邢台市第三医院,河北 邢台 054000)
目的分析表皮生长因子受体(EGFR)表达与晚期食管鳞腺癌放化疗效果及预后的关系。方法选取53例晚期食管鳞腺癌患者,均使用常规放化疗方案,治疗前后均经活检提取癌变组织及癌旁组织,基于免疫组化染色方法检测组织中EGFR的表达变化,分析EGFR表达与治疗效果及预后的关系。结果治疗前食管鳞腺正常组织EGFR阳性表达率显著低于癌变组织(P<0.05);癌变组织治疗前后EGFR的表达阳性率差异显著(P<0.05);EGFR表达阳性与表达阴性组在总有效率及病死率上均差异显著(P均<0.05)。结论EGFR表达阳性患者晚期食管鳞腺癌放化疗治疗效果及预后更差,癌变组织中EGFR的表达在晚期食管鳞腺癌的治疗过程中有指导作用。
表皮生长因子受体;晚期食管鳞腺癌;放化疗;预后
食管癌为常见的一类消化道癌变疾病,发病率与致死率均位居全球所有癌变疾病的前列[1]。食管癌发病有明显的地域特征,主要类型为鳞癌与腺癌,其中我国主要以鳞癌发病最为多见,并且我国为食管鳞腺癌的高发区,且发病初期往往没有特异性症状,因此一旦发现往往到了晚期,当前临床对于晚期食管鳞腺癌的治疗以放化疗联合使用较为多见,不仅弥补了不能进行手术治疗的缺陷,而且疗效也较可观,但是预后效果仍不理想[2],对此本次研究选用了与多种癌变疾病相关的EGFR作为指标,分析了其表达与放化疗治疗晚期食管鳞腺癌的疗效及预后的相关性,以为晚期食管鳞腺癌的治疗预后提供指导依据,现报道如下。
1 临床资料
1.1一般资料 选取2010年1月—2011年6月邢台县医院收治的53例确诊为晚期食管鳞腺癌患者,均经病理学组织穿刺活检确诊为晚期食管鳞腺癌;经内镜检测食管组织为恶性肿瘤原发病灶;均未接受过恶性肿瘤治疗措施;无肺气肿、心肌梗死等严重型临床疾病;无严重肝肾心功能不全疾病;对化疗(氟尿嘧啶联合顺铂CF方案)药物无严重不良反应;均适合接受放化疗同步治疗;患者及家属均了解研究内容并自愿参与,签署同意协议书。其中男32例,女21例;年龄45~73(62.4±12.3)岁。
1.2治疗方法 患者均接受放化疗同步治疗,放疗与化疗于同一天开始,其中放疗采用三维适形技术,使用直线加速器(≥6MV),以60Gy的剂量进行,分割30次,每次1.8~2.0Gy,每天每个野照射1次,每周放疗5次,共放疗8周。化疗采用CF方案:化疗同时给予水化处理并于至少前3d给予抗呕吐药物,在化疗的第1—5天给予静脉注射氟尿嘧啶750~1 000mg/(m2·d),顺铂25mg/(m2·d),连续化疗4周为1个周期,放疗期间进行2个周期的化疗。之后于放疗结束3周后,以同样的CF方案化疗6周。
1.3组织EGFR表达的检测 应用免疫组织化学染色法[3]检测患者癌变及正常组织中EGFR的表达,使用的鼠抗人EGFR单克隆抗体购于北京西雅金桥生物技术有限公司。对石蜡已包埋好的组织切片(厚度4μm),经脱蜡、修复抗原、加一抗、加聚合物增加剂、加试剂酶标鼠/兔抗聚合物、加现配DAB、苏木兰染色、封片成标本,进行观察,并取EGFR表达阴性与阳性的标本进行比对。试剂均购于北京西雅金桥生物技术有限公司。
1.4EGFR阳性评定方法EGFR的阳性表达为棕黄色颗粒状物质,主要存在于细胞浆或细胞质膜中[4]。参考文献[5]方法按照染色深度与面积的乘积评定EGFR的表达。染色深度以棕褐色计4分、棕黄色计3分、浅黄色计2分、不显色计0分;染色面积以>80%计4分,>40%~80%计3分,25%~40%计2分,<25%计1分。染色深度得分与染色面积得分的乘积若为0分则表示阴性(-),1~2分则表示弱阳性(+),若为3~4分则表示中阳性(),若>4分则表示强阳性()。(+~)均记为阳性。
1.5疗效评价标准 完全缓解(CR):患者所有病灶消失,无新病灶出现,患者各项肿瘤标志物水平正常,且以上情况维持至少4周;部分缓解(PR):患者病灶最大径的和至少减少30%、且维持4周或以上;稳定(SD):患者病灶最大径之和减少不到PR或增大不到PD;恶化加重(PD):患者病灶最大径之和增大至少20%,或者有新病灶出现。CR与PR之和计为总有效。
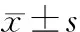
2 结 果
2.1不同临床特征EGFR表达情况 癌变组织不同TNM分期及不同分化程度EGFR阳性率比较差异无统计学意义(P均>0.05);有淋巴转移的癌变组织EGFR阳性率显著高于无淋巴转移的癌变组织(P<0.05)。见表1。
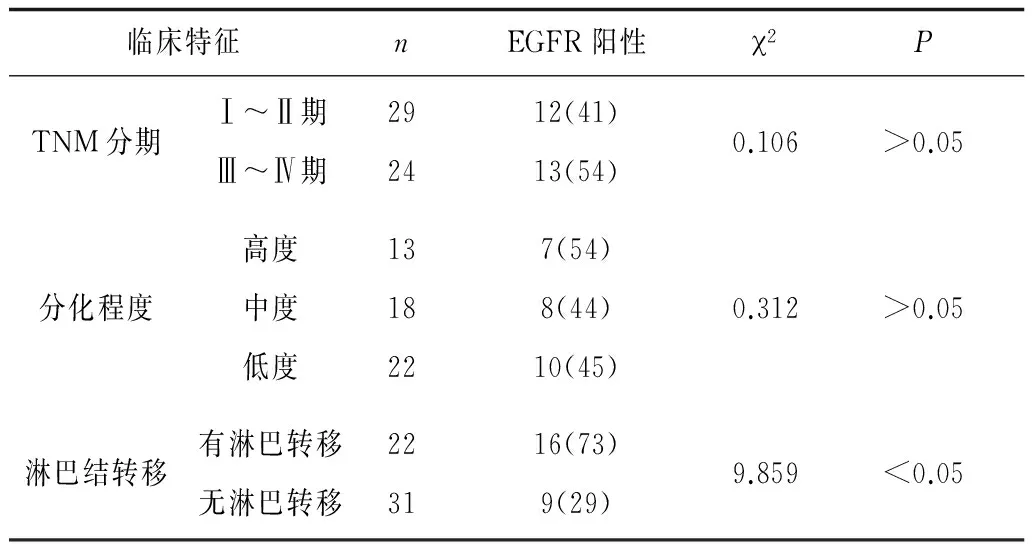
表1 不同临床特征EGFR表达情况 例(%)
2.2EGFR在组织治疗前后的表达变化 治疗前后癌变组织的EGFR阳性率均显著高于正常组织(P<0.05);治疗后癌变组织EGFR阳性率较治疗前显著下降(P<0.05)。见表2。
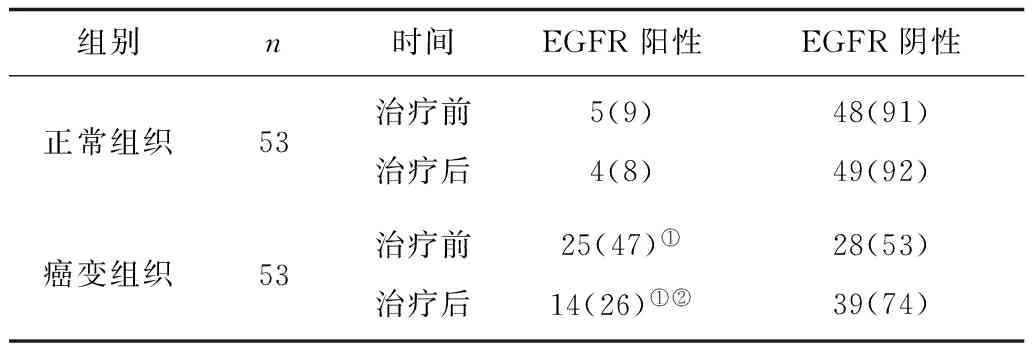
表2 EGFR在组织治疗前后表达变化 例(%)
注:①与正常组织比较,P<0.05;②与治疗前比较,P<0.05 。
2.3不同EGFR表达放化疗效果比较 EGFR表达阳性患者总有效率显著低于EGFR表达阴性者(P<0.05)。见表3。
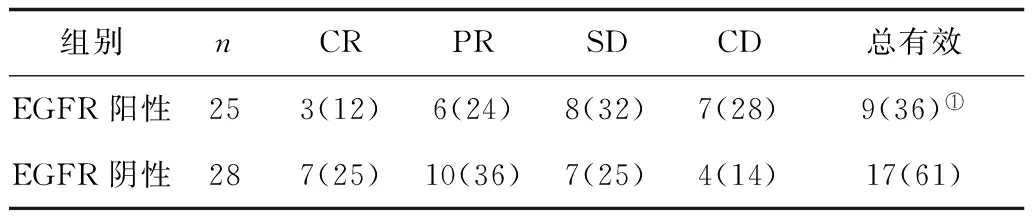
表3 不同EGFR表达放化疗效果比较 例(%)
注:①与EGFR阴性比较,P<0.05。
2.4不同EGFR表达患者预后比较 治疗后EGFR阳性患者1年、2年及3年病死率均显著高于EGFR阴性患者(P均<0.05)。见表4。
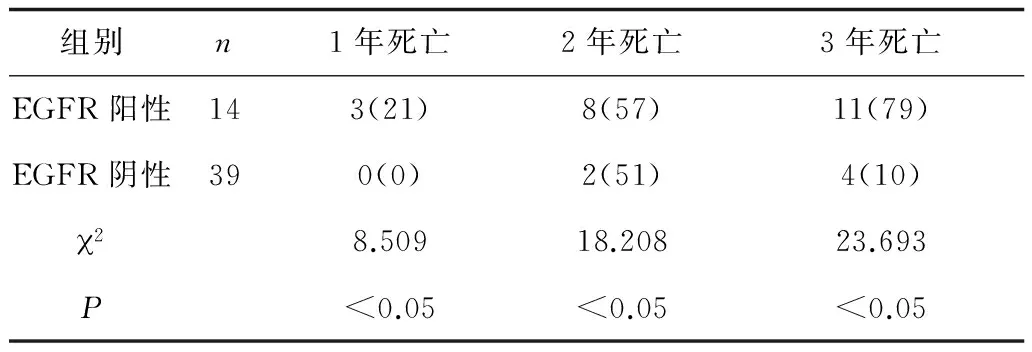
表4 治疗后不同EGFR表达患者预后比较 例(%)
3 讨 论
食管癌作为消化系统常见的恶性肿瘤,也是我国最常见、对人类健康威胁最大的恶性肿瘤之一,腺鳞癌是其最常见恶性病理组织学分型之一[7]。食管癌的典型临床表现包括进行性吞咽困难、持续性胸痛或背痛,并可形成食管支气管瘘,全身性转移等严重并发症。晚期患者手术治疗效果极差、甚至失去手术治疗机会,化疗、放疗是其目前主要治疗措施。随着分子靶向治疗研究的发展,特异性分子标志物在食管癌组织中被发现,并与其发生、发展和预后存在密切的关联性[8]。因此,以表皮生长因子受体为代表的分子标志物在食管癌的治疗研究中具有重要意义和价值。
3.1晚期食管鳞腺癌的放化疗 众所周知,早期或中期食管癌患者多主张手术切除食管癌变节段,但晚期患者,尤其食管鳞腺癌多伴随食管全节段癌变或全身性其他部位转移,放疗或化疗是其治疗的首选和唯一延长生命的措施[9]。放疗方法主要包括:①手术联合放疗的综合治疗。针对符合手术适应证,可耐受手术患者,可行姑息性手术切除适量癌变组织,改善食管梗阻,缓解其临床症状[10]。术前3~4周放疗控制癌症程度增加其手术敏感性,针对术中切除不全的残留癌组织在术后3~6周可行针对性放疗治疗。②单纯放疗。针对高位食管癌患者,如颈段、胸上段,由于手术难度大,患者基础条件要求高,并发症和禁忌证多,疗效不理想,仅可采取单纯放疗治疗。同放疗相似,化疗治疗亦包括单纯化疗及手术切除联合放疗的综合治疗。化疗治疗亦可适当缓解使食管癌压迫梗阻症状,延长患者存活期,提高其治疗效果。但由于化疗的药物毒副作用,应密切注意患者血象和肝肾功能变化。
3.2EFGR表达与食管鳞腺癌的关系 EGFR是一种跨膜糖蛋白型的受体酪氨酸蛋白激酶(tyrosine protein kinase,TPK),由1 186个氨基酸构成,相对分子质量170 000。其细胞膜外功能区可与转化生长因子α(TGF-α)、表皮生长因子(EGF)等配体结合后激活其细胞内酪氨酸激酶,启动下游途径和信号转导,诱发食管癌的发生和发展。现有研究认为其激活后下游主要途径包括如下4种[11]:①丝裂原激活蛋白激酶通路。通过细胞内转录因子丝/苏氨酸残基磷酸化的催化作用促进基因转录,加速细胞分裂。②磷脂酰肌醇-3-激酶通路。激活后具有抗凋亡和促进新生血管再生作用。③Janus激酶/信号传导与转录激活因子。激活后具有促进细胞增殖、延长细胞生存作用。④磷脂酶C-γ/蛋白激酶C通路。激活后具有促进细胞分化、凋亡,加速细胞周期进程的作用。本研究癌变组织与正常组织中EGFR表达阳性率差异有统计学意义。
3.3EFGR表达与食管腺瘤癌放化疗预后的比较 手术切除食管癌标本发现EFGR在食管癌组织中的表达远高于正常人群,结合EFGR与食管鳞腺癌的相关性亦可知EFGR是食管癌重要的诊断预测因子[12]。但大量放化疗治疗随访统计分析后发现,EFGR与其治疗预后具有统计学相关性。即EFGR表达阳性的食管鳞腺癌患者接受同步放化疗治疗后其症状缓解率和治疗综合疗效显著高于EFGR表达阴性患者。且本次研究还证实EFGR表达阳性的患者1年、2年、3年病死率显著高于后者,由此可见EFGR与食管癌放化疗效果及预后具有相关性。
综上,EFGR作为食管癌重要的分子标志物之一,具有良好可靠的诊断意义,可用于难确诊食管癌患者的确诊。并可有效反映食管鳞腺癌患者对放化疗的敏感性及短期病死率,在临床治疗中具有指导意义。
[1] 梁好. 胃癌、食管癌的病因学研究和环境危险因素人群归因危险度的评价[D]. 北京:北京协和医学院,2012
[2] 王澜,韩春,李晓宁,等. 中晚期食管癌二维适形放疗联合同期化疗的临床观察[J]. 中华肿瘤防治杂志,2010,17(24) :2053-2056
[3] 仰丽丽,李积德,高晟. MMP-2和EGFR在胃癌中的表达及其与生物学特征的关系[J]. 实用癌症杂志,2010,25(4):46-49
[4] 胡雅兵. EGFR、VEGF在非小细胞肺癌中的表达意义及与微血管密度之间的关系[J]. 四川医学,2011,32(7):1007-1010
[5] 何萍,王燕,杨晟. 191例EGFR突变状态不明晚期肺腺癌患者EGFR-TKIs耐药后化疗的疗效分析[J]. 中国肺癌杂志,2013,16(10):529-532
[6] 吴福道,蒋光伟,王永成,等. 局部晚期食管同步放化疗疗效观察[J]. 四川医学,2009,30(6):887
[7] Yang YL,Xu KL,Zhou Y,et al.Correlation of epidermal growth factor receptor overexpression with increased epidermal growth factor receptor gene copy number in esophageal squamous cell carcinomas[J]. Chin Med J(Engl),2012,125(3):450-454
[8] 高振华. 表皮生长因子受体在接受放化疗的局部晚期食管鳞癌中的预后作用研究[D]. 济南:济南大学,2014
[9] Minsky BD,Pajak T,Ginsberg RJ,et al. INT 0123(RTOG 94-05) phase Ⅲ trail of combined modality therapy for esophagael cancer: high dose(64.8Gy) vs. Standard dose (50.4Gy) radiation therapy[J]. Clin Oncol,2002,20(5):1167-1174
[10] 赵明宏,袁琳,仇建玲. 紫杉醇奈达铂化疗同步调强放疗治疗局部晚期食管癌疗效观察[J]. 现代中西医结合杂志,2012,21(31):3447-3449
[11] 黄大福,陈德玉. EGFR,HER2预测食管鳞状细胞癌同步放化疗敏感性的价值[J]. 江苏大学学报:医学版,2009,19(6):493-496
[12] Delektorskaya VV,Chemeris GY,Zavalishina LE,et al. Squamous cell carcinoma of the esophagus:evaluation of the status of epidermal growth factor receptors(EGFR and HER-2) by immunohistochemistry and in situ hybridization [J]. Bull Exp Biol Med,2010,149(5):615-620
10.3969/j.issn.1008-8849.2015.30.028
R735.1
B
1008-8849(2015)30-3379-03
2015-03-15

