ERCC1、TS在胃癌组织中的表达与术后辅助化疗预后的关系
王维民,周 炎,金 俊,姚 强,汤月华
(江苏大学附属宜兴医院,江苏 宜兴 214200)
论 著
ERCC1、TS在胃癌组织中的表达与术后辅助化疗预后的关系
王维民,周 炎,金 俊,姚 强,汤月华
(江苏大学附属宜兴医院,江苏 宜兴 214200)

目的探讨胃癌术后患者核苷酸切除修复交叉互补基因1(ERCC1)、胸苷酸合成酶(TS)表达与术后辅助化疗预后的关系。方法选取86例初次诊断为胃癌行胃癌根治术、术后病理诊断为Ⅱ~Ⅲ期的患者,术后均采用XELOX辅助化疗方案化疗,并进行4年以上随访。运用免疫组化方法检测患者癌组织中ERCC1、TS蛋白表达情况,分析ERCC1、TS表达与术后辅助化疗预后的关系。结果86例胃癌患者癌组织中ERCC1和TS的阳性表达率分别为40%和36%。ERCC1和TS阳性表达率与肿瘤的分化程度相关。ERCC1阴性表达者和TS阴性表达者平均生存期均明显长于阳性表达者(P均<0.05)。多因素COX回归分析表明,ERCC1、TS阳性表达者术后辅助化疗预后差[HR=0.29,95%CI(0.12,0.69),P=0.006; HR=0.49,95%CI(0.20,0.87),P=0.010]。结论ERCC1与TS表达情况可以作为预测胃癌术后辅助化疗预后的分子标志物。
胃癌;核苷酸切除修复交叉互补基因1;胸苷酸合成酶;辅助化疗;预后
胃癌是世界上最常见的恶性肿瘤之一,但近年来其发病率及病死率在世界范围内有下降趋势[1]。胃癌的发病有着明显的地域性差异,在欧洲胃癌的病死率位于肺癌、结肠癌、乳腺癌之后,位居第4位[2]。2009年的调查显示,我国胃癌的发病率及病死率均仅次于肺癌,位居第2位[3]。CLASSIC研究结果显示,采用希罗达联合奥沙利铂(XELOX)方案辅助化疗不仅可降低胃癌44%的复发风险,且74%的胃癌患者根治术后接受XELOX方案辅助化疗可获3年无病生存[4]。但是,手术残留的癌细胞和处于萌芽状态的癌细胞随时有可能复发和转移,为了能更有效地提高术后辅助化疗疗效,笔者对86例胃癌术后患者组织标本中核苷酸切除修复交叉互补基因1(ERCC1)、胸苷酸合成酶(TS)蛋白表达情况进行了检测,并分析了它们与临床病理特征的关系,旨在探讨分子标记物联合检测在预测胃癌术后采用XELOX方案化疗疗效及预后中的作用,为胃癌的个体化治疗提供临床依据。
1 临床资料
1.1一般资料 86例标本取自江苏大学附属宜兴医院2009年1月—2010年12月手术治疗的胃癌患者,均经病理证实。男52例,女34例;年龄33~75岁,中位年龄51岁。按1997年国际抗癌联盟(UICC)TNM标准分期Ⅱ期31例,Ⅲ期55例。术后患者均给予XELOX方案(奥沙利铂130 mg/m2静脉滴注第1天,希罗达1 000 mg/m2口服第1—14天)化疗,28 d为1个周期,至少完成6个周期的化疗。化疗后通过上门或电话的方式进行随访,直至患者死亡,若末次随访仍然存活则定为截尾值。随访截止时间2014年12月。
1.2主要仪器及试剂 鼠抗人ERCC1、TS单克隆抗体购自Santa Cruz生物工程公司,二步法免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司,石蜡切片机及漂片处理仪、图文分析系统为日本莱卡公司产品。
1.3实验方法 标本用4%甲醛固定,石蜡包埋,常规切片,厚度4 μm。采用二步法免疫组化检测结肠癌组织ERCC1、TS蛋白的表达。常规脱蜡、水化后进行预处理,3%H202室温培育10 min,蒸馏水洗3次,每次2 min,分别滴加1∶100稀释的抗ERCC1、TS单克隆抗体,室温培育20 min,DAB显色,苏木精对比染色、脱水,二甲苯透明,中性树脂封固,光学显微镜下观察。
1.4免疫组化结果判断标准 ERCC1、TS蛋白阳性染色者均在细胞核和/或细胞浆呈棕黄色沉着。在光镜下(400倍视野)计数1 000个肿瘤细胞中阳性细胞数,视野中阳性细胞数≥10%为阳性,不表达或<10%为阴性。病理结果由2位病理科医生在未获知临床资料及预后的情况下独立阅片判定。
1.5统计学方法 采用STATA 10.0统计软件进行统计学分析。定性资料比较采用Fisher 确切概率法,总体生存分析采用Kaplan-Meier生存曲线表示,生存率的比较采用log-rank检验,影响因素分析采用COX多因素回归模型。检验水准α=0.05,双侧P<0.05为差异有统计学意义。
2 结 果
2.1ERCC1、TS在胃癌组织中的表达及与临床特征的关系 86例胃癌患者中,ERCC1蛋白阳性表达34例(40%),阴性表达52例(60%);TS蛋白阳性表达31例(36%),阴性表达55例(64%)。ERCC1、TS蛋白表达与患者临床分期、年龄、性别均无明显相关性(P均>0.05),但两者阳性表达率均随着肿瘤的分化程度降低而明显增高(P均<0.05)。见表1。
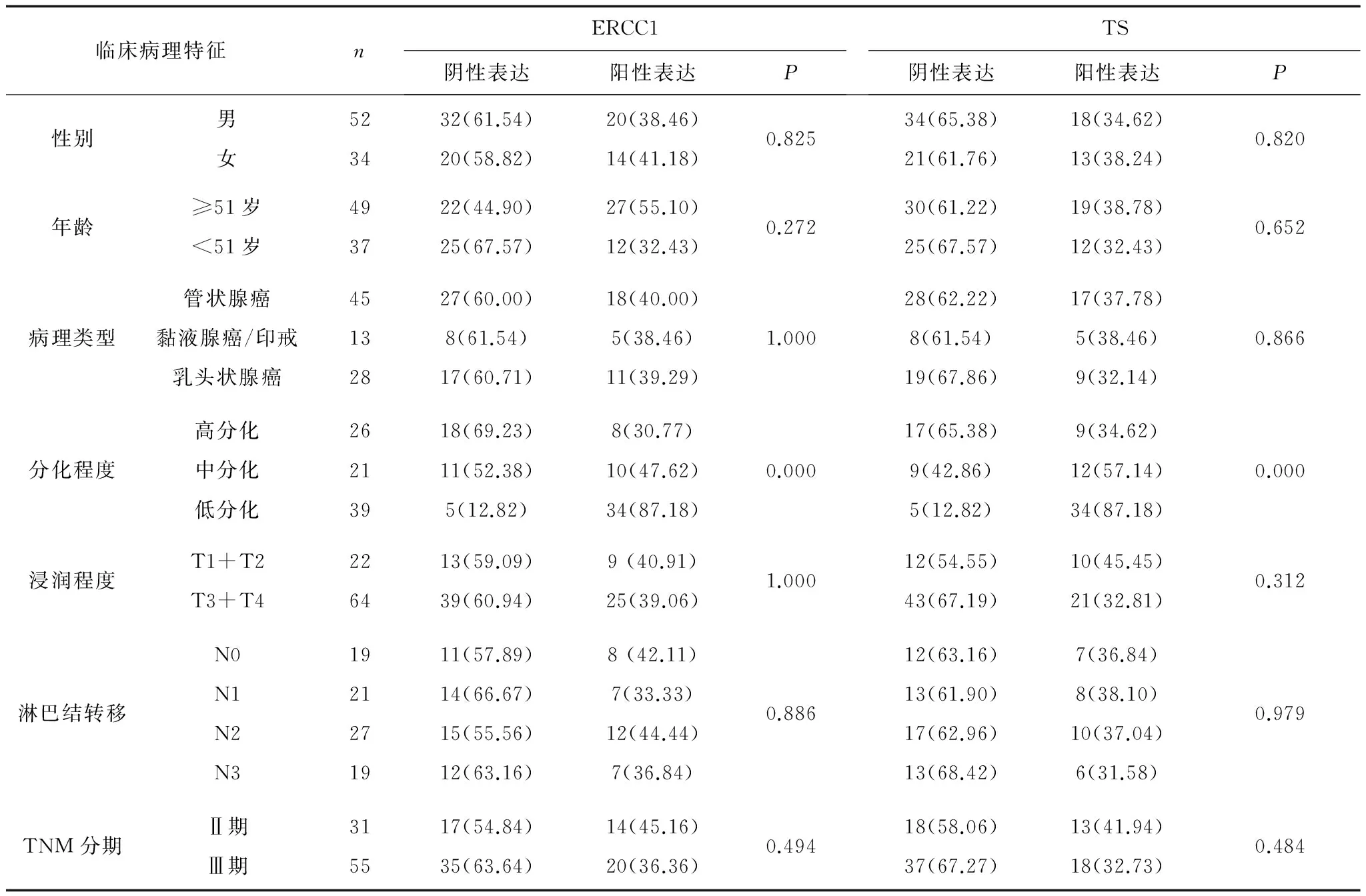
表1 ERCC1与TS蛋白表达与临床特征的关系 例(%)
2.2ERCC1与TS蛋白表达与生存期的关系 ERCC1阴性表达者平均生存期为42.8个月[95%CI(39.95,45.63)],而ERCC1阳性表达者平均生存期为33.4个月[95%CI(28.76,38.06)],2组比较差异有统计学意义(P<0.05);TS阴性表达者平均生存期为41.6个月[95%CI(38.54,44.59)],而TS阳性表达者平均生存期为34.7个月[95%CI(29.84,39.51)],2组比较差异有统计学意义(P<0.05)。Kaplan-Meier生存曲线显示:ERCC1阴性表达者和TS蛋白阴性表达者3年生存期均明显长于阳性表达者(P均<0.05)。见图1及图2。多因素COX回归模型分析表明,ERCC1阳性表达者和TS阳性表达者预后均较差,且分化程度越高的患者预后越好。见表2。
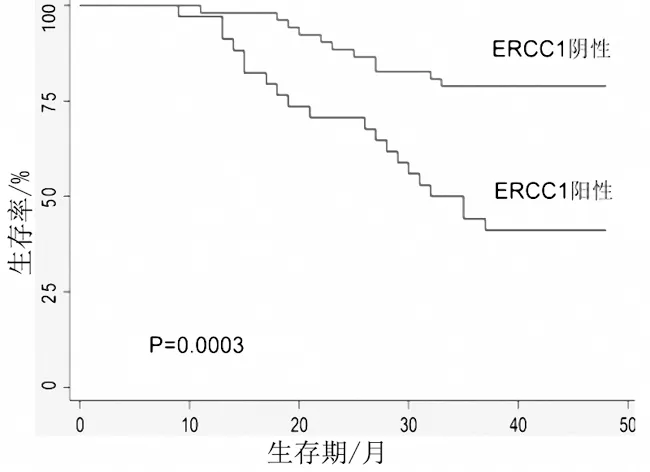
图1 ERCC1蛋白表达与生存期之间的关系
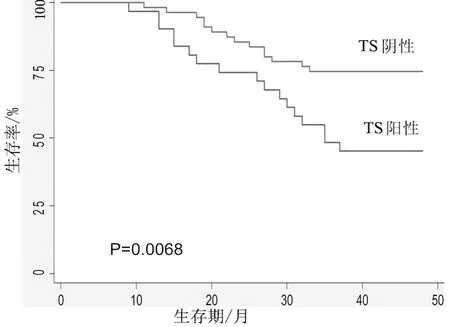
图2 TS蛋白表达与生存期之间的关系
3 讨 论
胃癌是常见的恶性肿瘤之一,日本是胃癌的高发地区,但由于早期胃癌占据了较大比例,预后相对较好[5]。目前手术疗法是治疗胃癌的主要手段,其中D2手术是治疗进展期胃癌的标准术式。近年腹腔镜胃癌根治术逐渐应用于临床,且较常规开腹手术具有一定的优越性[6-9]。但由于亚临床病灶的存在,术后仍有40%~80%的患者出现复发或远处转移,新辅助化疗可一定程度上提高患者R0切除率,降低胃癌术后复发及病死率,延长患者的生存期[10-12],所以化疗在胃癌的综合治疗中起至关重要的作用[13]。胃癌的预后与多种因子有关,侯毅鞠等[14]研究显示胃癌组织中凋亡抑制蛋白Livin高表达预示着肿瘤有较高的侵袭性,预后较差。
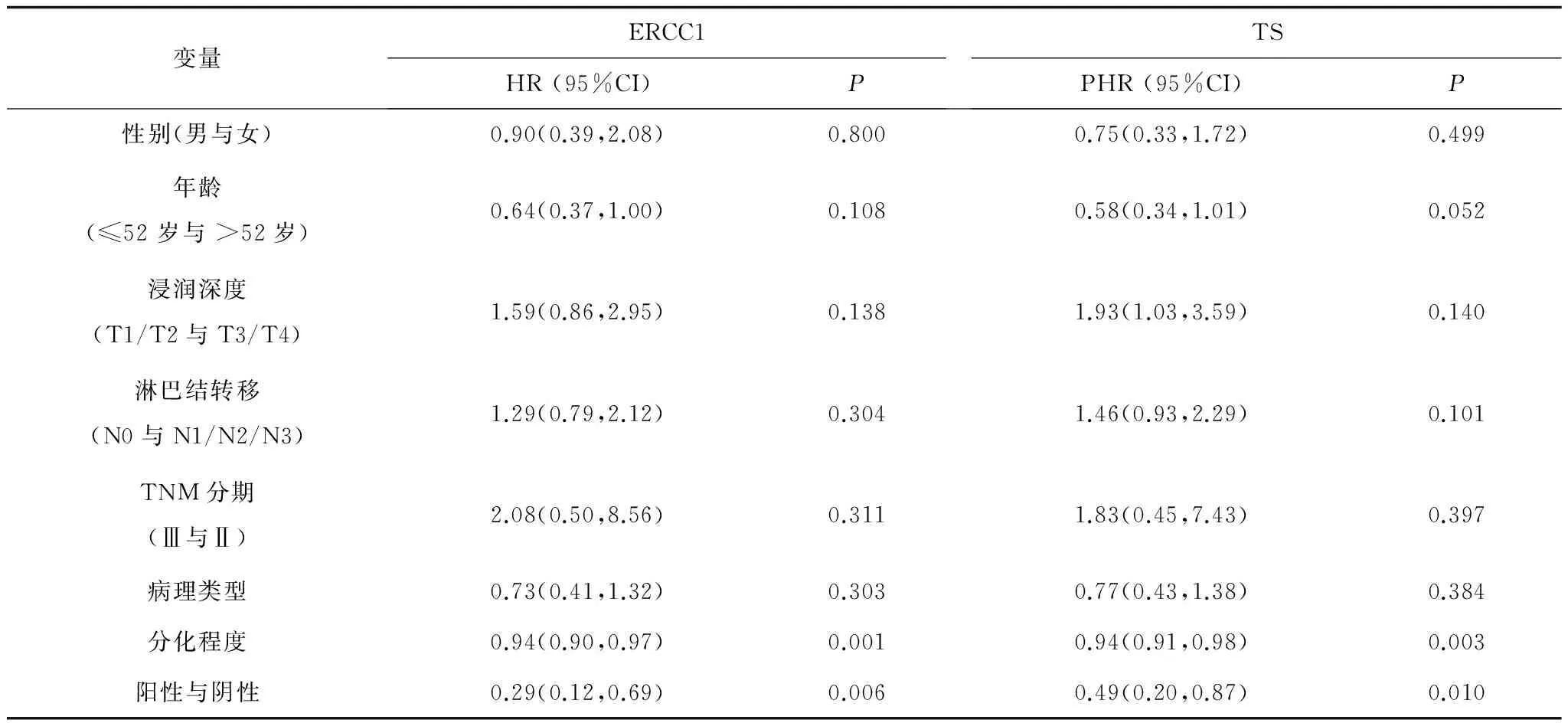
表2 胃癌患者癌组织中ERCC1、TS表达与临床病理资料变量多因素COX回归分析
ERCC1定位于19号染色体上,是核苷酸切除修复(Nucleotidc Excision Repair,NER)活性的标志性基因,是标志肿瘤患者预后和铂类化疗的重要指标,在肿瘤治疗中具有重要作用。已有Meta分析显示在接受以铂类为基础的化疗患者中,ERCC1与患者的预后存在明显负相关[15-16]。Kim等[17]研究发现,ERCC1、GSTP1与肿瘤大小明显相关,并与总生存期(OS)有明显关系(HR=0.069,P=0.021)。Kwon等[18]通过免疫组化法检测64例进展期胃癌患者组织中ERCC1、TS和GSTP1的表达,发现ERCC1阳性表达患者对FOLFOX方案化疗的敏感性显著低于阴性表达患者(P=0.045),多因素分析显示,ERCC1阳性表达对OS具有明显影响(HR=1.92,P=0.037) 。TS是胸苷酸合成的限速酶,其是促进肿瘤生长的重要因子,主要机制是催化dUMP转化成脱氧胸苷酸(dTMP),从而促进DNA的合成。TS是5-Fu发挥细胞毒作用的目标酶,5-Fu在体内的代谢产物5-氟尿嘧啶脱氧核苷(FdUMP)与TS结合,从而降低TS的活性。TS蛋白过表达将使FdUMP不能完全抑制TS的作用,诱发肿瘤细胞对5-Fu产生耐药。因此,TS 蛋白和基因的表达水平与5-Fu为基础的胃癌患者化疗疗效呈负相关。Lenz等[19]发现胃癌患者TS表达水平与5-Fu的疗效呈负相关。 Liu 等[20]回顾了58例年龄≥65岁的进展期胃癌患者,他们均接受了单药希罗达化疗,免疫组化方法检测TS在胃癌组织中的表达,研究提示TS低表达胃癌患者DFS及OS均较TS高表达患者明显延长(P=0.001,0.002)。Baroudi等[21]研究提示TS高表达与患者对化疗敏感性及预后均存在负相关,不但说明TS水平高的肿瘤对5-Fu的敏感性差,而且说明细胞持续暴露于5-Fu也可以使细胞内TS基因突变导致基因扩增及蛋白的过度表达,从而引起对5-Fu的继发性耐药。希罗达化学名是卡培他滨,是一种对肿瘤细胞有选择性活性的口服细胞毒性制剂,是5-Fu的前体,本身无毒性,且只在肿瘤部位转化为有细胞毒性的5-Fu,具有一定的靶向性和特异性,更有效,不良反应较少。在进展期胃癌化疗方案中,无论是二药还是三药联合方案,希罗达效果明显优于5-Fu。
本课题组应用免疫组化技术检测胃癌术后患者的ERCC1、TS蛋白表达水平,结果显示ERCC1蛋白在胃癌组织中的阳性表达率为40%,TS蛋白在胃癌组织中的阳性表达率为36%, 两者阳性表达率随肿瘤的分化程度降低而明显增高。ERCC1、TS蛋白低表达较高表达的胃癌术后患者应用XELOX方案化疗可获得生存受益。本研究初步表明,ERCC1蛋白表达可以预测胃癌患者对铂类化疗的敏感性,TS蛋白表达可以预测希罗达化疗药物的敏感性,两者联合运用可以预测XELOX方案的有效性,可为胃癌术后患者的个体化治疗提供临床理论依据。
[1] Ferro A,Peleteiro B,Malvezzi M,et al. Worldwide trends in gastric cancer mortality(1980-2011),with predictions to 2015,and incidence by subtype[J]. Eur J Cancer,2014,50(7):1330-1344
[2] Ferlay J,Parkin DM,Steliarova-Foucher E. Estimates of cancer incidence and mortality in Europe in 2008[J]. Eur J Cancer,2010,46(4):765-781
[3] 陈万青,张思维,郑荣寿,等. 中国2009年恶性肿瘤发病和死亡分析[J]. 中国肿瘤,2013,22(1):2-12
[4] Noh SH,Park SR,Yang HK,et al. Adjuvant capecitabine plus oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): 5-year follow-up of an open-label, randomised phase 3 trial[J]. Lancet Oncol,2014,15(12):1389-1396
[5] Patru CL,Surlin V,Georgescu I,et al. Current issues in gastric cancer epidemiology[J]. Rev Med Chir Soc Med Nat Iasi,2013,117(1):199-204
[6] 陈凛,李涛. 胃癌综合治疗现状与进展[J]. 世界华人消化杂志,2008,16(6):571-574
[7] 黄飞,陈永军,韦杨年,等. 腹腔镜辅助下胃癌根治术与开腹胃癌根治术疗效的对比研究[J]. 中国内镜杂志,2012,18(10):1018-1022
[8] 唐波,余佩武. 腹腔镜胃癌D2手术淋巴结清扫原则与技巧[J]. 中国普外基础与临床杂志,2011,18(2):114-115
[9] 王璟,韩晓鹏,苏琳,等. 新辅助化疗联合腹腔镜治疗进展期胃癌的近期疗效分析[J]. 现代肿瘤医学,2014,22(11):2632-2635
[10] 李国立,李宁,黎介寿. 进展期胃癌新辅助化疗的临床实践与面临的问题[J]. 中国普外基础与临床杂志,2010,17(1):8-10
[11] 孙震,杨肖军,程伏林,等. 新辅助化疗FOLFOX4方案治疗进展期胃癌的临床疗效[J]. 肿瘤防治研究,2014,41(7):803-807
[12] 周堃,纪俊标. Ⅲ期胃癌新辅助化疗效果的临床分析[J]. 江苏医药, 2010,36(19):2333-2334
[13] 欧阳洋,欧阳植庭,夏绪东. 胃癌手术患者预后的多因素分析[J]. 中国普通外科杂志,2010,19(10):1061-1064
[14] 侯毅鞠,李艳,袁忠海,等. 凋亡抑制蛋白Livin在胃癌及癌旁组织中的表达[J]. 世界华人消化杂志,2010,18(12):1196-1200
[15] Ma SC,Zhao Y,Zhang T,et al. Association between the ERCC1 rs11615 polymorphism and clinical outcomes of oxaliplatin-based chemotherapies in gastrointestinal cancer:a meta-analysis[J]. Onco Targets Ther,2015,8:641-648
[16] Song P,Yin Q,Lu M,et al. Prognostic value of excision repair cross-complementation group 1 expression in gastric cancer:A meta-analysis[J]. Exp Ther Med,2015,9(4): 1393-1400
[17] Kim KH,Kwon HC,Oh SY,et al. Clinicopathologic significance of ERCC1, thymidylate synthase and glutathione S-transferase P1 expression for advanced gastric cancer patients receiving adjuvant 5-FU and cisplatin chemotherapy[J]. Biomarkers,2011,16(1):74-82
[18] Kwon HC,Roh MS,Oh SY,et al. Prognostic value of expression of ERCC1, thymidylate synthase, and glutathione S-transferase P1 for 5-fluorouracil/oxaliplatin chemotherapy in advanced gastric cancer[J]. Ann Oncol,2007,18(3):504-509
[19] Lenz HJ,Leichman CG,Danenberg KD,et al. Thymidylate synthase mRNA level in adenocarcinoma of the stomach: a predictor for primary tumor response and overall survival[J]. J Clin Oncol,1996,14(1):176-182
[20] Liu XF,Zhang H,Sun JQ,et al. Correlation between expression of thymidylate synthase and clinical outcome of advanced gastric cancer treated with capecitabine alone chemotherapy[J]. Tumour Biol,2014,35(12):12409-12414
[21] Baroudi O,Baroudi T,Omrane I,et al. Thymidylate synthase polymorphism in sporadic colorectal and gastric cancer in Tunisian population: a predictive role in 5-fluorouracil based chemotherapy treatment[J]. Med Oncol,2014,31(2):825
Relationship of the expression of ERCC1 and TS in gastric cancer tissue with the prognosis after postoperative adjuvant chemotherapy
WANG Weimin, ZHOU Yan, JIN Jun, YAO Qiang, TANG Yuehua
(Yixing Hospital Affiliated to Jiangsu University, Yixing 214200, Jiangsu, China)
Objective It is to investigate the relationship of the expression of ERCC1 and TS in gastric cancer with the prognosis after postoperative adjuvant chemotherapy. Methods 86 patients who were diagnosed gastric cancer for the first time were enrolled in our study. All the patients were received radical operation, pathologic diagnosis stage was Ⅱ or Ⅲ stage, and all accepted XELOX chemotherapy and followed at least 4 years. The expressions of ERCC1 and TS in gastric cancer tissue were detected by Immunohistochemistry method. The relationship of the expression of ERCC1 and TS with the prognosis was analyzed. Results The positive expression rate of ERCC1 and TS in 86 cases was 40% and 36% respectively. There were negative correlation between the positive expression of ERCC1 and TS and the differentiation of tumor. The mean survival time of patients with negative expression of ERCC1 and TS were significant longer than those with positive expression (allP<0.05). COX multivariate regression analysis revealed that patients with ERCC1 and TS didn't benefit from chemotherapy [HR=0.29, 95%CI(0.12,0.69),P=0.006; HR=0.49, 95%CI(0.20, 0.87),P=0.010]. Conclusion ERCC1 and TS may be a biomarker to predict the prognosis of gastric cancer patients receiving chemotherapy.
gastric cancer; ERCC1; TS; adjuvant chemotherapy; prognosis
王维民,男,主治医师,硕士,主要从事肿瘤化疗及分子靶向治疗方面的研究工作。
汤月华,E-mail:dryzhou@163.com
无锡市科技局医疗与公众健康技术研发项目(CSE31N1333);江苏省恶性肿瘤生物标志物与防治重点实验室开放课题(11ZLKF09)
10.3969/j.issn.1008-8849.2015.30.001
R735.2
A
1008-8849(2015)30-3307-04
2014-11-16

