伊立替康联合国产替吉奥二线治疗化疗失败的转移性结直肠癌疗效观察
宋利强,盖娟娟
(山东省东营市人民医院,山东 东营 257091)
伊立替康联合国产替吉奥二线治疗化疗失败的转移性结直肠癌疗效观察
宋利强,盖娟娟
(山东省东营市人民医院,山东 东营 257091)
目的观察伊立替康(CPT-11)联合替吉奥治疗一线化疗失败的晚期结直肠癌的疗效及安全性。方法38例晚期结直肠癌患者均为经5-氟尿嘧啶(5-Fu)、亚叶酸钙(LV)以及奥沙利铂等药物一线化疗失败者,行CPT-11联合替吉奥方案治疗,CPT-11 100 mg/m2,静脉滴注90 min,第1,8天;替吉奥40 mg/m2,2次/d,第1—14天口服, 休息7 d,21 d为1个疗程,每例患者至少接受2个疗程治疗。按照WHO 实体瘤近期客观疗效评定标准进行评价。结果38例均可评价疗效及不良反应。完全缓解0例,部分缓解14例,有效率为37%(14/38),稳定12例, 进展12例。中位疾病进展时间6.9个月( 6~25个月),中位生存期13.5个月,不良反应主要为恶心、呕吐、厌食、白细胞减少、脱发和延迟性腹泻, 多为Ⅰ~Ⅱ度。结论伊立替康联合替吉奥二线治疗晚期结直肠癌用药方便、疗效肯定,不良反应低,可广泛用于临床。
伊立替康;替吉奥;结直肠癌;化疗
结直肠癌是我国常见的消化道恶性肿瘤之一。近30年来其发病率在全球发达国家呈明显上升趋势。在我国的发病率和病死率亦处于逐年上升的趋势,死亡率在恶性肿瘤中占第四位[1]。对于晚期转移性结直肠癌,全身化疗是主要治疗手段,可延长患者的生存期,改善患者的生活质量。FOLFOX4联合化疗为一线治疗方案,有较好的疗效。对于应用FOLFOX4治疗失败的患者。FOLFIRI方案可以作为二线治疗,虽然相比姑息治疗,FOLFIRI 方案能显著改善生存率[2]。但该方案毒副作用较大,且需要持续静脉输注,部分患者难以耐受。替吉奥胶囊是日本制药公司最先研制的口服抗癌新药,最先用于胃癌治疗。近年来逐渐用于晚期转移性结直肠癌的治疗,笔者2009年1月—2011年6月应用伊立替康联合替吉奥治疗FOLFOX4化疗失败的转移性结直肠癌38例,并观察疗效,现报道如下。
1 临床资料
1.1一般资料 38例患者均经病理组织学检查确诊,均有影像学可测量病灶。其中男22例,女16例;年龄39~68岁,中位年龄52岁;直肠癌28例,结肠癌10例;其中合并肝转移15例,肺转移10例,骨转移6例,腹腔转移者5例,有肝肺转移2例。本组心电图检测显示正常,肝肾功能、血常规、尿常规以及便常规均基本正常;本组患者PS评分1分,预计生存期超过3个月。
1.2治疗方法 CPT-11 100 mg/m2静脉滴注,第1,8天;替吉奥(鲁南制药生产)40 mg/m2,分2次口服,第1—14天;每3周为1个周期,均治疗2个周期以上。患者化疗中要给予患者合理营养支持,帮助患者增强免疫力,同时给予患者抑酸、保肝治疗,为预防患者呕吐,采用5-羟色胺受体拮抗剂,每个疗程开始前常规进行肝肾功能、血常规及心电图检查,检查治疗期间进行不良反应评估。此外,用药期间要根据患者病情合理选择药物,尤其是禁用促进肠蠕动的药物,饮食要避免极易引起患者腹泻的饮料与食物,并注意及时观察治疗效果,若患者出现延迟性腹泻,立即采用易蒙停治疗,经过48 h治疗效果不佳则要给予生长抑素、抗生素以及补液治疗。如化疗过程中出现中性粒细胞<1.0×109L-1或WBC<2×109L-1,则予以粒细胞集落刺激因子(G-CSF)支持,2个疗程后进行肿瘤病灶评估, 包括盆腔、腹部、胸部CT检查。
1.3疗效评价标准 本组患者疗效严格按照世界卫生组织(WHO)制定的实体瘤疗效评价标准评价,分为完全缓解(CR),部分缓解(PR),稳定(SD),进展(PD),CR+PR为总有效率,CR+PR+SD为疾病控制率。疾病进展时间(TTP) 为开始治疗至肿瘤复发或进展的时间,生存期按月记录,以化疗日至患者死亡或末次随访时间为生存期限。
1.4毒副反应 按照WHO抗癌药物毒性反应分级标准评价,按WHO急性毒性反应分为0~Ⅳ度。
2 结 果
2.1治疗效果评价 本组研究38例患者均顺利完成化疗,共2~8个疗程,平均周期为4个,所有患者均可评价客观疗效。结果CR 0例,PR 14例,SD 12例,PD 12例,总有效率为37%,疾病控制率达68%,TTP 6.9个月,MST为13.5个月。
2.2毒副反应评价 经对患者疗效客观评价,本组治疗方案毒副反应较轻,主要表现为呕吐、恶心、白细胞减少、脱发、乙酰胆碱能症状及延迟性腹泻。白细胞减少多见于化疗后第4—5天,化疗后第7天最低,Ⅲ度以上的骨髓抑制均给予粒细胞集落刺激因子治疗。延迟性腹泻发生率较高,多发生在化疗后第2天,多为Ⅰ~Ⅱ度。其他还有贫血、血小板减少、肝功能异常等。患者可以耐受,无治疗相关死亡患者。见表1。
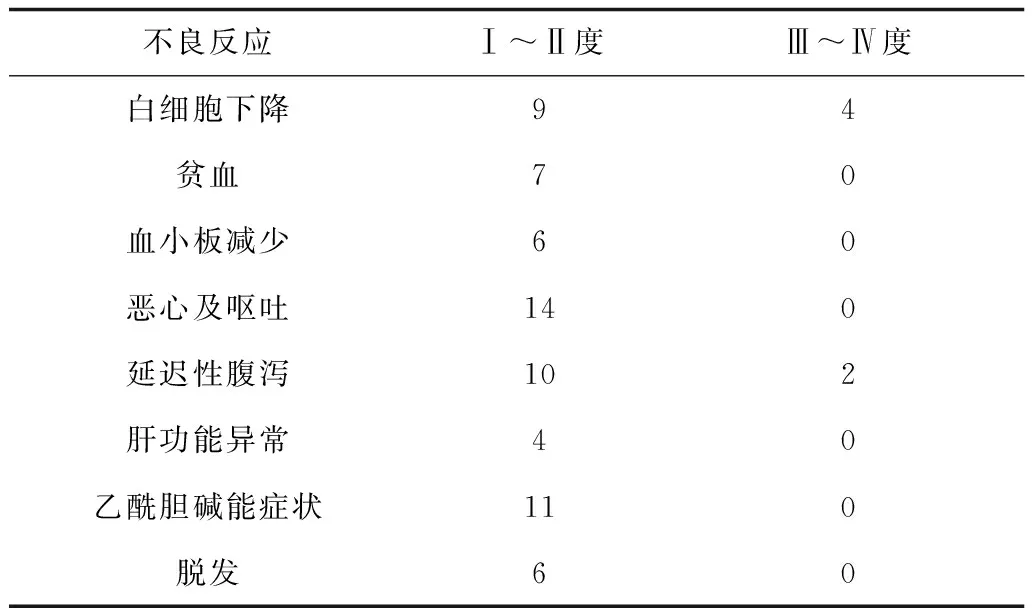
表1 38例患者化疗的不良反应 例
3 讨 论
结直肠癌属于临床常见的恶性肿瘤,相较于其他消化系统肿瘤,其生物学恶性行为比较低,据有关数据统计分析,50%左右的患者经过手术可以治愈。对于转移性结直肠癌,治疗效果较差,目前5年生存率只有5%~8%。治疗以全身化疗为主,5-氟尿嘧啶(5-Fu)一直是晚期结直肠癌化疗的首选药物,FOLFOX4是一线化疗方案,对于FOLFOX4方案治疗失败的患者,目前公认 FOLFIRI优于5- Fu联合CF方案。但该治疗方法也存在着诸多缺点,进而5-Fu的临床应用降低了患者治疗疗效,具体体现在以下方面:①5-Fu临床上采用静脉注射,加上5-Fu半衰期极短,最长达20 min,甚至于6 min,但是临床研究证实:5-Fu细胞毒效应除了与药物峰浓度有直接关系外,还与药物作用时间直接相关。为此,临床为达到药物峰浓度值,多采用静脉持续注射,延长药物作用时间以提高临床疗效,保持有效的AUC。但是埋置给药泵或者深静脉置管成本较高,增加了患者的治疗费用。②5-Fu临床应用不方便,易增加患者感染机会,同时易增加血栓形成、气胸等风险,这样,患者住院时间延长,导致患者无法接受,而且医护人员的劳动强度也随之增加,无形中增加了护理工作量。③组织特异性不高是5-Fu的另一大缺点,尤其会增加消化道黏膜毒性和骨骼抑制毒性,进而限制临床治疗效果和5-Fu治疗水平。
近年来,随着医疗技术水平的提高,医疗治疗手段也得到了很大提升,如近来在临床上普遍应用的替吉奥胶囊,属于新型氟尿嘧啶类口服抗癌药物,该药物由日本Taihu制药公司研制开发,为复方制剂,主要由吉美嘧啶、替加氟和奥替拉西钾3种成分组成,于2003在日本被批准用于临床上治疗结直肠,口服吸收好,具有优良生物利用度,在肿瘤组织内能够维持较高浓度。替加氟的抗肿瘤作用依靠5-Fu,它是在肝微粒体细胞色素P450代谢酶系作用下转变而成[3]。替加氟为5-Fu的前体药物,能在体内转化为5-Fu而发挥其抗肿瘤活性,化疗指数为5-Fu的2倍,毒性仅为5-Fu的1/4~1/7,吉美嘧啶主要作用可以保持5-Fu持续高浓度存在,能够有效地阻止5-Fu的分解代谢,由于该药物成分属于二氢嘧啶脱氢酶抑制剂,大大提升了患者肿瘤与血液组织中5-Fu的药效[4],从而取得与持续静脉滴注类似的效果,增强了抗肿瘤作用。奥替拉西钾则可以减轻药物所带来的毒副作用,患者在口服后,会经过胃肠道吸收,阻止5-Fu磷酸化,而且奥替拉西钾会在患者胃肠道内选择性地作用于乳清酸磷酸核糖转移酶, 能减少5-Fu毒副作用[5-6]。
伊立替康是喜树碱半合成衍生物,与传统的酶抑制剂不同,是拓扑异构酶Ⅰ抑制剂,临床上伊立替康会将核酶转变成对DNA有害的物质,但是其并不会阻碍TopoⅠ的结合。据临床研究表明:伊立替康会导致细胞死亡,致使DNA链发生断裂,直接干扰DNA合成,主要作用于S期,抑制断裂DNA链的再连接。结直肠癌肿瘤组织中TopoⅠ含量明显高于周围正常组织,故对肿瘤组织有较高特异性。其抗瘤活性广谱,同时大肠癌细胞对化疗药存在原发性耐药,同时容易产生继发性耐药,主要与拓扑异构酶高表达有关,而伊立替康对多药耐药的肿瘤依然有效。Douillard等[7]用FOLFIRI方案二线治疗晚期结直肠癌,有效率为35%,中位无进展生存期6.7个月,中位生存期17.4个月。
本实验对FOLFOX4方案失败的患者进行二线治疗,采用替吉奥作为联合伊立替康的药物,结果显示PR 14例,SD 12例,PD 12例,总有效率为37%,疾病控制率为68%,TTP 6.9个月,MST 13.5个月,且大多数患者化疗后症状较前缓解,生活质量改善。该方案更加方便,同时对医疗设备要求更低。
延迟性腹泻、肝功能损害和粒细胞减少为本病化疗最主要的毒副反应。在本研究中未发现Ⅳ度腹泻事件,这与欧美人群不同,考虑亚洲人群可能更适合IRIS方案;另一常见的毒性反应为血液学毒性粒细胞减少症。本组无因化疗毒副反应不耐受退出者,大部分患者用药后临床症状减轻或消失,生活质量明显改善。
综上所述,伊立替康联合替吉奥二线治疗晚期结直肠癌用药方便、疗效肯定、不良反应少,可广泛用于临床。但是本研究样本量小,随访时间短,仍需扩大样本量作进一步观察。
[1] 宋云龙,张万年,季海涛,等. DNA拓扑异构酶Ⅰ结构、功能及喜树碱类抗癌药物研究进展[J]. 中国药学杂志,2002,9(37):646-650
[2] Rougier P,Bugat R,Douillard JY,et al. Phase Ⅱ study of irinotecan in the treatment of advanced colorectal cancer in chemotherapy-naive patients and patients pretreated with fluorouracil-based chemo therapy[J]. J Clin Oncol,1997,15(1):251
[3] Ikeda K,Yoshisue K,Matsushima E,et al. Bioactivation of tegafur to 5- fluorouracil is catalyzed by cytochrome P-450 2A6 in human liver microsomes in vitro[J]. Clin Cancer Res,2000,6(11):4409
[4] Horio T,Tsujimoto H,Akase T,et al. Syndrome of inappropriate antidiuretic hormone secretion following adjuvant CDDP And 5-FU administration in a patient with esophageal carcinoma[J]. Gan To Kagaku Ryoho,2010,37(10):1945
[5] 邰雅宏,朱家沂. 序贯疗法与传统三联疗法根除幽门螺杆菌的临床观察[J]. 实用临床医药杂志,2010,14(5):66
[6] Rudholm T,Wallin B,Theodorsson E,et al. Releaseof regulatory gut peptides somatostatin, neurotensin and vasoactive intestinal peptide by acid and hyperosmolal solutions in the intestinein conscious rats[J]. Regul Pept,2009,152(1/3):8-12
[7] Douillard JY,Cunningham D,Roth AD,et al. Irinotecan combined with fluorouracil compared with fluorouracil alone as first line treatmentfor metastatic colorectal cancer:a multicentre randomised trial[J]. Lancet,2000,355(9209):1041-1047
10.3969/j.issn.1008-8849.2015.30.017
R735.35
B
1008-8849(2015)30-3353-03
2014-09-10

