神经肽Y对小神经胶质细胞活化状态和生成TNF-α的影响
李琦军,吴永波,常军英,侯卫星,邢兆国,王彦志,穆卫庐,李 炎,贾东昭,张淑丽
(1.河北省石家庄市第三医院,河北 石家庄 050011;2.河北省石家庄市公安局法医损伤检验鉴定室,河北 石家庄 050011;3.河北省秦皇岛市骨科医院,河北 秦皇岛 066001)
神经肽Y对小神经胶质细胞活化状态和生成TNF-α的影响
李琦军1,吴永波2,常军英1,侯卫星1,邢兆国1,王彦志1,穆卫庐1,李 炎1,贾东昭1,张淑丽3
(1.河北省石家庄市第三医院,河北 石家庄 050011;2.河北省石家庄市公安局法医损伤检验鉴定室,河北 石家庄 050011;3.河北省秦皇岛市骨科医院,河北 秦皇岛 066001)

目的 探讨神经肽Y(NPY)对原代小神经胶质细胞生物活性及生成肿瘤坏死因子-α(TNF-α)的影响。方法 培养原代大鼠皮质小胶质细胞,经脂多糖(LPS)和NPY处理后行免疫细胞化学荧光染色,显微镜下观察LPS和NPY对小胶质细胞形态学的影响。将小胶质细胞分为对照组、LPS组、NPY+LPS组、NPY组和BIBP3226+NPY+LPS组,每组3个样本,培养各组细胞6 h。ELISA法检测培养液中TNF-α蛋白含量,RT-PCR方法检测小胶质细胞中TNF-α mRNA表达水平。结果 LPS处理后小胶质细胞处于活化状态,NPY处理后的小胶质细胞活化水平降低。LPS组和IBP 3226+NPY+LPS组培养液中TNF-α蛋白含量及细胞中TNF-α mRNA表达水平显著高于对照组(P均<0.05);LPS+NPY组TNF-α蛋白含量和TNF-α mRNA表达水平明显低于LPS组和IBP3226+NPY+LPS组(P均<0.05)。结论 NPY能够降低小神经胶质细胞的生物活性。NPY可能通过激活NPY Y1受体抑制小神经胶质细胞生成TNF-α。
神经肽-Y;小神经胶质细胞;肿瘤坏死因子-α
小胶质细胞是一种广泛分布于中枢神经系统的巨噬细胞。正常状态下,小胶质细胞处于静息状态,在中枢神经系统中起着免疫监视作用。当内环境发生变化时会迅速被激活,激活后的小胶质细胞能够释放白细胞介素1β(IL-1β)和肿瘤坏死因子α(TNF-α)等细胞因子以及活性氧、活性氮、脂类等大量生物活性物质[1-2],这些活性物质的过分释放并积聚于中枢神经系统会导致神经元损伤[3-5]。神经肽Y(NPY)是一种多肽类物质,广泛分布于中枢及周围神经系统,由36个氨基酸组成,与癫痫、学习和记忆都有着密切关系,NPY可以通过其Y2、Y5受体起到保护神经元作用[6]。最近Ferreira等[7]研究表明,NPY可以抑制脂多糖(LPS)所致的小鼠小胶质细胞N9细胞株的激活,减少TNF-α、IL-1β、NO的生成。本实验进一步研究了NPY对体外培养的原代大鼠皮质小胶质细胞的生物活性、小胶质细胞来源的TNF-α生成的影响。现将结果报道如下。
1 实验资料
1.1实验动物 24 h内新生SD大鼠30只[清洁级,河北医科大学实验动物中心提供,动物生产许可证号:SCXK(冀)2013-1-03]。
1.2 主要试剂 小鼠单克隆抗体IBA-1、脂多糖(美国Sigma公司),FITC标记的山羊抗小鼠IgG(美国Proteintech公司),胎牛血清、DMEM/F12培养基(美国Gibco公司), BIBP3226(美国Tocris Bioscience公司),NPY(美国ENZO公司),ELISA试剂盒(中国Bio-Swamp公司),GoldViewⅠ型核酸染料(美国Ameresco公司),Trizol(美国Invitrogen公司),RT-PCR逆转录试剂盒、RNA酶抑制剂(RNasin)、PCR扩增试剂盒、随机引物(美国Promega公司)。
1.3 小胶质细胞培养 参照Nakajima等[8]所述方法。24 h内新生大鼠无菌环境下开颅取脑,剥除脑膜及血管,取部分大脑皮质,剪碎后用0.125%胰蛋白酶37 ℃消化15 min后,反复吹打成悬液,1 000 r/min离心5 min后过滤,弃上清,在沉淀物中加入胶质细胞培养液(胶质细胞培养液为含10%胎牛血清,1 IU/mL青霉素、100 μg/mL链霉素的DMEM/F12培养基制成细胞悬液),接种于250 mL培养瓶中,37 ℃、5%CO2培养。第2天全量换液1次,以后每3 d更换1/2体积培养液。培养至第14天,细胞充分分层生长后,置于37 ℃恒温摇床中180 r/min振摇2 h,收集细胞悬液,1 000 r/min离心5 min,去上清,用DMEM/F12全培养基吹打成细胞悬液,将细胞调至约1×108L-1,种植到预先铺好多聚赖氨酸的六孔板内,每孔3 mL。在恒温培养箱内静置30 min后完全换液1次,去除少突胶质细胞,加入 DMEM/F12完全培养基继续培养3~5 d。
1.4 形态学观察 分离纯化好的小胶质细胞分别以1×104个细胞/皿接种于3个预先放置经多聚赖氨酸处理过的盖玻片的3.5 cm培养皿,24 h后,分别更换为无血清胶质细胞培养液、含LPS(终浓度为100 ng/mL)的无血清胶质细胞培养液和含NPY (终浓度为1 μmol/L)及LPS(终浓度为100 ng/mL)的无血清胶质细胞培养液继续培养6 h, 6 h后取出盖玻片,以IBA-1为一抗,行免疫细胞化学染色,荧光显微镜下观察原代大鼠皮质小胶质细胞形态学变化。
1.5 小胶质细胞分组及处理方法 将分离纯化好的小胶质细胞以2×104个细胞/孔接种于预铺多聚赖氨酸的24孔培养板用于TNF-α蛋白检测,以5×105个细胞/孔接种于6孔培养板用于TNF-α mRNA的检测。培养3 d后换新鲜无血清胶质细胞培养液培养12 h使细胞同步化,然后将细胞分为对照组、LPS组、NPY+LPS组、NPY组和BIBP3226+NPY+LPS组,每组3个样本。对照组细胞以无血清胶质细胞培养液孵育6 h,LPS组细胞以含LPS(终浓度为100 ng/mL)的无血清胶质细胞培养液孵育6 h,NPY+LPS组细胞是先以含NPY(终浓度为1 μmol/L)的无血清胶质细胞培养液孵育0.5 h,然后加入LPS(终浓度为100 ng/mL)继续孵育6 h。NPY组细胞以含NPY(终浓度为1 μmol/L) 无血清胶质细胞培养液孵育6 h。IBP3226+NPY+LPS组细胞先用含NPY Y1受体阻断剂BIBP3226(终浓度为1 μmol/L)的无血清胶质细胞培养液孵育0.5 h,再加入终浓度为1 μmol/L的NPY孵育0.5 h,最后加入终浓度100 ng/mL的LPS继续孵育6 h。
1.6 小胶质细胞培养液中TNF-α蛋白含量的检测 取上述各组小胶质细胞培养液,离心后采用ELISA法检测培养液中TNF-α蛋白含量。
1.7 小胶质细胞中TNF-α mRNA表达水平的检测 采用实时荧光定量PCR法检测上述各组小胶质细胞中的TNF-α mRNA表达水平。小胶质细胞加入Trizol(1 mL/孔),吹打后移至去核酶的离心管中,静置5 min。每管加入0.2 mL氯仿,震荡15 s,静置5 min。12 000 r/min离心15 min,把上层无色液体移到新的离心管中。加入等体积的异丙醇,颠倒混匀。4 ℃ 12 000 r/min离心10 min,管底可见羽毛状白色沉淀物,完全弃去上清。加入1 mL 75%乙醇(DEPC水配置),洗涤沉淀。4 ℃ 7 500 r/min离心5 min,弃上清。静置晾干3~5 min,加入20~30 μL DEPC水充分溶解RNA。1%琼脂糖凝胶电泳证实RNA完整性较好,无污染。紫外分光光度计检测RNA浓度。引物由上海生工生物公司合成。TNF-α和GAPDH的引物序列:TNF-α上游引物为5’-TGCCTCAGCCTCTTCTCATT-3’;TNF-α下游引物为5’-GCTTGGTGGTTTGCTACGAC-3’;扩展长度为208 bp。GAPDH上游引物为5’- TGAACGGGAAGCTCACTGG -3’; GAPDH下游引物为5’- GCTTCACCACCTTCTTGATGTC -3’;扩增长度为120 bp。实时PCR反应中反转录反应体系为:总RNA 8 μL,随机引物1 μL,2×ES Reaction Mix 10 μL,RT/RI Enzyme Mix 1 μL,总体积20 μL。扩增体系为:2×UltraSYBR Mixture(with ROX)10 μL,上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,cDNA 8 μL,总体积20 μL。RT-PCR反应程序参数:预变性95 ℃ 10 min;变性95 ℃ 15 s,退火58 ℃ 20 s,延伸72 ℃ 27 s,40个循环。用ABI 7300 Real-Time PCR System (Applied Biosystems,Foster City,CA,USA)检测并计算目的基因表达量与内参GAPDH比较的相对值(RQ值),结果用于统计分析。

2 结 果
2.1大鼠大脑皮质小胶质细胞的形态学表现 无血清培养液孵育的小胶质细胞呈分枝状外观,胞体较小,有细长的突起(箭头),细胞表达IBA-1,见图1(标尺为25 μm)。含LPS的无血清培养液孵育的小胶质细胞处于活化状态,胞体变为圆形和阿米巴状,突起回缩,IBA-1染色加深(箭头),见图2。提前加入NPY再加入LPS的无血清培养液孵育的小胶质细胞大部分为非活化状态,成多角形,有长的突起(箭头),IBA-1染色阳性,但比LPS组荧光强度明显弱,见图3。各组IBA-1染色阳性细胞均大于90%。
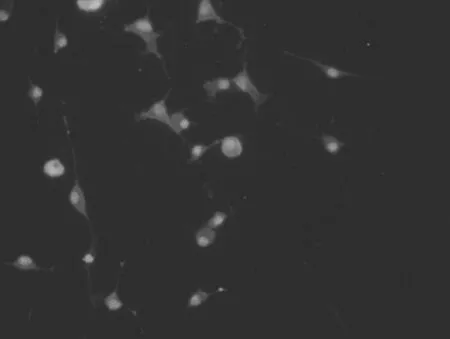
图1 无血清培养基孵育的IBA-1染色后的小胶质细胞 (400×)

图2 含LPS的无血清培养基孵育的IBA-1染色后的小胶质细胞(400×)

图3 含LPS和NPY的无血清培养基孵育的IBA-1染色后的小胶质细胞(400×)
2.2 培养液中TNF-α蛋白含量及小胶质细胞中TNF-α mRNA表达水平的变化 孵育各组小胶质细胞 6 h后,LPS组和IBP3226+NPY+LPS组培养液中TNF-α蛋白含量及小胶质细胞中TNF-α mRNA表达水平均显著高于对照组(P均<0.05),LPS组和IBP3226+NPY+LPS组比较差异均无统计学意义;LPS+NPY组培养液中TNF-α蛋白含量及小胶质细胞中TNF-α mRNA表达水平均显著低于LPS组和IBP3226+NPY+LPS组(P均<0.05)。见表1。

表1 各组培养基中TNF-α蛋白含量及小胶质细胞中TNF-αmRNA相对表达量比较
注:①与对照组比较,P<0.05;②与LPS+NPY组比较,P<0.05。
3 讨 论
自从Besedovsky 提出了免疫-神经-内分泌调节网络学说以来,免疫在神经系统疾病中的作用受到人们越来越多的关注。小胶质细胞广泛分布于中枢神经系统,在免疫功能调节方面起着重要作用。当中枢神经系统发生病理变化时,小胶质细胞能够迅速做出反应,由静止状态变为激活状态,胞体变大,成阿米巴状,特异性标志产物增加,吞噬能力增强。很多资料显示小胶质细胞激活和中枢神经系统很多疾病有关,如阿尔茨海默病、帕金森综合征、脑缺血等中枢神经系统病变[9-10]。小胶质细胞活化后产生大量细胞因子等生物活性物质,如IL-1β、TNF-a、NO等,这些物质的大量积聚会对神经元产生毒害作用,这可能是小胶质细胞活化后导致神经元损伤的重要途径之一。TNF-α是最常见的损伤性细胞因子,也是小胶质细胞激活后释放的前炎症因子,在中枢神经系统多种生理和病理过程中发挥着重要作用。
人体内的神经肽类物质与炎症反应有着较密切的关系。当体内出现炎症反应时会释放一些神经肽类物质,如血管活性肠肽、尿皮质素、胃饥饿素(ghrelin)等[11-13],这些神经肽类物质可以下调机体的免疫应答,诱导T细胞的产生,抑制抗原特异性Th1细胞分化,维持机体免疫耐受,减轻炎症反应[14-16]。NPY是一种广泛存在于中枢神经系统中的神经肽,与癫痫、学习、记忆、摄食和内分泌有着密切关系。NPY通过与不同的受体结合在体内发挥不同的作用,NPY受体都属于G蛋白的耦联受体,在人体内包括Y1、Y2、Y3、Y4、Y5 5种亚型。其Y1受体与机体免疫功能的调节有着密切关系,NPY通过其Y1受体影响细胞迁移、细胞因子的释放、抗体的产生等多个方面[17]。在不同的部位,不同的免疫进程阶段,NPY可能起的作用也不尽相同。周江睿等[18]对原代培养的腹腔巨噬细胞和RAW264.7细胞的研究显示,NPY对炎症因子的调节具有双面性:一方面,NPY能够抑制腹腔巨噬细胞释放炎性因子IL-1β、TNF-α、IL-6 和前列腺素B2;另一方面,NPY能够促进腹腔巨噬细胞晚期炎症因子HMGB1的分泌。Ferreira等[19-20]的研究表明,小鼠小神经胶质细胞株N9细胞表达NPY Y1受体,NPY可以抑制LPS所致N9细胞的激活,减少IL-1β、NO的生成,另一方面,NPY还能抑制N9细胞的吞噬作用和迁移能力,当阻断NPY Y1受体后,这种抑制作用消失。本实验采用LPS为小胶质细胞的激活剂,在LPS处理小胶质细胞6 h后,小胶质细胞处于明显的活化状态,细胞体积增大,突触回缩,由分支状变为圆形、梭形或者阿米巴状,特征性标志物IBA-1免疫染色加深,小胶质细胞的免疫活性也随之增强,小胶质细胞培养液中TNF-α蛋白含量与小胶质细胞中TNF-α mRNA表达水平均明显增高。加入NPY后能够明显抑制LPS对小胶质细胞的激活作用,使大部分小胶质细胞处于非活化状态,降低了小胶质细胞培养液中TNF-α蛋白和小胶质细胞内的TNF-α mRNA表达水平,使用BIBP3226阻断NPY Y1受体后这种抑制作用完全消失,说明NPY是通过Y1受体起到降低小胶质细胞的免疫活性,减少小胶质细胞来源的TNF-α产生的,这与文献[19-20]研究N9细胞株的结果一致。NPY处理非活化的小胶质细胞后,培养液中TNF-α蛋白及小胶质细胞的TNF-α mRNA水平均未发生明显变化,说明NPY对静止期的小胶质细胞影响不大。
综上所述,NPY对中枢神经系统内的小胶质细胞的免疫活性有调节作用,NPY能下调中枢神经系统内小胶质细胞的免疫活性,抑制TNF-α的产生,这种作用是通过其Y1受体实现的。本研究为NPY以小胶质细胞为靶点治疗与免疫有关的中枢神经系统疾病提供了实验依据。
[1] Wu CY,Kaur C,Sivakumar V,et al.Kv1.1 expression in microglia regulates production and release of proinflammatory cytokines,endothelins and nitric oxide[J].Neuroscience,2009,158(4):1500-1508
[2] Mayer AM,Clifford JA,Aldulescu M,et al.Cyanobacterial Microcystis aeruginosa lipopolysaccharide elicits release of superoxide anion,thromboxane B2,cytokines,chemokines,and matrix metalloproteinase-9 by rat microglia[J].Toxicol Sci,2011,121(1):63-72
[3] Auvin S,Mazarati A,Shin D,et al.Inflammation enhances epileptogenesis in the developing rat brain[J].Neurobiol Dis,2010,40(1):303-310
[4] Friedman A,Dingledine R.Molecular cascades that mediate the influence of inflammation on epilepsy[J].Epilepsia,2011,52(s3):33-39
[5] Vezzani A,Maroso M,Balosso S,et al.IL-1 receptor/Toll-like receptor signaling in infection,inflammation,stress and neurodegeneration couples hyperexcitability and seizures[J].Brain Behav Immun,2011,25(7):1281-1289
[6] Noe F,Nissinen J,Pitkänen A,et al.Gene therapy in epilepsy: the focus on NPY[J].Peptides,2007,28(2):377-383
[7] Ferreira R,Xapelli S,Santos T,et al.Neuropeptide Y modulation of interleukin-1β (IL-1β)-induced nitric oxide production in microglia[J].J Biol Chem,2010,285(53):41921-41934
[8] Nakajima K,Takemoto N,Kohsaka S.Retinoic acid enhances the secretion of plasminogen from cultured rat microglia[J].Febs Lett,1992,314(2):167-170
[9] Marinova-Mutafchieva L,Sadeghian M,Broom L,et al.Relationship between microglial activation and dopaminergic neuronal loss in the substantia nigra:a time course study in a 6-hydroxydopamine model of Parkinson's disease[J].J Neurochem,2009,110(3):966-975
[10] Arranz AM,Gottlieb M,Pérez-Cerdá F.Increased expression of glutamate transporters in subcortical white matter after transient focal cerebral ischemia[J].Neurobiol Dis,2010,37(1):156-165
[11] Anderson P,Gonzalez-Rey E.Vasoactive intestinal peptide induces cell cycle arrest and regulatory functions in human T cells at multiple levels[J].Mol Cell Biol,2010,30(10):2537-2551
[12] Gonzalez-Rey E,Delgado M.Vasoactive intestinal peptide inhibits cycloxygenase-2 expression in activated macrophages,microglia,and dendritic cells[J].Brain Behav Immun,2008,22(1):35-41
[13] Gonzalez-Rey E,Ganea D,Delgado M.Neuropeptides: keeping the balance between pathogen immunity and immune tolerance[J].Curr Opin Pharmacol,2010,10(4):473-481
[14] Delgado M,Ganea D.Anti-inflammatory neuropeptides:a new class of endogenous immunoregulatory agents[J].Brain Behav Immun,2008,22(8):1146-1151
[15] Dello Russo C,Lisi L,Navarra P,et al.Diverging effects of cortistatin and somatostatin on the production and release of prostanoids from rat cortical microglia and astrocytes[J].J Neuroimmunol,2009,213(1):78-83
[16] Prasse A,Zissel G,Lützen N,et al.Inhaled vasoactive intestinal peptide exerts immunoregulatory effects in sarcoidosis[J].Am J Respir Crit Care Med,2010,182(4):540-548
[17] Wheway J,Herzog H,Mackay F.NPY and receptors in immune and inflammatory diseases[J].Curr Top Med Chem,2007,7(17):1743-1752
[18] 周江睿,蒋春雷.神经肽Y对巨噬细胞炎症因子和小分子炎症介质的调节及机制研究[D].上海:第二军医大学,2012
[19] Ferreira R,Santos T,Cortes L,et al.Neuropeptide Y inhibits interleukin-1 beta-induced microglia motility[J].J Neurochem,2012,120(1):93-105
[20] Ferreira R,Santos T,Viegas M,et al.Neuropeptide Y inhibits interleukin-1b-induced phagocytosis by microglial cells[J].J Neuroinflammation,2011,8:169
Effect of NPY on the biological activity of microglia and production of TNF-α in these cells
LI Qijun1,WU Yongbo2,CHANG Junying1,HOU Weixing1,XING Zhaoguo1,WANG Yanzhi1,MU Weilu1,LI Yan1,JIA Dongzhao1,ZHANG Shuli3
(1.The Third Hospital of Shijiazhuang,Shijiazhuang 050011,Hebei,China; 2.Forensic Damage Identification Room,the Public Security Bureau of Shijiazhuang,Shijiazhuang 050011,Hebei,China; 3.Orthopedic Hospital of Qinhuangdao,Qinhuangdao 066001,Hebei,China)
Objective It is to explore the effect of NPY on biological activity of primary microglia and the production of TNF-α in the rats.Methods Primary cerebral cortical microglia were cultured and treated with LPS and NPY.Then they were stained by immunocytochemistry staining and the morphological characteristics of microglia was observed with microscope.The microglia were divided into control group,LPS group,NPY+LPS group,NPY group and BIBP3226+NPY+LPS group.Every group had 3 samples and the the cells were cultured for 6 h.The protein levels of TNF-α in the culture media and the mRNA expression levels of TNF-α in the microglia cells of different groups were detected with the methods of ELISA and RT-PCR respectively.Results The microglia treated with LPS kept active,the activity of microglias treated with NPY was lower.The contents of TNF-α in the culture media and the mRNA expression levels of TNF-α in the cells of LPS group increased remarkably compared with control group(P<0.05).Compared with LPS group,the contents of TNF-α in the culture media and the mRNA expression levels of TNF-α in the cells of LPS+NPY group reduced obviously.Compared with LPS+NPY group,the contents of TNF-α in the culture media and the mRNA expression levels of TNF-α in the cells of BIBP3226+NPY+LPS group rose outstandingly (P<0.05).Conclusion NPY can restrain the biological activity of microglia cells.NPY can reduce the production of TNF-α of microglia cells,Activation of NPY Y1 recepter on the microglia cells may be one of the reasons.
neuropeptide Y; microglia; TNF-α
李琦军,男,副主任医师,博士,从事创伤骨科研究工作。
邢兆国,E-mail:13832121438@163.com
10.3969/j.issn.1008-8849.2015.13.006
R-332
A
1008-8849(2015)13-1384-04
2014-10-10

