基于明胶-碳纳米管构建癌胚抗原免疫传感器的研究
朱宇萍,冯晓清
(内江师范学院化学化工学院,四川内江641112)
基于明胶-碳纳米管构建癌胚抗原免疫传感器的研究
朱宇萍*,冯晓清
(内江师范学院化学化工学院,四川内江641112)
利用纳米金与明胶-碳纳米管 (MWCNTs)复合物固载癌胚抗体制得较高灵敏度的电流型癌胚抗原(CEA)免疫传感器。首先将制得的明胶-碳纳米管复合物修饰在金电极表面成膜,再利用明胶中丰富的氨基吸附纳米金,并通过静电吸附作用吸附癌胚抗体(anti-CEA)。实验过程中采用循环伏安法对电极的修饰过程及响应性能进行表征。结果表明,制得的免疫传感器对癌胚抗原有良好的电流响应,其线性范围为0.1~80.0 ng/mL,检出下限为0.03 ng/mL。
免疫传感器;癌胚抗原;纳米金;碳纳米管;明胶
0 前言
免疫传感器是生物传感器诸多分类中的一类,它利用抗体与抗原之间的免疫应答机理,将其中之一修饰到换能器内(或表面),能够对复杂体系中相应的免疫组分进行检测。由于它具有选择性好、灵敏度高、分析速度快、成本低以及容易在线活体检测等优点,在临床医学、环境工业、食品加工及生产产业等方面都有着重要应用[1]。目前,对人体血清中癌胚抗原的检测大部分以临床实验为主。传统免疫方法有放射免疫法、酶联免疫法、荧光免疫分析法,但这些分析方法存在一些弊端,如操作复杂、耗时,仪器设备精密度要求高,有潜在危险或材料昂贵[2]。与上述检测癌胚抗原的传统方法相比较,电化学免疫分析方法具有操作简便,选择性强,成本较低且省时,还可直接检测等优点[1]。近年来,免疫传感器的研究已十分普遍,其构建方式被研究者们广泛关注。
纳米材料由于具有优异的化学和物理性能,如较高的比表面积,较高的表面自由能、吸附浓缩效应。这些优良的性能有利于提高敏感分子的吸附能力和生化反应的速率,因此被广泛运用于生物传感器[3]。
纳米金颗粒(nano-Au)具有比表面积大、表面反应活性高、表面活性中心多、催化效率高、吸附能力强等性能。良好的生物共容性和稳定性,可用于固载和标记生物蛋白质[4]。此外,蛋白质分子带正电荷可以通过静电吸附作用结合带负电荷纳米金,并能够保持蛋白质的生物活性[5],因而可利用纳米金吸附癌胚抗体(anti-CEA),制得灵敏度较高的免疫传感器。
碳纳米管(MWCNTs)是一种可用于修饰电化学传感器的优良纳米材料。这是由于其比表面积大,易于向修饰电极中引入多种官能团,使MWCNTs应用于修饰电极中能够降低电极的氧化过电势、增加氧化峰的电流值、改善电化学传感器的性能、提高选择性和灵敏度等[6]。
明胶(Gelation)是肽分子聚合物,分子量一般在几万到几十万,既具有酸性又具有碱性,是一种两性物质。其分子在结构上有大量的羟基、羧基和氨基,这就使得明胶具有极强的亲水性,且明胶不溶于有机溶剂和冷水,具有较好的成膜能力[7]。
结合Gelation和MWCNTs的优点,将明胶溶于温水中,作为MWCNTs的分散介质。碳纳米管能够很好的被明胶包裹,并均匀的分散在整个基体中[8]。明胶还能够使纳米材料表面氨基(-NH2)功能化,以便联结其它成分[7]。制备明胶-碳纳米管复合物(Gelation-MWCNTs)并将其修饰在金电极表面。碳纳米管可有效增大比表面积,明胶含有大量-NH2且具有较好的成膜能力,形成的明胶-碳纳米管复合物能够大量的吸附纳米金,能固载更多的癌胚抗体。
1 实验部分
1.1 仪器与试剂
仪器:CHI660C电化学工作站(上海辰华仪器公司)、BRANSONIC200超声清洗仪 (德国)、AB204--S电子天平 (瑞士Mettler-toledo公司)、MP230酸度计(瑞士Mettler-toledo公司)、金电极(Φ=4 mm)、铂电极、饱和甘汞电极、恒温水浴锅、所有玻璃仪器均用铬酸洗液浸泡,再超声洗涤并晾干。
试剂:癌胚抗原定量检测试剂(博赛生物有限公司)、明胶、碳纳米管、氯金酸、柠檬酸三钠、固体K3Fe(CN)6、K4Fe(CN)6、KCl、NaH2PO4、Na2HPO4· 12H2O、无水乙醇等。实验用水均为去离子水。
1.2 免疫传感器的制备
1.2.1 Gelation-MWCNTs复合物的制备
称取0.05 g Gelation固体颗粒加入2 mL去离子水,在50℃水浴中加热并振荡,使明胶溶解。趁热加入约5 mg MWCNTs充分混合,超声0.5 h后即制得Gelation-MWCNTs复合物[9]。
1.2.2 nano-Au颗粒的制备
在 100 mL去离子水中加入 1 mL 1%(w) HAuCl4溶液,煮沸,再迅速加入4 mL 1%(w)柠檬酸钠(Na3C6H5O7)溶液,继续煮沸15 min,冷却至室温,即得nano-Au颗粒,该颗粒粒径为16 nm[10]。取3 mL制得的纳米金溶液离心沉降5 min后,用滴管吸走上层清液,既得浓缩nano-Au,保存在4℃冰箱中备用。
1.2.3 修饰电极的制备
依次用0.3 μm、0.5 μm的Al2O3糊将金电极(Φ=4 mm)抛光成镜面,用去离子水冲洗除去表面的抛光粉,依次用去离子水、无水乙醇、去离子水超声清洗5 min,室温下晾干备用。
将所制得的Gelation-MWCNTs复合物用微量取量计取出10 μL滴涂于预处理好的电极表面,待其电极表面成膜后,再取20 μL浓缩nano-Au溶胶滴涂在上述修饰电极表面,自然晾干。将修饰好的电极置于癌胚抗体(anti-CEA)溶液中,在4℃下放置16 h。最后将修饰好的电极浸泡在0.25%(w)的牛血清白蛋白(BSA)溶液中约30 min,使电极上的非特异性吸附位点封闭,即制得癌胚抗原免疫传感器。将其置于4℃冰箱中,备用。图1为免疫传感器制备过程示意图。
1.3 检测方法
实验对电极的制备过程采用三电极体系以循环伏安法(Cyclic voltammograms)进行表征。饱和甘汞电极为参比电极,铂电极为对电极,被修饰的金电极为工作电极,电极表征在5 mmol/L K3Fe(CN)6+K4Fe(CN)6+0.1 mol/L KCl+0.1 mol/L PBS(pH=7.4)溶液中进行,循环伏安法电位区间为-0.2~0.6 V,扫描速率为50 mV/s,实验温度若未做说明均为25℃。
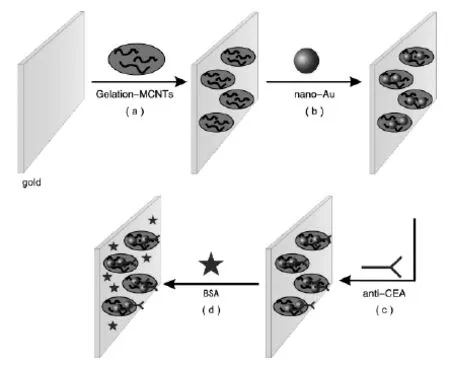
图1 免疫传感器的制备过程示意图Fig.1 Schematic diagram of the stepwise immunosensor construction process
2 结果与讨论

图2 电极修饰过程的循环伏安表征(a)裸Au电极;(b)Au/MWCNTs-Gelatin;(c)Au/ MWCNTs-Gelatin/nano-Au;(d)Au/MWCNTs-Gelatin/ nano-Au/anti-CEA;(e)Au/MWCNTs-Gelatin/nano-Au/ anti-CEA/BSA;(f)孵育20 ng/mL CEAFig.2 Cyclic voltammograms of different electrodes
2.1 电极在修饰过程的电化学表征
对电极修饰过程中不同阶段的电化学特性用CV进行表征,结果见图2。曲线a是裸金电极在铁氰化钾溶液中的CV表征图。从图中可见,曲线a出现一对准可逆的氧化还原峰,这是由于测试底液中含有 Fe3+/Fe2+氧化还原电对;将Gelation-MWCNTs复合物滴涂于金电极表面后,由于复合物中Gelation在一定程度上阻碍了电子传递,导致氧化峰电流有所降低[9](图2b);通过明胶表面上的-NH2将nano-Au吸附到修饰电极上,由于nano-Au有利于电子在电极与测试底液中传输,从而使氧化峰电流升高[10](图2c);由于nano-Au与anti-CEA之间存在着静电吸附作用,故可利用nano-Au使anti-CEA固定在电极表面。因蛋白质大分子在一定程度上阻碍了电子的传输,氧化峰的电流值减小[11](图2d);再利用BSA封闭电极表面的非特异性吸附位点,氧化峰电流继续降低 (图2e);最后将修饰好的免疫传感器在 20 ng/mL的CEA抗原中孵育一定时间,当溶液中CEA和电极表面的anti-CEA特异性结合后,生成的抗原-抗体复合物使修饰电极表面的电子传输通道部分堵塞,因而其响应电流进一步下降[11](曲线f)。
2.2 实验条件的优化
2.2.1 扫描速度的优化
将修饰电极置于pH为7.4的5 mmol/L K3Fe (CN)6+K4Fe(CN)6+0.1 mol/L KCl的测试底液中,分别于50、100、150、200、300、400、500、600 mV/s的扫描速度下进行扫描,见图3。还原峰电流值与扫描速度的平方根两者之间成反比例关系,即扫描速度越大,其还原峰电流值越小,反之则越大。这就表明电极上的氧化还原反应要受扩散过程的影响[11]。

图3 修饰电极峰电流与扫速的关系曲线,插图为不同扫速下的循环伏安图Fig.3 plot of peak current vs scan rate; Inset:Cyclic voltammograms of the immunoelectrode at different rate
2.2.2 缓冲溶液pH的优化
测试底液的pH对抗原抗体的活性和亲和性均有影响。pH过低会使抗原-抗体缔合物解离;而pH接近蛋白质的等电点时,会引起蛋白质的自凝现象,造成假阳性结果。 因此,维持测试底液适当的pH是抗原与抗体的结合的必要条件之一[12]。实验选择测试底液pH值分别为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.4、8.0下用CV法表征其对应的峰电流值(见图4)。当pH在4.0~7.4的范围时,pH越大,还原峰的峰电流值越大。当pH大于7.4后,若继续增加pH值,还原峰电流值又会降低。因此实验选择测试底液pH为7.4。
2.2.3 抗原孵育温度的优化
温度对抗原抗体的免疫反应具有重要的影响。温度低时,免疫蛋白活性较低,免疫反应速度缓慢,时间较长;温度较高时,免疫蛋白活性增加,免疫反应速度较快,时间较短;但当温度过高时,免疫蛋白会失活,故控制适当的温度对免疫反应有重要的影响[9]。图5为免疫传感器分别在15、20、25、30、35、37、40、45℃温度下孵育20 ng/mL抗原的还原峰电流值与温度的关系。由图可见孵育温度为30℃时还原峰电流值最小,此时癌胚抗体对抗原结合的较快且较稳定,响应曲线较好,因此该免疫传感器最佳孵育温度为30℃。但在实际应用中由于考虑到免疫传感器的保存问题,长期置于30℃的工作环境下,蛋白质大分子易失活,故实际操作中一般选择25℃为工作温度。

图4 pH值对免疫传感器的影响Fig.4 The effect of pH on the response of immunosensor
2.2.4 抗原孵育时间的优化
抗原孵育的时间直接影响抗原与抗体结合的程度[11]。对同一支修饰电极在20 ng/mL的CEA中分别孵育3、5、8、10、12、15、20、25 min,然后进行CV表征。还原峰电流与孵育时间的关系见图6。由图可知,当孵育时间为15 min时,还原峰具有最大峰电流值,即抗原与抗体反应最充分,电极上结合的抗原量达到饱和,因此实验的最佳孵育时间为15 min。

图5 不同孵育温度下免疫电极的响应峰电流值Fig.5 The effect of incubation temperature on the response of the immunosensor

图6 峰电流值与孵育时间的关系Fig.6 The effect of incubation time on the response of the immunosensor
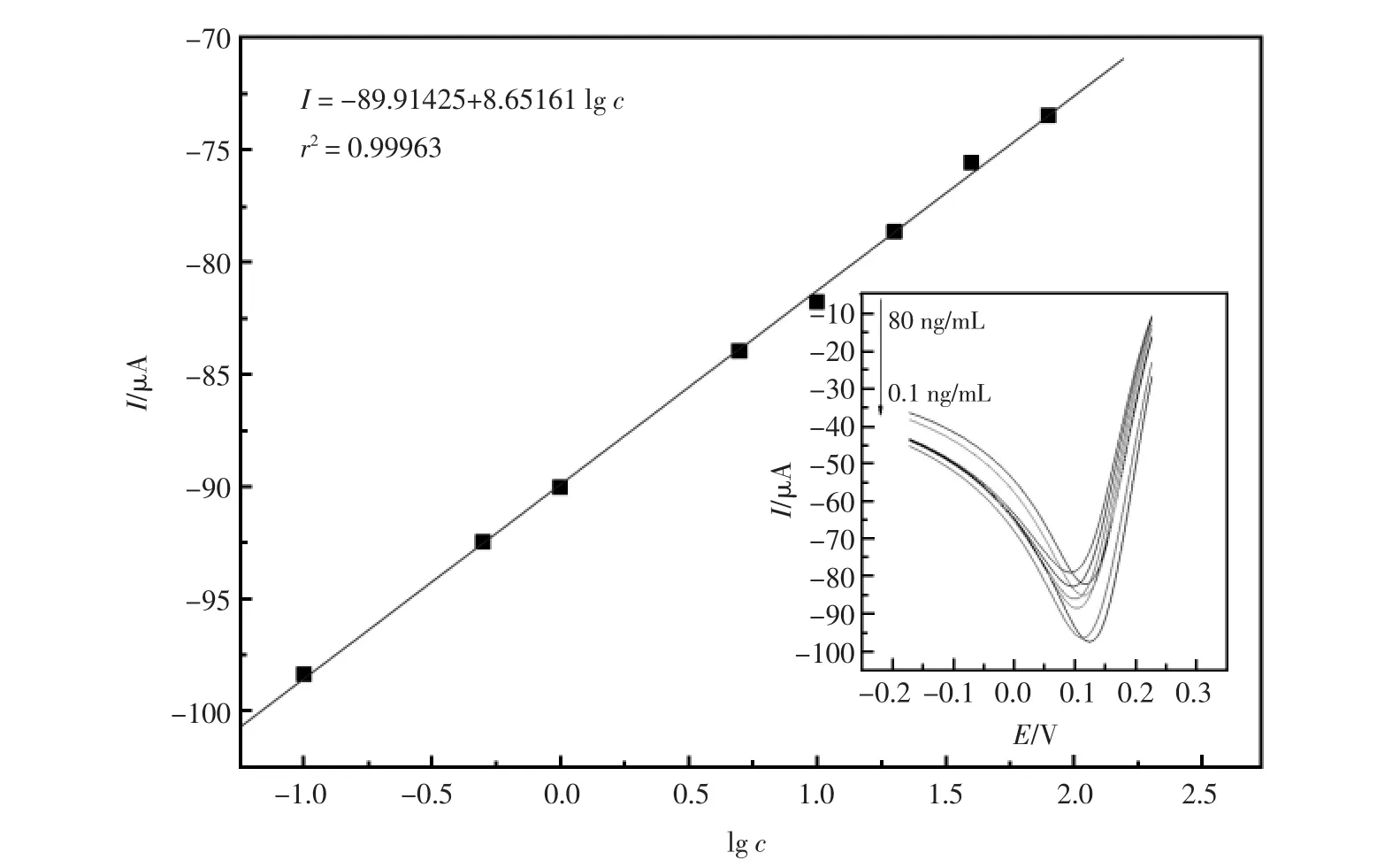
图7 峰电流响应值与浓度的关系曲线(插图为免疫传感器在不同浓度CEA下的循环伏安图)Fig.7 Linear relationship between the peak current and Cyclic voltammograms of the immunoelectrode in different concentration of CEA Insert:Cyclic voltammograms of the immunoelectrode in different concentration of CEA
2.3 免疫传感器的响应特性
2.3.1 免疫传感器对CEA抗原的响应曲线
在最优化的条件下,将免疫电极依次孵育浓度为 0.1、0.5、1.0、5.0、10.0、20.0、40.0、80.0 ng/mL的CEA抗原溶液,并用CV表征,测得其还原峰峰电流与浓度的关系。图7为该免疫传感器还原峰电流值与抗原浓度的对数值呈线性关系。线性关系式为I=-89.87194+8.62307 lg c;相关系数r2=0.99963;检出范围为0.1~80.0 ng/mL;检出限为0.03 ng/mL。在一定浓度范围内,浓度越高,抗体与抗原结合的越多,则电极表面的电子传输通道阻塞的越多,则还原峰峰电流值增加[11]见图7插图。
2.3.2 免疫传感器的选择性
模拟人体环境存在的L-谷氨酸(C5H9NO4)、甘氨酸 (C2H5NO2)、牛血清蛋白等干扰物质与CEA抗原的混合溶液,将制备好的同一免疫传感器先后置于只含20 ng/mL CEA抗原标准溶液和含20 ng/mL CEA抗原以及干扰物质的混合溶液中依次孵育15 min,分别进行CV表征见图8。曲线a表示有干扰物质存在时的响应曲线,b表示无干扰物质存在时的响应曲线,两者并无明显差别,故该免疫传感器具有良好的选择性。
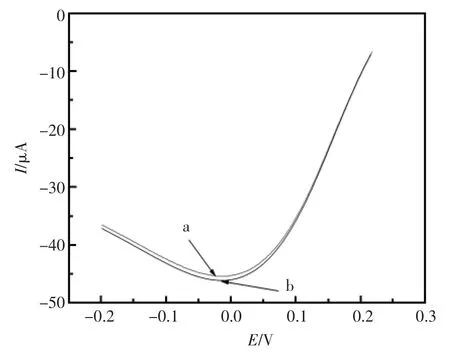
图8 干扰物质对免疫电极响应曲线的影响a:20 ng/mL CEA抗原+干扰物质;b:20 ng/mL CEA抗原Fig.8 Effects of interfering substances on the response curve of the Immunosensor
3 结论
实验首先制得Gelation-MWCNTs复合物,通过Gelation表面的-NH2结合nano-Au,再利用nano-Au静电吸附anti-CEA成功制备了癌胚免疫传感器。该传感器具有灵敏度高、制作简单、响应时间快、选择性强、检测下限低,成本低等特点。此外,实验中采用的原料明胶价廉易得且无污染,取代了一般用于电化学免疫传感器中较贵的原料。在实验中,以CEA作为免疫物质模型,实现了对CEA的定量检测。同时该方法也可应用于其他免疫物质的测定,在临床诊断方面有着潜在的应用价值。
[1]张海锋,张小水,王丽娟,等.生物传感器的研究现状、应用及前景[J].计测技术,2006,26:92-96.
[2]Tobi M,O’Kieffe D,Trujillo N,et al.Steinberg WM.Detection of carcinoembryonic antigen in colonic effluent by specific anti-CEA monoclonal antibodies[J].Cancer Lett.,1992,67(5):47-54.
[3]缪煌清,刘仲明,官建国.纳米科技在生物传感器中的应用[J].传感器技术,2002,21(7):61-64.
[4]刘艳,王卫芬.纳米金在电化学免疫传感器中的应用[J].长江大学学报(自然科学版),2010,7(3):460-462.
[5]王潇蕤,周敬良,张艳丽,等.基于纳米金增强吸附伏安分析的电化学免疫传感技术用于蛋白分子检测[J].化学传感器,2009,29(2):18-24.
[6]李玲,王海燕,孙东艳.基于碳纳米管的脂质体电化学发光免疫传感器检测人体免疫球蛋白G[J].分析化学研究简报,2010,38(9):1329-1332.
[7]郭玮.浅谈明胶[J].中国科技术语,2012,4(2):40-45. [8]巩方玲,黄明智.明胶表面活性的研究[J].明胶科学与技术,2000,20(3):314-315.
[9]易斌,陈小华,陈传盛.新型明胶基碳纳米管骨架活性炭的制备[J].湖南大学学报(自然科学版),2010,3:57-61.
[10]朱宇萍,袁若,柴雅琴,等.基于碳纳米管/L-半胱氨酸/ Fe3O4@Au纳米复合材料的电流型甲胎蛋白免疫传感器的研究[J].分析化学,2012,40(3):359-364.
[11]朱宇萍,袁若,柴雅琴,等.基于纳米金与牛血清蛋白—二氧化钛复合物固定甲胎蛋白免疫传感器的研究[J].内江师范学院学报,2011,26(4):45-46.
[12]闵丽根,袁若,柴雅琴,等.基于纳米金与碳纳米管-纳米铂-壳聚糖纳米复合物固定癌胚原免疫传感器的研究[J].化学学报,2008,66(14):1676-1680.
Study on construction of An immunosensor for carcinoembryonic based on carbon nanotube-gelatin composite
Zhu Yu-ping*,Feng Xiao-qing
(College of Chemistry and Chemical Engineering,Neijiang Normal University,Neijiang 641112,China)
A highly sensitive amperometric immunosensor for the determination of carcinoembryonic antigen(CEA) was construted with the comprised of gelatin,muti-wall carbon nanotubes(MWCNTs).At first,place the prepared gelatin-carbon nanotube composites on the gold electrode surface.Then,absorb the nano-Au by the numerous amino of gelatin and anti-CEA by electrostatic adsorption on its surface successively.In the experiment,the perparing process of the immunosensor was characterized by the cyclic voltammetrys.The results show that the immunosensor present highly sensitivity,with a linear range of 0.1~80.0 ng/mL and a detection limit of 0.03 ng/mL.
immunosensor;CEA;nano-Au;MWCNTs;gelatin
四川省教育厅科研项目(15ZA0292)
*通信联系人,Tel:13696067037,E-mail:judy20060830@163.com

