基于二氧化硅-壳聚糖纳米复合物构建免疫传感器的研究
朱宇萍,许 琼
(内江师范学院化学化工学院,四川内江641112)
基于二氧化硅-壳聚糖纳米复合物构建免疫传感器的研究
朱宇萍*,许 琼
(内江师范学院化学化工学院,四川内江641112)
首先制备二氧化硅(SiO2)-壳聚糖(chitosan,Cs)纳米复合物。将其修饰在玻碳电极表面,利用纳米SiO2高的表面能和多孔结构吸附电子媒介体硫堇(Thi)。通过Thi中的氨基吸附纳米金(nano-Au),从而固载甲胎蛋白抗体(anti-AFP),并用牛血清白蛋白(BSA)封闭非特异性吸附位点,成功制得一种新型的甲胎蛋白免疫传感器。在最优实验条件下,该免疫传感器在检测范围:0.01~1.0 ng/mL和5~200 ng/mL内呈现良好线性关系,检测下限为0.003 ng/mL。结果表明,该免疫传感器灵敏度高,制备方法简易。
免疫传感器;甲胎蛋白;二氧化硅;壳聚糖;纳米复合物
0 引言
电化学免疫传感器具有高特异性、高灵敏度、精确测量、操作简单、分析快速、便宜和仪器小型化等优势,是生物化学分析的研究热点。在临床诊断,医疗保健,环境监测,食品安全等领域得到广泛应用[1]。修饰材料的选择及其固载方法是成功制备免疫传感器的关键[2]。
纳米二氧化硅(SiO2)粒径小,具有三维网状结构。它比表面积大、表面吸附力强、表面含有丰富的羟基[3]。并具有生理惰性,能保证生物分子的活性[4]。因此,在免疫感器领域被广泛应用。有研究将金属纳米材料与其它纳米材料制备成纳米复合物,用于免疫传感器的研究。使得免疫传感器峰电流信号增强,稳定性提高[5]。硫堇(Thi)分子中含有两个氨基,带正电,是良好的电子媒介体,可作氧化还原探针。同时,在酸性条件下,Thi单体分子可以聚合形成多孔高聚复合膜,这种多孔高聚硫堇复合膜的稳定性好,比表面积大,是优良的固定基质。可将其用于增强抗体的吸附量, 提高免疫传感器的灵敏度[6]。 壳聚糖(Chitosan;Cs)是甲壳素(Chitin)脱去其中一部分乙酰基后的产物,具有优异成膜性、透气性、吸附性和渗透性,作为一种良好的成膜材料在传感器研究领域被广泛应用[7]。金属纳米颗粒则具有高的催化性、选择性[8]、生物相容性好、吸附性强[6]等特点,广泛应用于免疫传感器的研究。纳米金是典型的金属纳米材料。实验首先制备纳米SiO2,并将它与Cs制备成纳米复合物。再将其修饰在玻碳(GCE)电极表面。然后利用纳米SiO2高的表面能和多孔结构[9],以及所含羟基与氨基反应,吸附电子媒介体Thi[6]。Thi带有双功能团,带正电,可吸附带负电的纳米金颗粒,从而吸附甲胎蛋白抗体蛋白质(anti-AFP)。该制备方法操作简便,成功率高。制备的甲胎蛋白免疫传感器灵敏度高,选择性强。
1 实验部分
1.1 仪器与试剂
CHI660C电化学工作站 (上海辰华仪器公司 ),BRANSONIC200超 声 清 洗 仪 (德 国BRANSONUL-TRASCHALL公司),FA2004A电子天平 (上海精天电子仪器有限公司),TL-5.0W台式离心机(上海市离心机械研究所有限公司)。
氨水(体积分数25%),无水乙醇,正硅酸乙酯(TEOS),氯金酸(武汉兴众诚股份有限公司),柠檬酸三钠(成都科龙化工试剂厂),磷酸二氢钠,磷酸氢二钠,氯化钾,硫堇(青岛正业试剂仪器有限公司),以上试剂如未加说明,均为分析纯。壳聚糖,甲胎蛋白诊断试剂盒(郑州博赛生物技术股份有限公司),牛血清白蛋白(BSA),去离子水。
1.2 纳米金的制备
将0.0300 g氯金酸溶于100 mL去离子水中,加热至沸腾,搅拌下滴加1%(w)的柠檬酸钠溶液2 mL(先滴加6滴,搅拌,沸腾2 min后继续滴加剩余溶液)。持续沸腾15 min后,停止加热。继续搅拌至室温,得到玫红色纳米金溶胶[10]。
1.3 纳米二氧化硅的制备
将12 mL体积分数为25%的氨水和100 mL无水乙醇混合。在35℃,超声条件下,以0.4 mL/min的速度滴入6 mL TEOS,滴加完后再超声5 min即得粒径均一的纳米二氧化硅纳米粒子[11]。
以10000 r/min进行高速离心10 min,倒掉上清液,用去离子水洗涤至亚中性,最后用去离子水定容至刚开始体积,保存待用。
1.4 二氧化硅-壳聚糖纳米复合物的制备
将0.0100 g Cs溶于5 mL醋酸中,室温搅拌至溶解。用NaOH溶液调节pH在4.0~5.0。将已制备好的纳米SiO2溶液5 mL,加入其中,搅拌8 h,即得SiO2-Cs纳米复合物。
1.5 免疫传感器制备过程
玻碳电极 (GCE,Φ=4 mm)经0.3 μm,0.05 μm的Al2O3糊抛光后用蒸馏水冲洗干净。再依次用去离子水,无水乙醇,去离子水分别超声5 min后取出,室温下晾干备用。取制备好的SiO2-Cs纳米复合物10 μL,用微量取样器滴加在处理过的电极表面。室温下自然晾干后,向该修饰电极表面滴加10 μL Thi,室温下晾干。将上述电极表面滴涂20 μL nano-Au溶胶,室温下晾干。最后,将其侵泡在anti-AFP溶液中6 h后取出,用BSA封闭30 min,最后用去离子水洗涤晾干。在4℃条件下保存备用。修饰电极制备过程如图1。
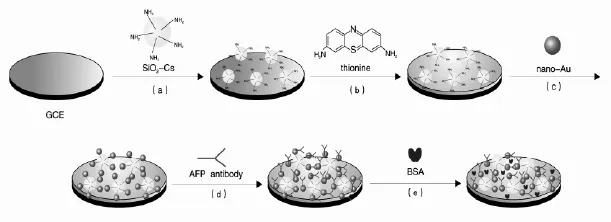
图1 免疫传感器的制备过程Fig.1 Immune sensor preparation process
1.6 检测方法
用循环伏安法(Cyclic Voltammetry,CV)对免疫传感器不同过程进行扫描。工作采用三电极体系,其中修饰电极为工作电极,甘汞电极为参比电极,铂电极为对电极。 实验时以0.1 mol/L(pH6.0)磷酸缓冲液(PBS)作为测试底液,在-0.4 V~0.2 V电压范围内扫描,扫描速度为50 mV/s。不另加说明,温度均为25℃。
2 实验结果与讨论
2.1 电极在不同修饰过程的电化学表征
利用电化学工作站(CHI660C)中CV技术对电极在不同修饰过程中进行表征,见图2。图2中曲线a为裸(GCE)电极。由于玻碳电极不导电,测试底液中无电活性物质,此时没有出现氧化还原峰[12]。曲线b为电极表面修饰了SiO2-Cs纳米复合物的CV图。SiO2-Cs纳米复合物不利于电子传输,因此也没有出现氧化还原峰。曲线c为修饰了Thi之后的CV图。 从图中明显可见,电压在-0.2 V~-0.1 V范围内出现了一对准可逆的氧化还原峰,此峰为Thi特征峰[7],因为Thi是一种良好的电子媒介体。同时也表明Thi成功修饰在电极表面。曲线d为修饰了nano-Au之后的CV图。由图可见,氧化还原峰峰电流值明显增大。这是由于nano-Au能促进电子传输,使得峰电流值增大[12];曲线e、f、g分别为浸泡anti-AFP、BSA,孵育20 ng/mL AFP之后的CV图。可以看出氧化还原峰值逐渐减小。这是由于anti-AFP、BSA、AFP均为蛋白质大分子,会阻碍电子传输,使得峰电流值下降[13]。
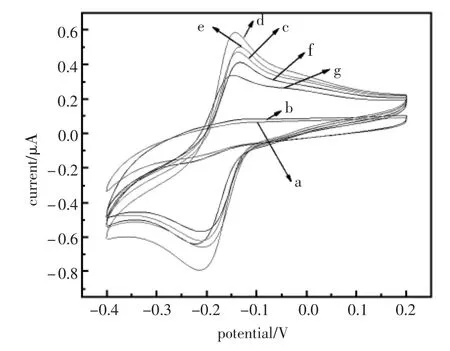
图2 修饰电极制备过程的循环伏安图Fig.2 Cyclic voltammograms of the immunoelectrode preparation paocess(a)GCE;(b)SiO2-Cs/GCE;(c)Thi/SiO2-Cs/GCE;(d)nano-Au/ Thi/SiO2-Cs/GCE;(e)anti-AFP/nano-Au/Thi/SiO2-Cs/GCE; (f)BSA/anti-AFP/nano-Au/Thi/SiO2-Cs/GCE;(g)AFP/BSA/ anti-AFP/nano-Au/Thi/SiO2-Cs/GCE

图3 免疫电极在不同扫速下的循环伏安图Fig.3 Cyclic voltammograms of the immunoelectrode at different scan rate
图3为免疫传感器在0.1 mol/L(pH=6.0)的PBS中,扫速分别为50、100、150、200、250、300、350、400 mV/s(从内到外)下的CV图。由图可见,随着扫速的增大,氧化还原峰值不断增加。在50~ 400 mV/s扫速范围内氧化还原峰电流值与扫速均呈良好线性关系(见插图),相关系数分别为:0.9996和0.9991,说明电极氧化还原受表面吸附的影响[6]。
2.2 实验条件的优化
2.2.1 测试底液酸度的选择
测试底液的pH将影响抗体、抗原的活性,同时还会影响抗原抗体特异性结合。试验用CV扫描了测试底液PBS的pH在4.0~8.0范围内,免疫传感器的响应性能。图4为免疫传感器在不同pH值下扫描的CV。由图可得,随着pH逐渐增大,氧化还原峰电流值逐渐减小。并且,pH值达到6以后,电流值趋于平稳。同时,氧化峰、还原峰电位随着pH的增大负移。说明H+浓度大有利于电子媒介体Thi发生氧化还原反应[14]。但酸度太大会影响生物分子的活性。因此,实验选择pH为6.0。

图4 免疫电极在不同pH值下的循环伏安图Fig.4 Cyclic voltammograms of the immunoelectrode in different pH

图5 免疫传感器在不同孵育时间下的CVFig.5 Cyclic voltammograms of the immunoelectrode in different incubation time
2.2.2 孵育时间的选择
免疫反应受孵育时间的影响。在实验中,将已制备好的修饰电极放入20 ng/mL AFP抗原溶液中孵育,依次测定孵育时间分别为1、3、5、7、10、12、15、20 min CV图。图5插图即为孵育不同时间后所测循环伏安图,可看出随着时间的增长,氧化峰电流值逐渐减小,峰电流值变化较大。但在12 min以后,峰电流变化较小,说明此时免疫反应达到平衡,抗体吸附抗原达到饱和[15]。故选择12 min为最佳孵育时间。
2.2.3 孵育温度的选择
抗体,抗原的活性同样也受温度的影响。实验中固定抗原浓度为20 ng/mL,测试底液pH= 6.0,孵育时间12 min,改变孵育温度,用CV扫描。从图6中可见,在一定温度范围内随着温度的升高,氧化峰值减小。说明在适宜温度范围内,温度越高越有利于吸附抗原。但当温度达到35℃后,峰电流值基本不变,说明此时免疫反应达到平衡[10]。考虑温度过高,会影响蛋白质活性,选择室温25℃作为反应条件。
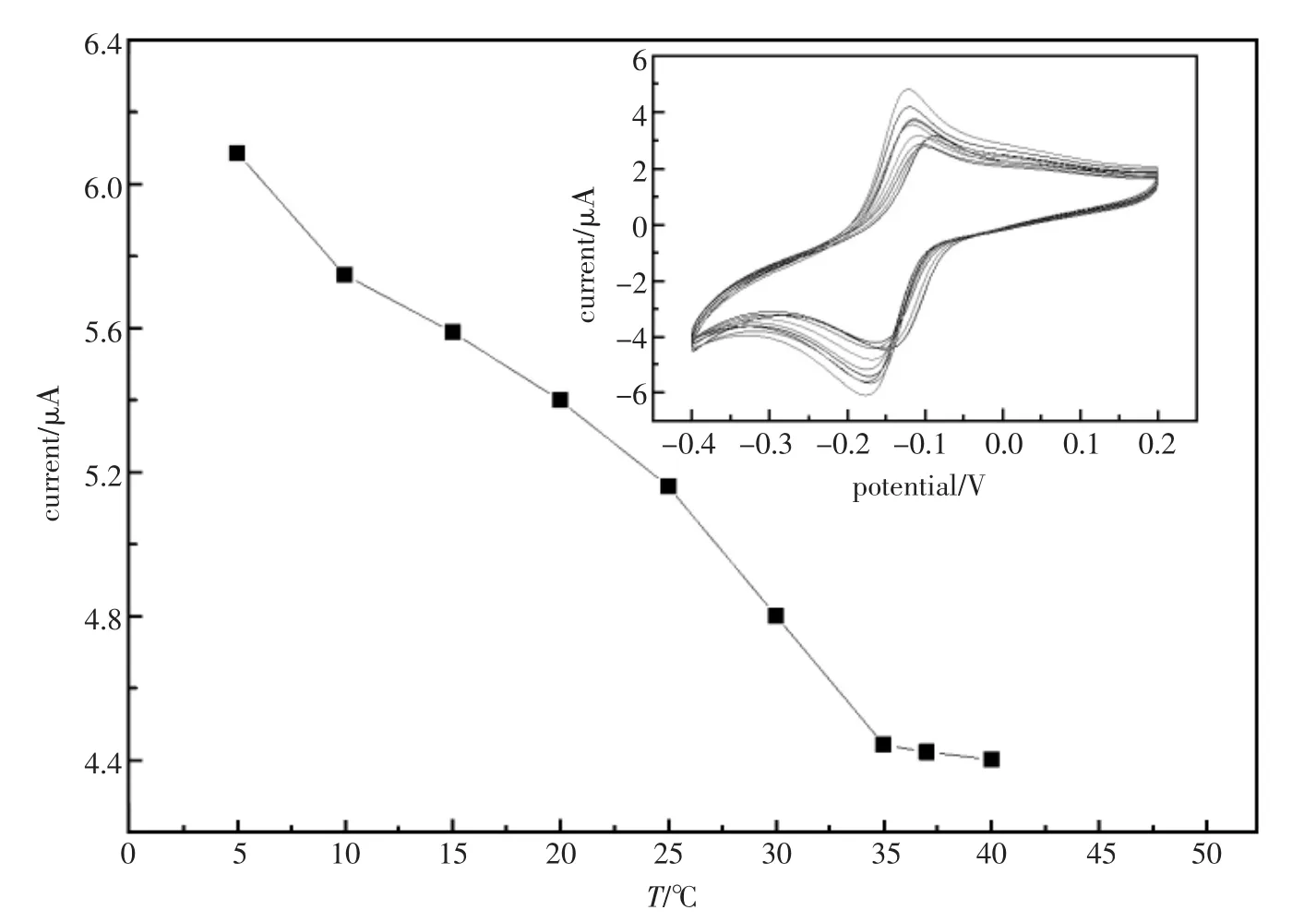
图6 免疫传感器在不同温度下的循环伏安图Fig.6 Cyclic voltammograms of the immunoelectrode in different temperature
2.3 免疫传感器的性能
2.3.1 免疫传感器的检测范围和检出限
在最优实验条件下,测试免疫传感器检测范围和检出限。配制成不同浓度的抗原溶液(0.01~ 200 ng/mL),由低浓度到高浓度,将免疫传感器依次孵育不同浓度抗原12 min后,取出用CV表征。图7插图即为在不同浓度抗原中孵育后的CV图,随着浓度的增大,氧化还原峰降低。同时,从图7可知AFP抗原浓度分别在0.01~1.0 ng/mL和5~200 ng/mL范围内,峰电流与抗原浓度成良好线性关系。线性方程分别为:Current= -1.51082 c+6.94359和 Current=-0.00639 c+ 5.44035,相关系数分别为0.9901和0.9712,检出下限为0.003 ng/mL。说明该传感器检测范围宽,灵敏度高。主要是Thi和nano-Au的协同作用,促进了电子传输。
2.3.2 免疫传感器的选择性和抗干扰性
为了检测免疫传感器的选择性和抗干扰性,实验将免疫传感器分别置于只含AFP抗原100 ng/mL溶液与含有BSA、赖氨酸、谷氨酸和抗坏血酸等干扰蛋白质的100 ng/mL AFP抗原溶液中浸泡12 min后,取出依次用CV表征。从图8中可以看出两次扫描峰电流值相差很小,说明该免疫电极具有良好的选择性和抗干扰性。
3 结论
实验用SiO2-Cs纳米复合物、Thi共同修饰电极构建了检测范围广,灵敏度高,抗干扰性强的AFP免疫传感器。与其他传统固载方法相比,该方法具有如下优点:(1)纳米SiO2具有的三维网状结构,增加了抗体吸附量;(2)Thi的引入,简化了实验步骤,提高了免疫传感器的灵敏度;(3)利用Cs、Thi和nano-Au及抗体蛋白质之间的静电吸附,提高了实验成功率,同时也增加了抗体吸附量。该传感器的制备过程中可操作性强,同时该传感器也可应用于其他免疫体系的检测,在临床医学方面有潜在应用价值。
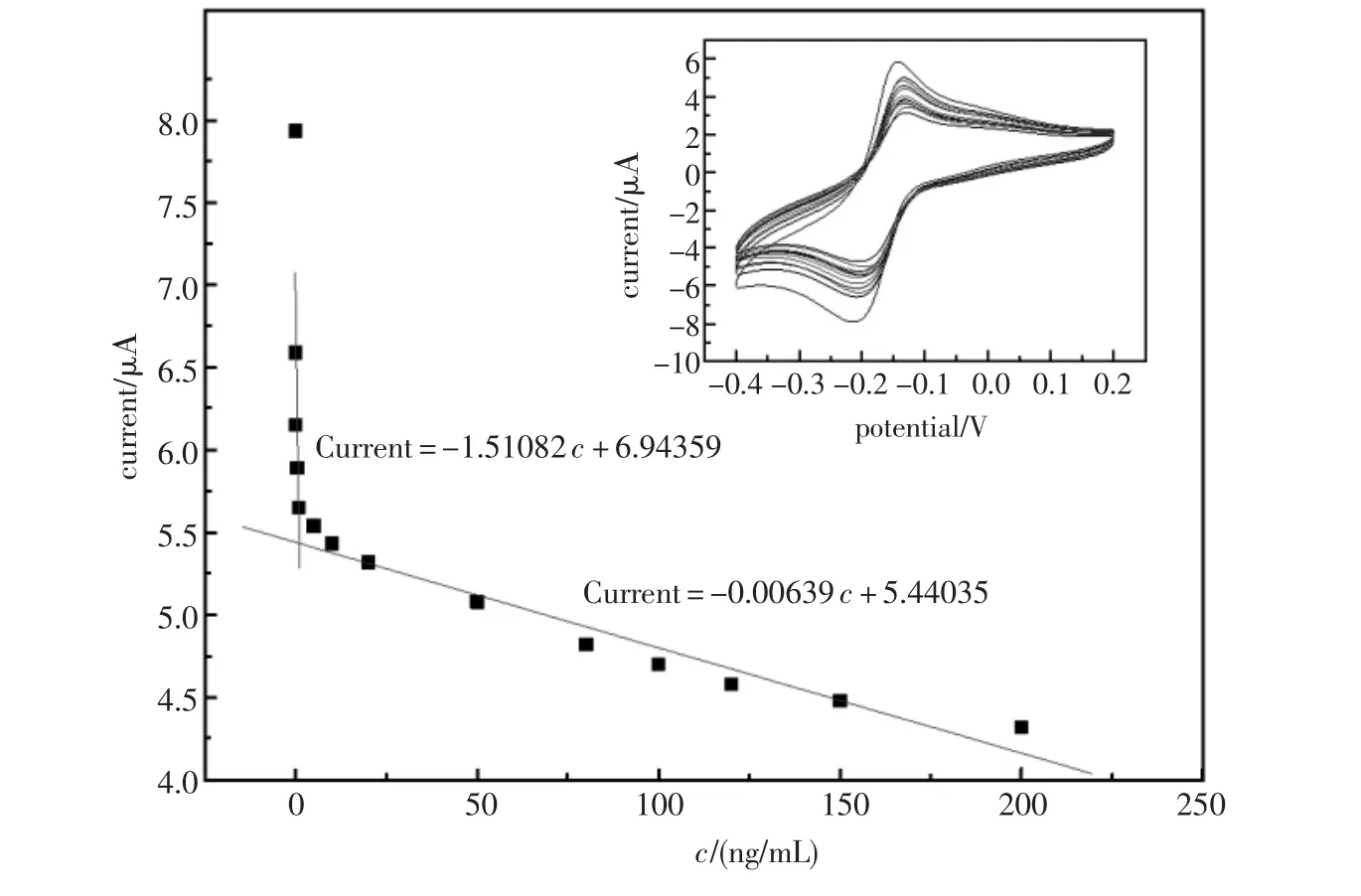
图7 不同浓度抗原下循环伏安图Fig.7 Cyclic voltammograms of the immunoelectrode in different AFP concentration浓度:0.01,0.05,0.1,0.5,1,5,10,20,50,80,100,120,150,200 ng/mL
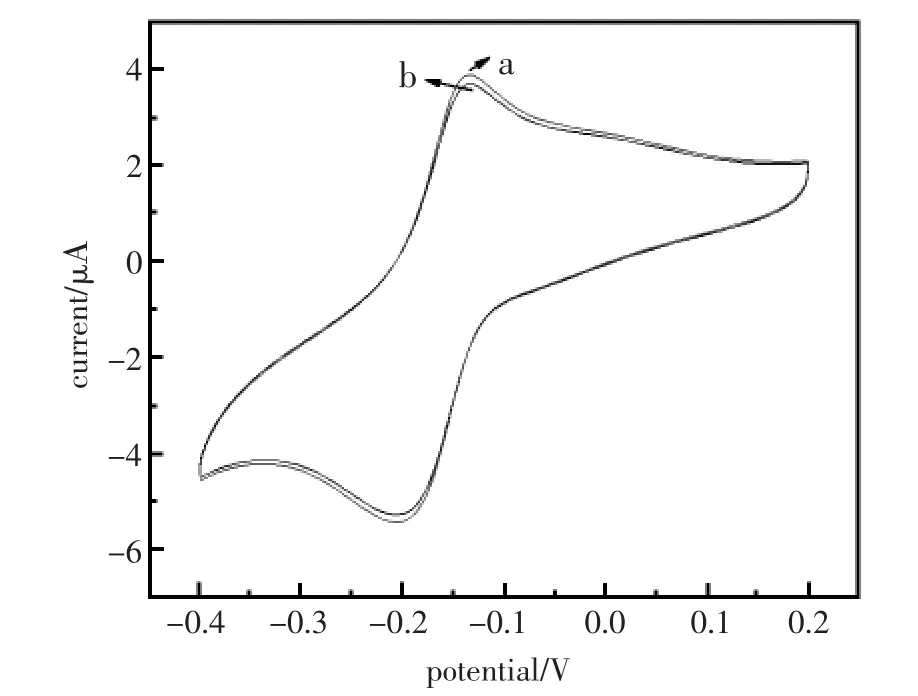
图8 (a)加有干扰物的循环伏安图 (b)只有AFP抗原的循环伏安图Fig.8 (a)Cyclic voltammograms of the immunoelectrode have other protein molecules.(b)Cyclic voltammograms of the immunoelectrode only have AFP
[1]贾立永,郑磊,王前,等.电化学免疫传感器及其在临
床检验中的应用进展[J].国际检验医学杂志,2010, 31(11):1329-1330.
[2]蒋文,袁若.纳米材料在电化学生物传感器及生物电分析领域中的应用[J].分析测试学报,2011,30(11): 1200-1206.
[3]禹坤.纳米二氧化硅的生产及应用现状[J].现代技术陶瓷,2005,4:28-32.
[4]李曦,刘连利,王莉莉.纳米二氧化硅的研究现状与进展[J].渤海大学学报 (自然科学版),2006,27(4): 304-308.
[5]Yang M H,Yang Y,Yang H F.Layer-by-layer self-assembled multilayer films of carbon nanotubes and platinum nanoparticles with polyelectrolyte for the fabrication of biosensors[J].Biomaterials,2006,27(2):246-255.
[6]安海珍,袁若,柴雅琴,等.基于聚硫堇、DNA/纳米银复合物共修饰癌胚抗原免疫传感器的研究[J].化学学报,2008,66(6):633-638.
[7]闵丽根,袁若,柴雅琴,等.基于纳米金与碳纳米管-纳米铂-壳聚糖纳米复合物固定癌胚抗原免疫传感器的研究[J].化学学报,2008,66(14):1676-1680.
[8]Nara yanan R,EL-sayed M A.Effect of colloidal catalysis on the nanoparticle size distribution:dendrimer-Pd vs PVP-Pd nanoparticles catalyzing the suzuki coupling reaction[J].J.Phys.Chem.B.,2004,108(25):8572-8580.
[9]Zhuo Ying,Yuan Ruo,Chai Yaqin,et al.Enhancement of carcinoembryonicantibody immobilization on gold electrode modified by gold nanoparticles and SiO2/Thion-ine nanocomposite[J].Journal of Electroanalytical Chemistry,2009,628(1-2):90-96.
[10]欧朝凤,袁若,柴雅琴,等.基于硫堇/碳纳米管修饰电极的过氧化氢生物传感器[J].分析化学研究简报,2007,35(7):1011-1014.
[11]范艳玲,刘艺芳,吕雪莉,等.硅酸乙酯为原料反相微乳液法制备纳米二氧化硅[J].化学工业与工程,2010,27(5):378-410.
[12]冉小琪,袁若,柴雅琴,等.基于纳米金、铁氰化镍纳米颗粒共修饰的电流型甲胎蛋白免疫传感器的研究[J].化学传感器,2010,30(1):36-41.
[13]朱宇萍,袁若,柴雅琴,等.基于碳纳米管/L-半胱氨酸/ Fe3O4@Au纳米复合材料的电流型甲胎蛋白免疫传感器的研究[J].分析化学,2012,40:359-364.
[14]Liu Ya xi,Yuan Ruo,Chai Ya qin,et al.Preparation of a composite film electrochemically deposited with chitosan and gold nanoparticles for the determination of α-1-fetoprotein[J].Bioprocess Biosyst Eng,2010,33(5):613-618.
[15]柴荣,袁若,柴雅琴,等.邻氨基苯甲酸膜及纳米金固定的亚甲基蓝为介体的乙型肝炎免疫传感器[J].西南大学学报(自然科学版),2007,29(9):52-56.
An immunosensor based on silica-chitosan nano composites
Zhu Yu-ping*,Xu Qiong
(College of Chemistry and Chemical Engineering,Neijiang Normal University,Neijiang 641112,China)
First,the preparation of silica-chitosan nano composites.Then modify the surface of glassy carbon electrode,using nano silicon dioxide high porous structure and surface energy of adsorption electronic media body thionine.Through thionine amino adsorption of nanometer gold,which immobilized AFP antibody,using bovine serum albumin closed nonspecific adsorption sites,successfully obtained a new kind of AFP immune sensor.Under the optimal experimental conditions,the immune sensor detection range in 0.01~1.0 ng/mL and 5~200 ng/mL show good linear relations,detecting limit was 0.003 ng/mL.Results show that the sensor sensitivity,simple preparation method.
immunosensor;AFP;SiO2;chitosan;nano composite
四川省教育厅科研项目(15ZA0292)
*通信联系人,Tel:13696067037,E-mail:judy20060830@163.com

