麻仁润肠软胶囊特征图谱研究及苦杏仁气相鉴别
王枚博, 毛秀红, 王 柯, 季 申
(上海市食品药品检验所,上海201203)
麻仁润肠软胶囊特征图谱研究及苦杏仁气相鉴别
王枚博, 毛秀红, 王 柯, 季 申*
(上海市食品药品检验所,上海201203)
目的建立麻仁润肠软胶囊 (火麻仁、苦杏仁、大黄、木香、陈皮、白芍)高效液相色谱特征图谱,并建立气相色谱法用于鉴别其中的苦杏仁成分。方法以大黄素为参照物,采用Zorbax SB-C18色谱柱 (250 mm×4.6 mm,5 μm),以乙腈为流动相A,0.1%磷酸溶液为流动相B,梯度洗脱,检测波长210 nm,建立麻仁润肠软胶囊的特征图谱;以苯甲醛和苦杏仁对照药材为对照品,采用聚乙二醇20000毛细管柱 (30 m×0.25 mm,0.25μm)来鉴别其中的苦杏仁成分。结果高效液相色谱中有13个特征峰,并确定了其中7个;气相色谱中鉴别出苯甲醛,而且空白样品 (缺苦杏仁)无干扰。结论该方法专属性强,可用于麻仁润肠软胶囊的质量控制。
麻仁润肠软胶囊;特征图谱;苦杏仁;鉴别;气相色谱法;高效液相色谱法
麻仁润肠软胶囊为北京同仁堂科技发展股份有限公司制药厂独家生产的品种,全方由火麻仁、苦杏仁 (去皮炒)、大黄、木香、陈皮、白芍六味药组成,功效润肠通便,主治大肠积热、津液不足所致的大便秘结,胸腹胀满。目前,该药收载于国家药品监督管理局国家药品标准 (新药试行标准转正式标准)WS3-050(Z-009)-2002Z[1],规定了大黄、陈皮、白芍的薄层鉴别以及大黄中大黄素的定量测定,但对苦杏仁鉴别和特征图谱则未作规定。文献报道[2-7],苦杏仁鉴别大多以苦杏仁苷对照品或苦杏仁对照药材为参照,但上述方法并不适用于麻仁润肠软胶囊,因为苦杏仁苷经自身酶或酸水解后可产生苯甲醛[8-11]。本实验以苯甲醛和苦杏仁为对照品和对照药材,建立了麻仁润肠软胶囊中的苦杏仁气相鉴别方法。另外,中药特征图谱是中药整体性的化学表征,是近年来研究热点,而HPLC法具有高效、快速、灵敏、重现性好、应用范围广等特点,已成为首选方法[12]。因此,本实验又以大黄素为参照物,建立了麻仁润肠软胶囊的HPLC特征图谱,为其质量控制提供科学依据。
1 仪器和试药
1.1 仪器 6890N型气相色谱仪(包括FID检测器)、1260型高效液相色谱仪 (包括DAD检测器)(美国Agilent公司);B5500S-MT型超声波清洗器(美国Branson公司);5810R型离心机(德国Eppendof公司)。
1.2 试剂 苯甲醛对照品 (批号11650-200301)、苦杏仁苷对照品 (批号110820-200403)、木香烃内酯对照品 (批号111524-200503)、去氢木香烃内酯对照品 (批号1525-200102)、大黄素对照品(批号 110756-200110)、大黄酸对照品 (批号0757-9804)、大黄酚对照品 (批号 110796-200309)、芦荟大黄素对照品 (批号 110795-200806)、橙皮苷对照品 (批号110721-200211)、芍药苷对照品 (批号110736-201035)、α-亚麻酸对照品 (批号111631-200502)、苦杏仁对照药材(批号 121554-200601)、木香对照药材 (批号120921-200506)、大黄对照药材 (批号1212149-200402)、陈皮对照药材 (批号120969-201109)、白芍对照药材 (批号120905-200407)、火麻仁对照药材 (批号121097-200402),均购于中国食品药品检定研究院;乙醚、乙腈均为色谱纯 (德国Merck公司);水为超纯水,经Molcel超纯水仪制得;其余试剂均为分析纯 (国药集团化学试剂有限公司)。
1.3 试药 麻仁润肠软胶囊 (批号0173480、1172321、12177561、1175471,自编号 1、2、3、 4)、空白样品 (缺苦杏仁),均由北京同仁堂科技发展股份有限公司制药厂提供。
2 方法和结果
2.1 特征图谱
2.1.1 色谱条件 色谱柱为Zorbax SB-C18(250 mm×4.6 mm,5μm);乙腈为流动相A,0.1%磷酸溶液为流动相B,梯度洗脱 (0~30 min,10% A→40%A;30~40 min,40%A→90%A;40~50 min,90%A);柱温30℃;体积流量1.0 mL/min;检测波长210 nm;进样量20μL。
2.1.2 参照物溶液制备 精密称取大黄素对照品适量,加甲醇溶解,制成每1 mL含0.5 mg的溶液,即得参照物溶液。
2.1.3 对照品溶液制备 精密称取苦杏仁苷对照品、木香烃内酯对照品、去氢木香烃内酯对照品、大黄酸对照品、大黄酚对照品、芦荟大黄素对照品、橙皮苷对照品、芍药苷对照品、α-亚麻酸对照品适量,分别加甲醇溶解,制成每1 mL含2mg的溶液,即得对照品溶液;精密称取苦杏仁对照药材、木香对照药材、大黄对照药材、陈皮对照药材、白芍对照药材、火麻仁对照药材1 g,按“2.1.4”项下方法分别制备,即得对照药材溶液。
2.1.4 供试品溶液的制备 精密称取麻仁润肠软胶囊内容物2 g,加70%乙醇10 mL溶解,超声处理30 min,4 000 r/min离心5min,取上清液,即得供试品溶液。
2.1.5 精密度试验 精密吸取同一供试品溶液(批号0173480)20μL,按 “2.1.1”项下色谱条件连续进样6次,记录色谱图,并以大黄素为参照物峰,计算各特征峰的相对保留时间。结果,各特征峰相对保留时间的RSD均小于0.2%,表明仪器精密度良好。
2.1.6 稳定性试验 精密吸取同一供试品溶液(批号0173480)20μL,分别于0、2、4、8、12、24 h进样测定,记录色谱图,并以大黄素为参照物峰,计算各特征峰的相对保留时间。结果,各特征峰相对保留时间的RSD均小于0.5%,表明供试品溶液于24 h内测定结果稳定。
2.1.7 重复性试验 精密称取供试品 (批号0173480)内容物6份,按 “2.1.4”项下方法制备供试品溶液,然后精密吸取其中20μL分别进样测定,记录色谱图,并以大黄素为参照峰,计算各特征峰的相对保留时间。结果,各特征峰相对保留时间的RSD均小于0.3%,表明该方法重复性良好。
2.1.8 特征图谱的建立 分别精密吸取参照物溶液和供试品溶液各20μL,按 “2.1.1”项下色谱条件测定,记录50 min时的色谱图,即得特征图谱。通过综合比较4个不同批号麻仁润肠软胶囊的供试品色谱图,标定13个共有峰作为其特征峰,见图1。以大黄素参照物相应的峰为S峰,计算其余12个特征峰的相对保留时间,见表1。同时,其相对保留时间应在规定值的±5%以内,规定值为:0.100(峰1)、0.112(峰2)、0.314(峰3)、0.423(峰 4)、0.457(峰 5)、0.622(峰 6)、0.684(峰 7)、0.902(峰 8)、0.926(峰 9)、1.000(峰S)、1.072(峰10)、1.156(峰11)、1.227(峰12)。以大黄素参照物相应的峰为S峰,计算其余12个特征峰的峰面积,见表2,其峰面积RSD为0.05%~2.64%。

图1 麻仁润肠软胶囊特征图谱Fig.1 Specific chromatogram of M aren Runchang Soft Capsules

表1 特征图谱中特征峰的相对保留时间Tab.1 Relative retention time of specific peaks in specific chromatogram
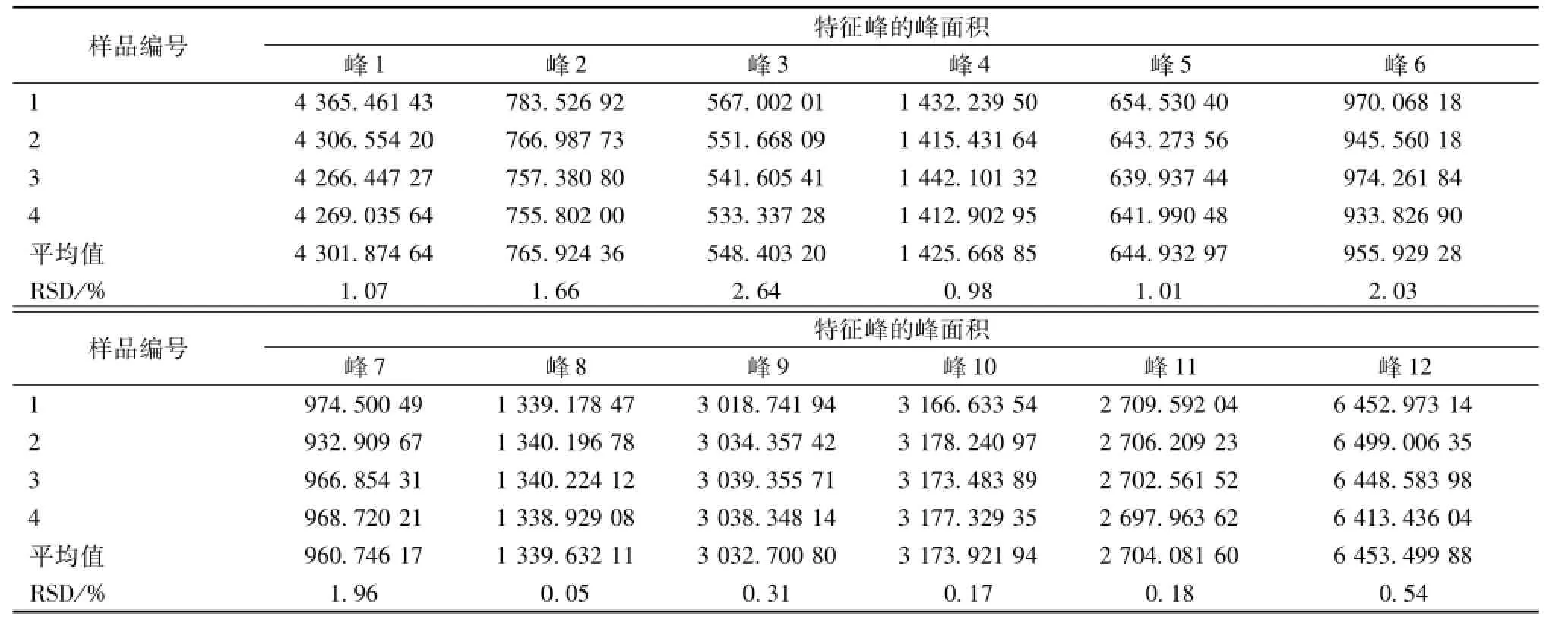
表2 特征图谱中特征峰的峰面积Tab.2 Peak area of specific peaks in specific chromatogram
2.1.9 特征峰归属 分别精密吸取参照物溶液、对照品溶液、对照药材溶液和供试品溶液各20μL,按 “2.1.1”项下色谱条件测定,记录50 min的色谱图,即得特征峰。与对照品和对照药材比对,并结合DAD光谱,确定3号峰为芍药苷峰,5号峰为橙皮苷峰,8号峰为芦荟大黄素峰,9号峰为大黄酸峰,10号峰为大黄酚峰,11号峰为α-亚麻酸峰。
2.2 苦杏仁气相色谱鉴别
2.2.1 色谱条件 色谱柱为聚乙二醇20000毛细管柱 (30m×0.25 mm,0.25μm);柱温为程序升温:初始温度为80℃,保持20 min,之后以100℃/min的速率升温至200℃,保持5 min;分流进样,分流比5∶1;进样量1μL。
2.2.2 对照品溶液制备 精密称取苯甲醛对照品适量,加乙醚溶解,制成每1 mL含0.02μL的溶液,即得对照品溶液;精密称取取苦杏仁对照药材0.5 g,按 “2.1.3”项下方法制备,即得对照药材溶液。
2.2.3 供试品溶液制备 精密称取麻仁润肠软胶囊内容物2 g,加乙醚10 mL溶解,超声处理30 min,4 000 r/min离心5 min,取上清液,即得供试品溶液。
2.2.4 空白样品(缺苦杏仁)溶液制备 精密称取空白样品 (缺苦杏仁)2 g,按 “2.2.3”项下方法制备,即得空白样品 (缺苦杏仁)溶液。
2.2.5 结果 在供试品色谱中,均呈现出与苯甲醛对照品和苦杏仁对照药材色谱峰保留时间相同的峰,而且空白样品 (缺苦杏仁)无干扰,见图2。
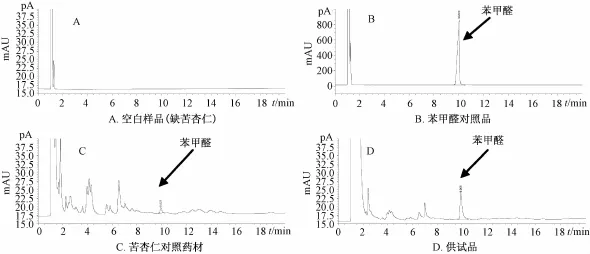
图2 苦杏仁气相鉴别图Fig.2 GC identification chromatogram s of bitter ap ricot seed
2.2.6 耐用性试验 分别选用HP-INNOWax(30 m×0.25 mm,0.25μm)、DB-WAX(30 m×0.53 mm,0.25μm)和ZB-WAX plus色谱柱(30 m× 0.32mm,1.00μm)进行实验,结果发现保留时间适中,均能获得良好的分离效果,故选择聚乙二醇20000毛细管柱作为色谱柱。
3 讨论
3.1 特征图谱提取溶剂考察 分别考察了30%乙醇、50%乙醇、70%乙醇、无水乙醇、甲醇的提取效果。结果显示,在5种提取溶剂中,70%乙醇和甲醇提取得到的供试品溶液色谱峰多于其他溶剂,从环保角度考虑,最终选择70%乙醇作为提取溶剂,见图3。

图3 特征图谱提取溶剂考察Fig.3 Investigation of extraction solvent for specific chromatogram
3.2 特征图谱检测波长考察 麻仁润肠软胶囊中有效成分的最大吸收波长多在210~240 nm之间,故分别选取210、220、230、240 nm作为检测波长,考察供试品溶液的出峰情况。结果显示,在210 nm下,供试品溶液色谱峰最多,故选择210 nm作为检测波长,见图4。
3.3 苦杏仁气相鉴别 本实验发现,以苦杏仁苷对照品或苦杏仁对照药材为参照,采用薄层色谱法鉴别麻仁润肠软胶囊中的苦杏仁时,样品斑点不清晰。文献[8]报道,苦杏仁苷经自身酶或酸水解后可产生苯甲醛,而苯甲醛具有挥发性,因此最终确定采用气相色谱法[13-16]建立苦杏仁鉴别方法。另外,苯甲醛遇光和空气易氧化为苯甲酸,因此检测过程中应尽量采用棕色玻璃器皿,实验操作应尽可能当天完成,苯甲醛对照品溶液应当天使用当天配制[8]。

图4 特征图谱检测波长考察Fig.4 Investigation of detection wavelength for specific chrom atogram
[1]国家药典委员会.国家食品药品监督管理局国家药品标准(新药转正标准):第41册 [S].北京:人民卫生出版社,2004:70.
[2]胡英婕.小儿肺热咳喘颗粒的薄层色谱鉴别研究[J].辽宁医学院学报,2011,32(4):352-356.
[3]刘建明,徐卉芳.虫草川贝止咳膏薄层色谱鉴别方法的研究[J].宁夏医科大学学报,2013,35(7):832-835.
[4]袁 丹,胡 爽,杜慧琴,等.橘红丸中苦杏仁苷的定性、定量分析方法的研究[J].中国药学杂志,2002,37(11):857-860.
[5]周 斌,高文远,张铁军,等.苦杏仁配方颗粒制备工艺和质量标准研究[J].中国实验方剂学杂志,2006,12(11):1-3.
[6]赵 晨,于 鹏,郑 歆,等.二母安嗽丸的质量标准研究[J].现代药物与临床,2010,25(1):52-57.
[7]唐志书,史亚军,王 梅,等.复方杏仁片质量标准研究[J].辽宁中医杂志,2004,31(9):782-783.
[8]王宪昌,王建中,王丰俊,等.苦杏仁挥发油的应用现状和提取技术改进思路 [C]//北方省区 《灌木暨山杏选育、栽培及开发利用》研讨会论文集.北京:国家林业局,2004:218-222.
[9]刑国秀,李 楠,杨美燕,等.天然苦杏仁苷的研究进展[J].中成药,2003,25(12):1007-1009.
[10]李雪玲,凌玮玮.桃仁中苯甲醛的提取及其抑菌作用研究[J].生物学杂志,2010,27(3):31-33.
[11]穆 静.苦杏仁甙的研究进展[J].中药材,2002,25(5):366-369.
[12]张翠英,董 梁,陈士林,等.人参药材皂苷类成分UPLC特征图谱的质量评价方法[J].药学学报,2010,45(10):1296-1300.
[13]谭平华,唐盛伟,刘长军,等.气相色谱法同时测定苯甲醛、苯甲醇和苯甲酸[J].天然气化工,2007,32(2):64-66.
[14]任飞亮,彭 茗,朱瀛华,等.气相色谱法同时测定复方庚酸炔诺酮注射液中的苯甲醇和苯甲醛[J].药物分析杂志,2013,33(2):304-307.
[15]杨 敏,刘吉金.气相色谱法测定蜜炼川贝枇杷膏中薄荷脑和苯甲醛的含量[J].中国实验方剂学杂志,2008,14(8):23-25.
[16]陈 伟.毛细管气相色谱法测定无花果中的苯甲醛[J].预防医学论坛,2005,11(1):56-57.
Specific chrom atogram research and GC identification of bitter apricot seed in M aren Runchang Soft Capsules
WANG Mei-bo, MAO Xiu-hong, WANG Ke, JIShen*
(Shanghai Institute of Food and Drug Control,Shanghai 201203,China)
AIMTo establish HPLC specific chromatogram of Maren Runchang Soft Capsules(MRRCSC)(Cannabis Fructus,Armeniacae Semen amarum,Rhei Radix of Rhizoma,Aucklandiae Radix,Citri reticulate pericarpium,Paeonia Radix alba)and GC identification of bitter apricot seed(Armeniacae Semen amarum).METHODSWith emodin as a reference,specific chromotogram was carried outon a Zorbax SB-C18(250mm× 4.6 mm,5μm)column with 210 nm as detection wavelength,which gradiently eluted with acetonitrile asmobile phase A and 0.1%phosphoric acid solution asmobile phase B.GCmethod of identifying bitter apricot seed was performed on PEG-200M(30 m×0.25 mm,0.25μm)column with benzaldehyde and bitter apricot seed as the reference substances.RESULTSThe HPLC chromatogram comprised thirteen common characteristic peaks,seven peaks ofwhich were identified.The chromatographic peak of benzaldehyde was found in the GC chromatogram,and there was no foreign substance in blank sample(lack of bitter apricot seed).CONCLUSIONThe HPLC and GCmethod ofMRRCSC is specific for identification ofMaren Runchang Soft Capsules,which could be applied to the quality control.
Maren Runchang Soft Capsules;specific chromatogram;bitter apricot seed;identification;GC;HPLC
R284.1
:A
:1001-1528(2015)06-1262-05
10.3969/j.issn.1001-1528.2015.06.022
2014-08-11
2010—2011年度国家药品标准提高研究课题项目 (320)。
王枚博 (1981—),男,主管药师,从事食品药品质量控制与元素分析工作。Tel:(021)38839900-26604,E-mail:wangmb99@163.com
*通信作者:季 申 (1963—),女,主任药师,从事中药的有效性和安全性及质量控制方法研究。Tel:(021)50798195,E-mail:jishen2008@gmail.com

