雷公藤红素对肝癌细胞SMMC-7721凋亡和周期的调控作用及机制
许阳贤, 宋海燕, 季 光*
(1.上海中医药大学附属龙华医院普外科,上海 200032;2.上海中医药大学脾胃病研究所,上海200032)
XU Yang-xian1, SONG Hai-yan2, JIGuang2*
(1.Departmentof General Surgery,Longhua Hospital Affiliated to Shanghai University of Traditional ChineseMedicine,Shanghai200032,China;2.Institute of Digestive Diseases,Shanghai University of Traditional Chinese Medicine,Shanghai 200032,China)
[药理]
雷公藤红素对肝癌细胞SMMC-7721凋亡和周期的调控作用及机制
许阳贤1, 宋海燕2, 季 光2*
(1.上海中医药大学附属龙华医院普外科,上海 200032;2.上海中医药大学脾胃病研究所,上海200032)
目的研究雷公藤红素对肝癌细胞SMMC-7721的增殖和凋亡的影响及机制。方法应用CCK8试剂检测雷公藤红素对SMMC-7721细胞的毒性和增殖影响,用软琼脂克隆形成试验检测药物对肝癌细胞的克隆形成能力的干预,通过核染色及检测活化caspase-3水平观察细胞凋亡情况,用流式细胞术检测药物干预对细胞周期分布的影响,并用Western blot检测细胞周期相关蛋白细胞周期素B1(cyclin B1)及细胞分裂周期蛋白2(cell division cycle protein 2,cdc2)水平。结果雷公藤红素以剂量依赖性方式使SMMC-7721细胞的增殖下降和克隆形成减少,使细胞凋亡增加及细胞周期阻滞在G2/M期,同时增加失活cdc2表达,并导致cyclin B1的积聚。结论雷公藤红素可显著抑制肝癌细胞SMMC-7721的增殖并促进细胞凋亡,对分裂周期相关蛋白调控导致的分裂阻滞可能是影响其对细胞凋亡和增殖作用的机制之一。
肝细胞癌;雷公藤红素;凋亡;细胞周期阻滞
肝癌是临床常见的诊治困难、预后极差的一种恶性肿瘤,全球肝癌病死率在各种癌症中位居第三[1]。我国由于肝炎和肝炎转肝硬化的病人众多,肝癌发病率和病死率均高于世界平均水平[2]。手术是早期肝癌治疗的首选方法,但复发率高,放、化疗是中晚期肝癌及转移性肝癌常用的治疗方法,然而疗效非常有限[3]。
中医药在临床治疗中晚期肝癌有一定疗效,近年来从中草药中提取的多种化合物被证实有治疗肿瘤的潜力[4]。其中雷公藤红素(celastrol)是醌甲基三萜类物质,主要从雷公藤的根皮中提取获得,研究表明其具有抗炎、抗动脉粥样硬化、抗神经退行性疾病等药理学作用[5]。近年来雷公藤红素在多种肿瘤中的作用受到广泛关注[6],其对肝细胞癌的作用研究主要为体外试验,使用的细胞株包括C3A、HepG2、Huh7等[7-11]。SMMC-7721是一种低分化恶性度较高的肝癌细胞株,且易对阿霉素、顺铂等药耐药,因此本研究拟观察雷公藤红素是否对SMMC-7721细胞增殖和凋亡有干预作用,这对于探索恶性度较高的中晚期肝癌的药物治疗具有重要意义。
1 材料与方法
1.1 材料
1.1.1 仪器Bio-Rad电泳系列及Trans-Blot TurboTM半干转膜仪;Syngene GBOX Chemi XT4多功能成像系统;Bio Tek Synergy H4微孔板检测仪;Thermo CO2培养箱;Thermo Herasafe KSA2二级生物安全柜;Olympus倒置荧光相差显微镜;BD FACSVerse流式细胞仪。
1.1.2 细胞 SMMC-7721肝癌细胞,购于中国科学院细胞库,由本实验室长期培养和冻存。
1.1.3 药物与试剂 雷公藤红素 (纯度大于98%)购于上海融禾医药科技发展有限公司,溶于DMSO配制成50 mmol/L贮存液保存于-20℃。DMEM高糖培养基为Gibco产品,胎牛血清(FBS)、青霉素/链霉素、胰酶等细胞培养试剂均为法国Biowest公司产品。细胞增殖和毒性实验试剂CCK-8为日本同仁化学研究所(Dojindo)产品。Difco Bacto琼脂粉为BD产品。PVDF膜、化学发光液为Millipore产品,cleaved caspase-3、cyclin B1、phospho-cdc2抗体及羊抗兔IgG购于Cell Signaling Technology公司,β-actin内参抗体为华安生物公司产品。二甲基亚砜 (DMSO)、核荧光染料DAPI及PI购自Sigma公司。
1.2 方法
1.2.1 SMMC-7721细胞培养 SMMC-7721细胞培养于含10%胎牛血清、50 U/m L青霉素和50 μg/mL链霉素的DMEM高糖培养基中,置于37℃、5%CO2培养箱中,生长至80%融合度时,0.25%胰酶消化传代。
1.2.2 细胞毒性和增殖检测 每孔5×103个细胞培养于96孔板中,24 h后弃培养液,加入含雷公藤红素不同浓度 (0.1、0.5、1、2.5、5、10 μmol/L)的培养基,以不含药孔为对照,置培养箱内孵育48 h,用培养基洗2次,每孔加入100μL新鲜培养基及10μL CCK8试剂,孵育4 h,应用酶标仪检测450 nm波长吸光度,并减去630 nm干扰吸光度值。应用公式计算:细胞活力 (%) =[A(加药)-A(空白)]/[A(正常)-A(空白)]× 100%,计算其半抑制浓度 (IC50)。
细胞增殖试验将2×103个细胞/孔培养于96孔板中,加入含雷公藤红素1、2.5、5μmol/L的培养基,以不含药孔为对照,培养24、48、72 h,如上操作加入CCK8及检测吸光度。
1.2.3 克隆形成试验 6孔培养板中铺入7 mL含0.5%Difco Bacto琼脂的DMEM作为基底层,上层铺入混悬有2×103个细胞的含0.3%琼脂的培养基1.5 m L,置于37℃培养箱培养7 d,显微镜下计数超过50个细胞的克隆数,每板计数5个视野。1.2.4 细胞核形态观察 将2×105个细胞培养于6孔板中,加入含雷公藤红素不同浓度 (1、2.5、5μmol/L)的培养基,以不含药孔为对照,72 h后用多聚甲醛固定,加入DAPI染核,于荧光显微镜下观察并拍照。
1.2.5 细胞周期检测 2×105个细胞培养于6孔板中,加入含雷公藤红素不同浓度 (1、2.5、5 μmol/L)的培养基,以不含药孔为对照,48 h后收集并用70%预冷乙醇固定,无水乙醇固定过夜,用100μg/mL RNase A处理后用0.5 mg/mL PI溶液孵育30 min,用流式细胞仪检测细胞周期。
1.2.6 Western Blot检测蛋白水平 细胞用RIPA溶液裂解提取蛋白,用BCA法测定浓度。50μg蛋白用SDS-PAGE电泳分离并转移至PVDF膜,5%牛奶封闭后,加一抗孵育过夜,二抗室温下孵育1 h,化学发光液孵育10 min后用成像系统拍照并分析条带光密度值,以β-actin条带作为上样量参照,计算蛋白相对表达水平。
1.3 统计学分析 实验数据以x±s表示,应用SPSS 16.0软件进行统计学分析,用GraphPad Prism 5作图,采用单因素方差分析进行多组间比较,组间两两比较用Tukey-Kramer's法,P<0.05为差异有统计学意义。
2 结果
2.1 雷公藤红素抑制SMMC-7721细胞增殖和克隆形成 应用雷公藤红素对细胞毒性检测,计算得出其IC50为3.57μmol/L,因此后续试验选用1、2.5、5μmol/L 3个剂量观察其抗肿瘤作用。图1增殖试验显示,相对于对照,雷公藤红素1 μmol/L对细胞吸光度有轻度下调作用,在2.5、5 μmol/L从24 h起即显著下调吸光度值,并有剂量依赖性。图2显示细胞克隆形成实验结果,随着雷公藤红素浓度增加,细胞克隆数逐渐减少,数量均明显下降,两个较大剂量组较对照有显著性差异。
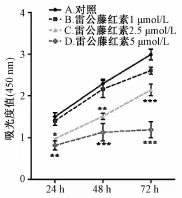
图1 雷公藤红素对SMMC-7721细胞增殖的影响Fig.1 Effect of celastrol on SMMC-7721 cell proliferation

图2 雷公藤红素对SMMC-7721细胞克隆形成的影响Fig.2 Effect of celastrol on colony form ation of SMMC-7721 cell
2.2 雷公藤红素促进SMMC-7721细胞凋亡 应用倒置荧光显微镜观察细胞核的形态变化,对照组细胞核基本为圆形或椭圆形,雷公藤红素干预组中部分细胞核皱缩甚至成为碎片状,并随其剂量增加程度越严重,正常细胞核明显减少 (图3A)。图3B显示,SMMC-7721细胞中活化的caspase-3水平随雷公藤红素剂量增加而升高,caspase-3是细胞凋亡的标志物,因此提示细胞凋亡与该化合物密切相关。

图3 雷公藤红素对SMMC-7721细胞凋亡的影响Fig.3 Effect of celastrol on apop tosis of SMMC-7721 cell
2.3 雷公藤红素对SMMC-7721细胞周期分布的影响 图4显示,与对照组相比,细胞周期各时相在雷公藤红素干预下有所改变,细胞G2/M期细胞比例在对照及雷公藤红素1、2.5、5μmol/L干预组中的比例分别为:14%、19%、26%、31%,逐渐增加,说明该化合物使细胞周期阻滞在G2/M阶段,细胞分裂减少,并相应引起进入G0/G1期的细胞数有一定下降。

图4 雷公藤红素对SMMC-7721细胞周期分布的影响Fig.4 Effect of celastrol on cell cycle d istribution of SMMC-7721 cell
2.4 雷公藤红素对SMMC-7721细胞cyclin B1及磷酸化cdc2蛋白水平的影响 细胞分裂G2/M期主要受cyclin B1-cdc2复合物的调控,该复合物发挥作用需要使cdc2去磷酸化而活化。图5显示,磷酸化cdc2在雷公藤红素2.5及5μmol/L浓度时含量显著高于对照细胞,而cyclin B1蛋白水平也随着其剂量增加而上升。

图5 雷公藤红素对SMMC-7721细胞中Cyclin B1及失活cdc-2蛋白水平的影响Fig.5 Effect of celastrol on the protein level of cyclin B1 and phosphor-cdc-2 in SMMC-7721 cell
3 讨论
既往对雷公藤红素抗肿瘤作用研究表明,其作用机制包括诱导肿瘤细胞凋亡、抑制血管生成、干预肿瘤坏死因子及核因子-κB信号通路、影响细胞微管、调节热休克反应等[6]。几项对肝癌作用的相关研究报道显示,雷公藤红素可单独或协同其它化疗药物促进肝癌细胞凋亡、抑制增殖及细胞侵袭,分子机理包括对STAT3/JAK2通路、内质网应激等通路的调控作用[7-8,10-11]。本研究结果显示,雷公藤红素可有效抑制肝癌细胞SMMC-7721增殖和克隆形成能力,并显著促进细胞凋亡,与文献报道其在其它肝癌细胞株中的作用一致[8,10,12]。另外,既往报道高剂量雷公藤红素可抑制肝癌细胞周期,使细胞阻滞在G0/G1期[7-8],而本研究显示雷公藤红素干预是阻滞在G2/M期细胞增多,这与Jiang H L等在Huh7细胞中的研究结果一致[10]。
细胞周期是调节肝癌细胞增殖的关键机制,周期过程由周期素-周期依赖性激酶复合物紧密调控,cyclin B-cdc2复合物驱动G2/M转化从而促进细胞分裂[13]。本研究中雷公藤红素干预细胞使失活的cdc2水平增加,导致cyclin B-cdc2复合物不能正常活化分裂中期各种相关下游分子,细胞阻滞在G2/M相,影响细胞的增殖水平,cyclin B1分子也因此不能被降解而积聚。cdc2的活化能确保细胞正确进入分裂相,DNA损伤时通过相关分子使cdc2失活,从而阻滞细胞分裂以修复DNA,而大量G2/M阻滞将导致细胞最终凋亡[14-15]。因此我们推测雷公藤红素可能使细胞DNA受损,引起cdc2失活,并最终导致细胞凋亡。
本研究表明中药来源的化合物雷公藤红素,可有效抑制高恶性度的肝癌细胞SMMC-7721的增殖和活性,促进细胞凋亡,对于导致细胞周期阻滞相关的cyclin B、cdc2等分子的调控可能是其发挥抗肿瘤作用的途径,其具体机制有待于进一步探讨。
[1]Forner A,Llovet JM,Bruix J.Hepatocellular carcinoma[J]. Lancet,2012,379(9822):1245-1255.
[2]Yuen M F,Hou JL,Chutaputti A.Hepatocellular carcinoma in the Asia pacific region[J].JGastroenterol Hepatol,2009,24(3):346-353.
[3]Villanueva A,Hernandez-Gea V,Llovet JM.Medical therapies for hepatocellular carcinoma:a critical view of the evidence[J].Nat Rev Gastroenterol Hepatol,2013,10(1):34-42.
[4]Hu Y,Wang S,Wu X,etal.Chinese herbalmedicine-derived compounds for cancer therapy:a focus on hepatocellular carcinoma[J].JEthnopharmacol,2013,149(3):601-612.
[5]任献青,鲁 静,孟祥乐,等.雷公藤红素药理作用最新研究进展[J].中华中医药杂志,2013,28(9):2679-2682.
[6]吴 丹,寇 芳,吕春明,等.雷公藤红素抗癌作用的研究进展[J].中国实验方剂学杂志,2013,19(11):356-361.
[7]Zhu H,Yang W,He L J,et al.Upregulating Noxa by ER stress,celastrol exerts synergistic anti-cancer activity in combination with ABT-737 in human hepatocellular carcinoma cells[J].PLoSOne,2012,7(12):e52333.
[8]Rajendran P,Li F,Shanmugam M K,etal.Celastrol suppresses growth and induces apoptosis of human hepatocellular carcinoma through themodulation of STAT3/JAK2 signaling cascade in vitro and in vivo[J].Cancer Prev Res,2012,5(4):631-643.
[9]Li H,Li Y,Liu D,et al.MiR-224 is critical for celastrol-induced inhibition ofmigration and invasion of hepatocellular carcinoma cells[J].Cell Physiol Biochem,2013,32(2):448-458.
[10]Jiang H L,Jin J Z,Wu D,et al.Celastrol exerts synergistic effects with PHA-665752 and inhibits tumor growth of c-Met-deficient hepatocellular carcinoma in vivo[J].Mol Biol Rep, 2013,40(7):4203-4209.
[11]陈永安,韩峭青,周 敏,等.雷公藤红素对人肝癌MHCC97H细胞侵袭转移的影响及机制研究[J].中医学报,2014,29(5):623-625.
[12]Kannaiyan R,Manu K A,Chen L,et al.Celastrol inhibits tumor cell proliferation and promotes apoptosis through the activation of c-Jun N-terminal kinase and suppression of PI3 K/Akt signaling pathways[J].Apoptosis,2011,16(10):1028-1041.
[13]Hara M,Abe Y,Tanaka T,et al.Greatwall kinase and cyclin B-Cdk1 are both critical constituents of M-phase-promoting factor[J].Nat Commun,2012,3(1059):1-9.
[14]Sancar A,Lindsey-Boltz L A,Unsal-Kacmaz K,etal.Molecularmechanisms ofmammalian DNA repair and the DNA damage checkpoints[J].Annu Rev Biochem,2004,73:39-85.
[15]Xu Z,Wu G,Wei X,et al.Celastrol induced DNA damage,cell cycle arrest,and apoptosis in human rheumatoid fibroblastlike synovial cells[J].Am J Chin Med,2013,41(3):615-628.
Effect and underlyingmechanism of celastrol on apoptosis and cell cycle in hepatocarcinoma cell line SMMC-7721
AIMTo study the effect and potentialmechanism of celastrol on apoptosis and cell cycle of hepatocarcinoma cell line SMMC-7721.METHODSCytotoxicity and the effect of celastrol on cell proliferation were assessed by CCK8 assay.Colony formation assay was used to determine the intervention of the compound for the ability of cell growth and tumorigenesis.The appearance of cellular nucleiwas observed through DAPI stain.Cell cycle was determined using a fow cytometer after PI stain.And Western blot was used to detect protein level of cleaved caspase-3,cyclin B1 and phospho-cdc2.RESULTSCompared with control,celastrol decreased cell proliferation,retarded colony formation in a dose dependentmanner.The compound increased cell apoptosis and cell cycle arrest at the G2/M phase.Simultaneously,it increased the level of inactive cdc2 and the expression of cyclin B1.CONCLUSIONCelastrol could inhibit SMMC-7721 cell proliferation and promote cell apoptosis. Themitotic cycle arrest by this compound through regulation of cell cycle related proteinsmight partially contribute to the underlyingmechanism.
hepatocellular carcinoma;celastrol;apoptosis;cell cycle arrest
R966
:A
:1001-1528(2015)06-1153-05
10.3969/j.issn.1001-1528.2015.06.001
XU Yang-xian1, SONG Hai-yan2, JIGuang2*
(1.Departmentof General Surgery,Longhua Hospital Affiliated to Shanghai University of Traditional ChineseMedicine,Shanghai200032,China;2.Institute of Digestive Diseases,Shanghai University of Traditional Chinese Medicine,Shanghai 200032,China)
2015-02-20
上海市教委预算内科研项目 (2012JW39);国家自然科学基金项目 (81202667)
许阳贤(1971—),男,硕士,副主任医师,从事中西医结合治疗消化道肿瘤研究。E-mail:xuyangxian@163.com
*通信作者:季 光(1968—),男,博士,教授,主任医师,博士生导师,从事慢性肝病中医药治疗研究。E-mail:jiliver@vip.sina.com

