白术、黄芪、党参促进IEC-6细胞损伤后的快速修复
宋厚盼, 谢梦洲, 胡志希, 黄惠勇, 蔡 雄
(湖南中医药大学中医诊断研究所,湖南长沙410208)
白术、黄芪、党参促进IEC-6细胞损伤后的快速修复
宋厚盼, 谢梦洲, 胡志希, 黄惠勇*, 蔡 雄*
(湖南中医药大学中医诊断研究所,湖南长沙410208)
目的研究白术、黄芪、党参提取物对体外胃肠黏膜上皮细胞损伤的快速修复作用。方法采用Tips划痕法建立小肠上皮 (IEC-6)细胞迁移模型,首先考察不同的IEC-6细胞接种密度、划痕后修复时间、不同的血清浓度以建立稳定的迁移模型;接着采用表皮生长因子 (EGF)及其阻断剂AG1478对迁移模型进行评价;最后考察三味中药对IEC-6细胞迁移的作用效果。结果(1)细胞的最佳接种密度为1×105个/mL;(2)宜在划痕后8 h计算细胞迁移率;(3)1%血清浓度为最适宜浓度;(4)EGF明显促进了IEC-6细胞迁移,AG1478明显抑制了细胞迁移;(5)白术、黄芪、党参提取物均可促进IEC-6细胞迁移。结论益气健脾中药可促进胃肠黏膜损伤后的快速修复过程,其机制是否与影响EGFR信号通路有关有待进一步研究。
胃肠黏膜损伤;IEC-6细胞;细胞迁移模型;表皮生长因子 (EGF);白术;黄芪;党参
人体的胃肠黏膜表面上皮代表着胃肠道的一道重要屏障,它能阻止肠腔内的许多毒性物质和免疫原性物质进入机体。胃肠道表面屏障的损伤和破坏常见于各种不同的胃肠道疾病如慢性胃炎、炎症性肠病等,并且有可能导致毒性和免疫原性物质渗透和吸收的增加,从而使机体产生炎症、不受控制的免疫反应、以及宿主体内稳态的失调等症状[1]。因此,黏膜损伤后的上皮表面屏障的快速修复过程对维持正常的稳态具有重要的作用。
胃肠道黏膜的损伤常来源于药物、外力、应激、酒精等因素的诱发,胃肠黏膜是人体更新最快的组织之一,通过上皮细胞的快速迁移,其在损伤后具有很强的快速修复能力。上皮表面连续性的重建主要依赖于受损表面附近的上皮细胞迁移至损伤区域并覆盖裸露的部位,这个过程一般发生于损伤后的几分钟至几个小时不等[2]。
肠上皮(IEC-6)细胞来源于正常大鼠小肠隐窝,它保持了肠上皮干细胞未分化的特性,现普遍将其作为体外模型用于研究人体胃肠黏膜损伤后修复过程。本课题组前期的研究曾采用手术刀片划痕法考察黏膜损伤后的重建过程,但该方法操作繁琐,容易产生人为的实验误差。为改进实验方法,提高实验效率和实验结果准确性,本研究采用Tips(枪头)划痕法建立IEC-6细胞损伤后的迁移模型,通过考察细胞接种密度、培养时间、血清浓度确定该迁移模型,并以表皮生长因子 (EGF)和表皮生长因子受体(EGFR)阻断剂Tyrphostin AG 1478(AG1478)评价该模型的可靠性,最后采用白术提取物、黄芪提取物和党参提取物进一步验证了该模型的准确性。
1 实验仪器和材料
1.1 细胞株 IEC-6细胞(来源于正常大鼠小肠隐窝),购自美国典型微生物菌种保藏中心(ATCC,编号C11995,批号8112123)。
1.2 药材 白术、黄芪及党参药材均购于湖南中医药大学第一附属医院,经湖南中医药大学中药鉴定教研室刘塔斯教授鉴定,白术为菊科植物白术(Atractylodesmacrocephalae Rhizoma)的根茎,黄芪为豆科植物蒙古黄芪(Astragali Radix)的根,党参为桔梗科植物党参(Codonopsis Radix)的根。
1.3 仪器 IX-71型荧光相差倒置显微镜(Olympus公司);HW03017-VBA型CO2培养箱(HARRIS公司);AUM-120D 岛津分析天平(SHIMADZU公司);高压灭菌器(美国Zealway公司);TGL-16B离心机(上海安亭科学仪器厂)。
1.4 试剂 高糖DMEM培养基 (批号8112123)、胎牛血清FBS(批号1027885)、Penicillin Streptomycin双抗溶液(批号1116222),TrypLETMExpress试剂(批号1045845,美国Life technologies公司);表皮生长因子 (EGF,批号E9644)、选择性表皮生长因子受体阻断剂Tyrphostin AG 1478(批号T4182,美国Sigma公司)。其他试剂均为分析纯,碧云天生物技术研究所。
2 方法
2.1 白术、黄芪和党参提取物的制备 精确称量200 g白术药材饮片,打粉后加入800 mL 90%的乙醇35℃超声提取30 min(100W,40 kHz),重复提取3次后用200目纱布过滤所有药液,并采用0.22μm有机滤膜抽滤,收集滤液得白术乙醇提取液。用旋转蒸发仪将上述所得白术乙醇提取液浓缩至200 mL左右,真空干燥箱40℃干燥后得25 g白术乙醇提取物 (总得率12.5%,以下简称白术提取物)。实验前以PBS配成所需浓度,实验剂量以白术提取物重量表示。
准确称取300 g黄芪药材,加蒸馏水淹没药材浸泡30 min,分两次煎煮。第一次加入10倍量的蒸馏水 (质量比为黄芪 ∶水=1∶10),武火急煎至沸,再调文火煎煮1.5 h,收集滤液;接着加入6倍量的蒸馏水,文火煎煮1 h,合并两次滤液,80℃水浴浓缩至300 mL(生药含量1 g/mL),冷冻干燥得黄芪提取物固体粉末,-20℃保存待用。党参提取物制备过程同黄芪提取物。实验前采用PBS溶解黄芪、党参提取物以制备受试药。实验剂量以黄芪、党参提取物重量表示。
2.2 培养液配制 高糖DMEM加10%FBS、1× 104units/mL青霉素,10 mg/mL链霉素。其他浓度血清的培养液均在该配方基础上加高糖DMEM作相应稀释。
2.3 细胞培养方法 细胞复苏后接种于培养瓶,于培养箱37℃,饱和湿度,95%空气-5%CO2环境培养;隔天换液1次。待细胞生长至80% ~90%时,TrypLE消化液消化细胞,制作单细胞混悬液,血球计数板计数,细胞分别以0.25、0.5、1、2、4、8×105个/m L的密度接种于6孔板 (考察接种密度),每孔加入2.5 mL培养液;加入含10%血清培养液培养48 h后,Tip划痕法造细胞迁移模型,分别加入含 0%、0.5%、1%、2%、4%、6%胎牛血清的完全培养液 (考察血清浓度),分别培养6、8、10、12、14、16 h后 (考察培养时间),观察细胞迁移情况。EGF、AG1478和白术提取物则在建立实验模型后加入培养液,作用质量浓度分别为30、100、50、100、200μg/mL。
2.4 细胞迁移实验方法 接种细胞前先用红色标记笔在6孔板各孔底部水平方向划5条线,便于选取准确的拍照位置。细胞接种于6孔板48 h后,吸弃培养液,用1 mL移液枪头(Tips)在6孔板各孔中央沿直径方向轻轻划一条痕,划痕时移液枪头与6孔板成45度角。用PBS清洗细胞表面2次以去除漂浮的细胞和细胞残骸,吸弃PBS。加入培养液培养相应时间后于划痕和标记线的交叉部位进行拍照记录。用NIH Image软件(版本1.58)测量划痕面积。IEC-6细胞迁移率等于(S0-ST)/ S0×100% (S0,0小时划痕形成的面积;ST,培养T h后划痕形成的面积)。每组3个复孔,所以n=15。
2.5 统计学处理 数据采用均数±标准差 (x±s)表示,采用SPSS 17.0统计软件分析,数据先进行方差齐性检验,然后方差分析,采用Dunnett法进行组间比较,以P<0.05为差异有统计学意义。
3 结果
3.1 细胞接种密度对IEC-6细胞迁移的影响。课题组首先考察了IEC-6细胞的接种密度对细胞迁移的影响,结果见图1。数据显示,当细胞以0.25×105个/mL的密度接种时,迁移率为0,可能是由于数量太少不足以在6孔板各孔中铺满,因而不能建立损伤后的迁移模型。当细胞分别以0.5、1、2、4、8×105个/mL的密度接种时,细胞均能贴壁铺满,Tips划痕后8 h观察,各组的迁移 率 分 别 为 23.95%、36.03%、44.73%、53.50%、56.60%,迁移率随着密度的增加而提高。实验过程中还发现,当接种的细胞密度为2或者大于2×105个/mL时,6孔板底部形成了多层贴壁的状况,培养液中出现大量的漂浮的死细胞,提示接种密度不能大于2×105个/mL。为了使该迁移模型在后续的药效学实验中能呈现正向促进和反向抑制的效果,课题组最终选择1×105个/mL为最佳接种密度。
3.2 划痕后不同观察时间IEC-6细胞的迁移情况。
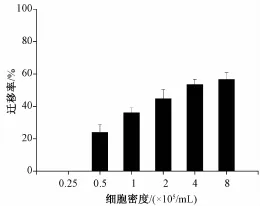
图1 细胞接种密度对IEC-6细胞迁移的影响Fig.1 Effect of cell density on IEC-6 cellm igration
黏膜损伤后的上皮快速修复与时间紧密相关。本实验考察了Tips划痕后不同时间段IEC-6细胞的迁移率。结果见图2,数据显示,迁移率随着培养时间的延长而增加,损伤后6、8、10、12、14 h后迁移率分别为 28.76%、40.00%、51.18%、61.69%、68.97%。由于黏膜损伤后的修复主要包括上皮细胞迁移、增殖和分化等过程,并且随着损伤时间的增加,细胞增殖和分化逐渐发挥主要作用[3],本研究旨在建立黏膜损伤修复早期的细胞迁移模型,因此,课题组选择划痕后8 h为最佳观察时间。

图2 划痕后不同时间段对IEC-6细胞迁移的影响Fig.2 Effect of scratch at different times on IEC-6 cellm igration
3.3 接种后不同血清浓度对IEC-6迁移的影响
胎牛血清 (FBS)是由血浆去除纤维蛋白而形成的一种很复杂的混合物,它含有各种血浆蛋白、多肽、脂肪、碳水化合物、生长因子、激素、无机物等,这些物质可促进体外培养细胞的生长、黏附、增殖[4]。因此,控制血清浓度对IEC-6细胞迁移模型的建立至关重要。图3结果显示,在不含血清的培养液中,IEC-6细胞也表现出迁移的能力 (迁移率为11.89%),但细胞形态发生了明显的变化,缺乏血清导致细胞萎缩、变形、脱落。当血清浓度为0.5%时,细胞状态稍微改善,迁移率提高至26.56%,但仍然可以在培养液中看见一些悬浮的死细胞。当血清浓度为1%和2%时,迁移率分别提高至40.7%和41.52%,细胞恢复至正常状态。当血清浓度为4%和6%时,迁移率分别为50.25%和55.63%。以上结果的偏差可能是由于血清浓度的提高促进了IEC-6细胞增殖,细胞数量增加,细胞生长加快。为了使细胞增殖对细胞迁移的影响降到最低,课题组最终选择1%的血清浓度为最佳培养条件。
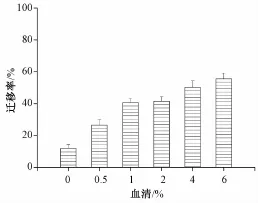
图3 不同血清浓度对IEC-6细胞迁移的影响Fig.3 Effect of different serum concentrations on IEC-6 cellm igration
3.4 IEC-6细胞迁移模型的评价 表皮生长因子(EGF)是机体胃肠道发育和损伤修复的主要营养因子,可促进胃肠上皮细胞迁移,EGF是与靶细胞膜上表皮生长因子受体 (EGFR)结合后发挥生物学效应,EGFR普遍存在于胃壁细胞、十二指肠黏膜上皮细胞和小肠上皮细胞[5]。本实验采用外源性的EGF和EGFR阻断剂AG1478来评价Tips划痕法建立的迁移模型。结果如图4所示,IEC-6细胞以1×105个/mL的密度接种于6孔板,Tips划痕后加入含1%FBS的培养液培养8 h,空白组细胞迁移率为42.27%,EGF明显地促进了IEC-6细胞迁移,细胞迁移率为70.10% (与空白组比较P<0.01);加入AG1478则明显抑制了细胞迁移,迁移率为25.73% (与空白组比较P<0.01)。该实验结果提示本课题组建立的IEC-6细胞迁移模型可检测药物的正向促进迁移作用和负相抑制迁移作用。
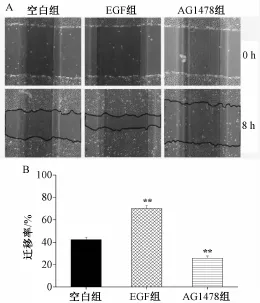
图4 EGF和AG1478对IEC-6细胞迁移的影响(n= 15,x±s)Fig.4 Effect of EGF and AG1478 on IEC-6 cell m igration.A.diagram of cell m igration induced by Tips scratch;B.quantitative analysis of cell m igration rate of each group(n=15,x±s)
3.5 白术、黄芪、党参提取物对IEC-6细胞迁移的影响 本课题组前期采用手术刀片划痕法建立了IEC-6细胞损伤后的迁移模型,并发现益气健脾中药白术、黄芪、党参具有促进IEC-6细胞迁移的作用,其机制可能与影响细胞内多胺信号通路的相关指标表达有关[6-9]。本实验采用Tips划痕法迁移模型考察白术提取物对IEC-6细胞迁移的作用效果,旨在进一步验证Tips划痕法模型的准确性和可行性。白术提取物对IEC-6细胞迁移的影响结果见图5A、B。空白组胞迁移率为 35.78%,低剂量(50μg/m L)的白术提取物并没有明显地影响细胞迁移速度 (迁移率为 35.5%),中剂量 (100 μg/mL)和高剂量(200μg/mL)的白术提取物则明显地促进了IEC-6细胞迁移,迁移率分别为66.43%和67.1% (与空白组比较,均P<0.01)。
黄芪提取物和党参提取物对IEC-6细胞迁移的结果见图5C。本实验中空白组细胞迁移率为37.63%,50、100、200μg/mL的黄芪提取物均可促进IEC-6细胞迁移,迁移率分别为58.43%、64.32%、65.86%,与空白组比较,均P<0.01。党参提取物低、中、高剂量组 (50、100、200 μg/mL)的细胞迁移率分别为59.33%、62.14%和66.25%,均显著高于空白组细胞迁移率 (与空白组比较,均P<0.01),提示党参提取物可促进IEC-6细胞迁移。这些实验结果与本课题组前期手术刀片划痕法的结果相吻合,提示本研究建立的Tips划痕法迁移模型稳定可靠,可以作为实验模型用于胃肠黏膜损伤后快速修复过程的体外药效研究。

图5 白术、黄芪和党参提取物对IEC-6细胞迁移的影响(n=15,x±s)Fig.5 Effects of Atractylodesmacrocephalae Rhizoma,AstragaliRadix,and Codonopsis Radix extracts on IEC-6 cellm igration(n=15,x±s)
4 讨论
人体消化道黏膜表面上皮是由大量的多功能的上皮细胞组成,这些上皮细胞具有很强的再生能力,能保持每24~96 h更新一次。因此胃肠道黏膜在损伤后其表面上皮具有快速重建完整性的能力。上皮表面连续性的重建至少是通过三种不同的机制完成的[10]。首先,靠近损伤部位的上皮细胞向损伤区域迁移,并逐渐覆盖损伤的裸露部位。这些迁移至损伤区域的上皮细胞并未开始分化,它们的细胞骨架发生重组,接着形成伪足样结构,当损伤部位完全密封后才开始逐渐分化。本课题组又把这个过程称为黏膜整复。无论是在体内环境还是体外研究,胃肠黏膜上皮整复均发生在损伤后的几个小时之内[2]。其次,为了补充细胞池损失的细胞,上皮细胞接着会发生增殖。最后,为维持黏膜上皮的各种功能活性,未分化的上皮细胞逐渐成熟并分化。为方便研究,人为地将黏膜损伤修复划分为三个过程,事实上,这3种痊愈机制在体内并不是三个独立的过程,它们往往相互重叠,本研究主要讨论的是黏膜损伤后的第一个快速修复步骤—上皮细胞迁移过程。
IEC-6细胞来源于正常大鼠的小肠隐窝,其未分化的特性很好的模拟了人体的胃肠黏膜环境,人们普遍将其应用于胃肠黏膜损伤的体外研究[11]。目前对IEC-6细胞损伤模型研究最多的两个学术团队分别是美国马里兰大学的Jian-ying Wang团队[12]和美国田纳西州大学健康科学中心的Leonard R. Johnson团队[13]。前者主要采用手术刀片划痕法建立IEC-6细胞损伤模型,后者则采用Tips划痕法建立IEC-6细胞损伤后迁移模型。本课题组前期采用手术刀片划痕法建立IEC-6细胞迁移模型,研究发现许多益气健脾中药的不同提取部位如黄酮、皂苷、多糖部位均可促进IEC-6细胞迁移,其机制与影响细胞内多胺含量有关[8-9,14-15]。但在实验中手术刀片划痕法对实验者要求甚高,为了达到理想的实验效果,需花大量的时间进行练习;即使是熟练操作的实验人员在同一次实验中也不可能全部划出又细又直的划痕,而划痕的粗细直接影响细胞迁移的速度,因此划痕的质量直接决定了实验结果;由于手术刀片划痕法存在操作不便、易产生误差和假阳性结果等缺点,因此本研究考察了另一种划痕损伤的方法,即Tips划痕法。
为建立稳定、可靠的Tips划痕法模型,本研究对IEC-6接种的细胞密度、划痕后培养时间和培养液中血清浓度进行了考察,并采用具有促进细胞迁移作用的EGF、白术提取物、黄芪提取物和党参提取物以及具有抑制细胞迁移作用的EGFR受体阻断剂AG1478进行了验证。结果发现,当IEC-6细胞接种数量为1×105个/mL,给药后培养时间8 h以及1%的血清浓度为建立Tips划痕法模型的最佳条件。在验证该模型时,发现EGF显著地促进了IEC-6细胞迁移,AG1478则抑制了IEC-6细胞迁移,同时发现中剂量和高剂量 (100和200 μg/mL)的白术提取物可促进IEC-6细胞迁移,此外,50、100、200μg/mL的黄芪提取物和党参提取物均可促进IEC-6细胞迁移。这些结果提示Tips划痕法建立的迁移模型具有可靠性和稳定性的特点。
祖国医学认为,脾胃为气血生化之源,后天之本。脾虚证患者和大鼠的胃肠黏膜都表现出上皮细胞脱落、坏死的情况。因此可以认为胃肠黏膜损伤是脾虚证的重要病理基础[16]。胃肠黏膜保护是中医 “脾”功能的重要内容,也是益气健脾中药的重要作用机制之一。本课题组前期的研究发现益气健脾中药促进胃肠黏膜损伤后修复的作用机制与增加细胞内多胺水平有关。而在本研究建立Tips划痕法后,课题组的研究将从多胺介导的相关信号通路转向EGFR介导的下游信号通路,Tips划痕法模型的建立为本课题组后续的研究建立了良好的工作基础。
[1]Mammen JM,Matthews JB.Mucosal repair in the gastrointestinal tract[J].Crit CareMed,2003,31(Suppl8):S532-537.
[2]Dignass A U.Mechanisms and modulation of intestinal epithelial repair[J].Inflamm Bowel Dis,2001,7(1):68-77.
[3]Iizuka M,Konno S.Wound healing of intestinal epithelial cells[J].World JGastroenterol,2011,17(17):2161-2171.
[4]Bieback K.Platelet lysate as replacement for fetalbovine serum in mesenchymal stromal cell cultures[J].Transfus Med Hemother,2013,40(5):326-335.
[5]Jones S,Rappoport JZ.Interdependent epidermal growth factor receptor signalling and trafficking[J].Int JBiochem Cell Biol,2014,51(1):23-28.
[6]胡 灿,李茹柳,卢文彪,等.IEC-6细胞迁移药理实验模型建立的研究[J].中药材,2011,34(5):738-746.
[7]胡 灿,李茹柳,王 静,等.黄芪和白术提取物对IEC-6细胞迁移的影响[J].中药新药与临床药理,2011,22(1):61-65.
[8]Song H P,Li R L,Chen X,et al.Atractylodesmacrocephala Koidz promotes intestinalepithelial restitution via the polyamine-Voltage-gated K(+)channel pathway[J].J Ethnopharmacol,2014,152(1):163-172.
[9]宋厚盼,李茹柳,王一寓,等.白术提取物对IEC-6细胞迁移过程多胺信号通路钙离子调控的影响[J].中华中医药杂志,2014,29(5):1361-1367.
[10]Kemmerly T,Kaunitz J D.Gastroduodenal mucosal defense[J].Curr Opin Gastroenterol,2013,29(6):642-649.
[11]Gao JH,Guo L J,Huang Z Y,et al.Roles of cellular polyamines in mucosal healing in the gastrointestinal tract[J].J Physiol Pharmacol,2013,64(6):681-693.
[12]Rao JN,Rathor N,Zhuang R,et al.Polyamines regulate intestinal epithelial restitution through TRPC1-mediated Ca(2)+ signaling by differentially modulating STIM1 and STIM2[J]. Am JPhysiol Cell Physiol,2012,303(3):C308-317.
[13]Ray R M,Bhattacharya S,Johnson L R.EGFR plays a pivotal role in the regulation ofpolyamine-dependentapoptosis in intestinal epithelial cells[J].Cell Signal,2007,19(12):2519-2527.
[14]李茹柳,曾 丹,温 鹏,等.党参黄酮提取物对小肠上皮细胞迁移及多胺的影响[J].中药新药与临床药理,2014,25(5):523-526.
[15]王一寓,李茹柳,宋厚盼,等.白术多糖对IEC-6细胞迁移及细胞生长的影响[J].中药药理与临床,2014,30(4):51-54.
[16]尹光耀,张武宁,何雪芬,等.脾虚证胃粘膜组织细胞病理学研究[J].中国中西医结合杂志,1999,19(11):660-663.
Study on the effect of Baizhu,Huangqi,and Dangshen on promoting IEC-6 cell repair after injury
SONG Hou-pan, XIE Meng-zhou, HU Zhi-xi, HUANG Hui-yong*, CAIXiong*
(Institute of TCM Diagnostics,Hunan University of Chinese Medicine,Changsha 410208,China)
AIMTo study the effect of Baizhu(Atractylodesmacrocephalae Rhizoma),Huangqi(Astragali Radix),and Dangshen(Codonopsis Radix)extracts on the rapid repair of gastrointestinal mucosa injury in vitro.METHODSThe gastrointestinalmucosa injurymodel was established by Tips scratch method.The effect of three kinds of extracts on the repair was studied in three areas:different cell seeding densities,rapid repair time after the scratch,and serum concentration.The cellmigrationmodelwas then evaluated by EGF and AG1478.Finally,we examined the effectof three kinds of extracts on IEC-6 cellmigration.RESULTS(1)The optimal culture density of intestinal epithelial cell(IEC-6)was1×105 cells/mL;(2)IEC-6 cellmigration rate should be calculated 8 h after scratch;(3)The serum concentration of 1%was the most suitable concentration;(4)Epidermal growth factor(EGF)significantly promoted IEC-6 cellmigration,while AG1478 significantly inhibited IEC-6 cellmigration;(5)Baizhu,Huangqi,and Dangshen extracts all increased the rate of IEC-6 cellmigration.CONCLUSIONTraditional Chinesemedicines of replenishing qi to invigorate the spleen can promote the repair of gastrointestinalmucosal injury,whether the mechanism is related to EGFR signaling pathway remains to be further studied.
gastrointestinalmucosal injury;intestinal epithelial cell;cellmigration model;epidermal growth factor(EGF);Bazhu(Atractylodesmacrocephalae Rhizoma);Huangqi(Astragali Radix);Dangshen(Codonopsis Radix)
R285.5
:A
:1001-1528(2015)06-1170-06
10.3969/j.issn.1001-1528.2015.06.004
2014-10-28
国家自然科学基金项目 (81373540);湖南省中医药科研计划重点项目 (201308);湖南省教育厅科学研究重点项目(12A107);湖南中医药大学中医诊断学国家重点学科开放基金项目 (2013ZYZD10);湖南省科技重大专项 (2014FJ1007)
宋厚盼 (1988—),男,博士,讲师,从事中医诊断学和中药消化道药理学研究工作。E-mail:pansyy-2008@163.com
*通信作者:蔡 雄 (1976—),男,博士,教授,博士生导师,从事中药抗炎免疫药理学和分子生物学与遗传学研究。E-mail:caix12@qq.com黄惠勇 (1963—),男,博士,教授,博士生导师,从事中医病证诊断规范及信息处理研究。E-mail:huanghy@126.com

